低温对腋路臂丛神经阻滞罗哌卡因半数有效浓度的影响
2019-12-30张忠其林卓鹏张奕文邢祖民
张忠其 林卓鹏 刘 念 张奕文 邢祖民
外周神经阻滞与全身麻醉相比,在不良反应的发生率和术后镇痛需求方面具有一定优势。研究[1-2]发现,使用不同温度的局部麻醉药进行外周神经阻滞,能影响其麻醉起效时间和维持时间。本研究团队的前期研究[3]结果显示,使用低温低容量局部麻醉药罗哌卡因进行臂丛神经阻滞能产生更强的麻醉作用,且麻醉起效时间更快,维持时间更长。上述研究结果表明,使用低温局部麻醉药罗哌卡因进行神经阻滞具有一定优势,但用于神经阻滞的最适宜浓度目前鲜见报道。本研究通过Dixon-Massey法比较经超声引导下腋路臂丛神经阻滞低温(4 ℃)与室温(23 ℃)罗哌卡因的半数有效浓度(EC50),旨在为外周神经阻滞时局部麻醉药的使用方法提供参考。
1 对象与方法
1.1 研究对象 本研究已经在中国临床中心注册(注册号:ChiCTR1800016721),经医院伦理委员会批准,并由患者或家属签署麻醉知情同意书。选择2018年6—10月在南方医科大学顺德医院和顺德和平外科医院择期行单侧手部手术的患者60例,均为美国麻醉医师协会(ASA)分级Ⅰ或Ⅱ级,随机分为2组,每组30例。低温组麻醉药物为4 ℃罗哌卡因+1 μg/kg右美托咪定,室温组麻醉药物为23 ℃罗哌卡因+1 μg/kg右美托咪定,每组容量定量为25 mL。排除标准:无本研究所用药物过敏史,无经腋路臂丛神经阻滞禁忌证,近期无使用其他镇痛药物史等。
1.2 麻醉方法 手术室温度设定在23 ℃,所有患者入手术室后均予常规吸氧并连接多功能监护仪监测平均动脉压(MAP)、心率、心电图(ECG)与脉搏血氧饱和度(SpO2),并使用加温系统(温度设置为40 ℃),将测温探头置于患者前额,持续监测前额皮肤的体表温度。常规开放外周静脉通道,患者取仰卧位,上肢外展90°。神经阻滞技术操作参照前期研究[3],注射药液为0.9%氯化钠溶液稀释的罗哌卡因混合右美托咪定25 mL。低温组术前预先配制药液,密封无菌保存于4 ℃冰箱30 min~1 h;室温组使用手术室温度保存的已配制好的药液。注药后每5 min测定桡神经、正中神经、尺神经和肌皮神经皮肤阻滞区域的痛觉疼痛感觉(针刺痛觉评分标准: 0分,正常;1分,痛觉减退;2分,痛觉消失)。记录痛觉消失时间,即阻滞起效时间;痛觉消失(2分)至正常(0分)的时间,即阻滞维持时间。两组初始的罗哌卡因浓度设定为0.5%,采用Dixon-Massey法确定下一患者罗哌卡因浓度。若阻滞开始至30 min内感觉神经被阻滞至能满足手术切皮要求则定义为“成功”,否则定义为“失败”。如“成功”,下一患者则降低一个浓度,相反则升高一个浓度,相邻浓度相差比值为1.2。对神经阻滞效果不全的患者,加用舒芬太尼0.1~0.2 μg/kg静脉注射行强化麻醉,仍不能满足手术要求者,改行全身麻醉。镇静评分(Ramsay法)标准:1分,焦虑、烦躁;2分,安静;3分,对指令有反应;4分,睡眠状态但可唤醒;5分,对大声刺激反应表现迟钝;6分,无反应。镇静评分≥5分定义为过度镇静。以术中心率和血压降低为基础值的20%定义为心率减慢和血压降低;以术中SpO2低于90%定义为呼吸抑制;以前额皮肤体表温度低于36 ℃为低体温。当出现心率减慢或血压降低时,给予阿托品或麻黄素;当出现呼吸抑制时,充分给氧,必要时予正压通气。
1.3 观察指标 按顺序记录所有患者的用药浓度,记录入手术室和神经阻滞30 min后的MAP、心率,记录阻滞起效时间、阻滞维持时间和不良反应(恶心、呕吐、寒战、低体温、注射痛、过度镇静、呼吸抑制、低血压、心动过缓、止血带反应)。
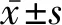
2 结 果
2.1 一般资料比较 两组间的性别构成、ASA Ⅰ/Ⅱ分级构成、年龄、身高、体重、手术时间、阻滞维持时间的差异均无统计学意义(P值均>0.05), 低温组阻滞起效时间显著短于室温组(P<0.05)。见表1。

表1 两组患者一般资料比较 (N=30)
与室温组比较:①P<0.05
2.2 阻滞前后30 min的MAP和心率比较 两组间神经阻滞前和阻滞后30 min MAP和心率的差异均无统计学意义(P值均>0.05);两组阻滞后30 min的MAP和心率均显著低于同组阻滞前(P值均<0.05)。见表2。


组别MAP(mmHg)阻滞前阻滞后30 min心率(次/min)阻滞前阻滞后30 min低温组96.3±10.581.8±8.7①72.0±11.964.8±8.2①室温组98.9±11.379.2±8.8①70.1±14.162.7±9.6②
1 mmHg=0.133 kPa。与同组阻滞前比较:①P<0.01,②P<0.05
2.3 不良反应比较 两组患者均未发生恶心、呕吐、低体温、过度镇静、呼吸抑制等不良反应。低温组发生寒战1例、注射痛3例、低血压2例、心动过缓3例、止血带反应2例,室温组发生低血压1例、心动过缓1例、止血带反应4例,两组间不良反应发生情况的差异均无统计学意义(P值均>0.05)。
2.4 罗哌卡因EC50值比较 低温组罗哌卡因的EC50为0.154%(95%CI为0.124%~0.191%),室温组罗哌卡因的EC50为0.219%(95%CI为0.180%~0.267%),两组间的差异有统计学意义 (Z=2.674,P=0.008)。低温组和室温组均有11例患者阻滞失败,室温组的失败患者的罗哌卡因浓度普遍高于低温组。见图1、2。

图1 低温组患者腋路臂丛神经阻滞结果

图2 室温组患者腋路臂丛神经阻滞结果
3 讨 论
低温本身不能产生麻醉作用,但是低温能使组织局部血管收缩,作用于神经产生局部麻醉样效应。有研究[4-6]结果显示,使用不同温度的局部麻醉药进行外周神经阻滞,所需的药物浓度、剂量、起效时间和维持时间都有所不同。温度越低,阻滞神经所需要的局部麻醉药浓度越低[5]。认为其可能的原因是局部麻醉药的解离常数随着温度的降低而增加,当局部麻醉药在低温下注射,将以更多的离子化形式存在,使之能更好地穿透神经纤维,加快麻醉起效时间,增强麻醉效能[7]。本研究结果显示,低温(4° C)比室温(23 °C)更能降低阻滞所需罗哌卡因EC50(0.154%比0.219%,P<0.05);经过低温处理后的局部麻醉药用于臂丛神经阻滞能明显降低局部麻醉药所需的浓度,且这种下降比例达29.7%。
目前,临床上通常将右美托咪定作为一种佐剂添加至局部麻醉药中,以增强麻醉效果,但可能会发生患者心率减慢、血压降低等不良反应[8]。Keplinger等[9]研究发现,局部麻醉药中添加右美托咪定进行外周神经阻滞,感觉阻滞的平均持续时间、镇静程度与右美托咪定呈剂量依赖性,认为添加100 μg右美托咪定的镇静和阻滞效果最佳。本研究在罗哌卡因中加入右美托咪定剂量1 μg/kg,所有患者总剂量并未超过100 μg,所有患者均未出现过度镇静现象。右美托咪定具有稳定血流动力学的作用,但是本研究加入1 /mg/kg右美托咪定阻滞30 min后,低温组与室温组间MAP和心率的差异无统计学意义,可见不同温度的局部麻醉药对血流动力学并无影响;然而,两组阻滞后30 min MAP和心率均较本组基础值显著降低,但降低值均在可接受范围内。不良反应方面,低温组分别有2例低血压和3例心动过缓,两组间不良反应发生情况的差异无统计学意义,但是仍需注意防范术中可能出现血流动力学不稳定。因此,为了降低不良反应的发生率,可考虑进一步减少混合的右美托咪定剂量。另外,本研究采用不同浓度罗哌卡因,通过序贯图发现,低温组使用低浓度罗哌卡因的患者数量更多、起效时间显著缩短,但两组间阻滞维持时间的差异无统计学意义。因此,使用同等浓度不同温度的罗哌卡因进行外周神经阻滞的阻滞起效时间和维持时间可能存在更大的差异。
低温注射可产生更多的寒战和注射痛,Hogan等[10]的meta分析结果显示,注射痛的产生与注射速度、注射部位、注射药物温度和参与者年龄等密切相关,将局部麻醉药的温度升高能明显降低注射痛的发生率。本研究中低温组有3例注射痛患者,室温组无1例注射痛患者,两组间的差异无统计学意义,在临床麻醉操作过程中可通过减慢注药速度以减少注射痛的发生。也有研究使用更高温度的局部麻醉药,发现能同时加快感觉与运动阻滞起效时间[11],并有效降低寒战发生率[12]。本研究使用低温罗哌卡因注射过程中仅1例患者发生寒战,体温监测过程中并未发生低体温现象,可能的原因:①低温局部麻醉药使用容量较小,不足以影响体温变化;②整个围术期给予患者适当的保温措施。
本研究的局限性:①Dixon-Massey法最大的优势是利用最小的样本量即可得到较准确的结果[13],但每次得出的罗哌卡因浓度作为一个独立的结果会影响下一个浓度的选择,最终的结果可能会因为个体对疼痛的敏感程度不同导致结果不准确,所以需要更多的样本量,才能得出更准确的结果;②在临床麻醉神经阻滞过程中人为操作失误,也可能造成结果不准确,例如,低温组第2例患者,使用较高的罗哌卡因浓度(0.42%)阻滞失败,可能为操作失误,也可能是其自身体质的原因。
综上所述,使用低温(4 °C)罗哌卡因行臂丛神经阻滞比使用室温(23 °C)更能降低罗哌卡因EC50,且无明显不良反应,值得在临床推广应用。
