绝经后女性宫颈癌前病变筛查方法的比较
2019-12-27刘荣马焱
刘荣,马焱
宫颈癌是妇科常见的恶性肿瘤之一,在全球女性恶性肿瘤中位列第三,仅次于乳腺癌和肺癌[1]。在美国,随着宫颈癌前病变筛查方法的普及和宫颈人乳头瘤病毒(human papillomavirus,HPV)疫苗的应用,近十年内宫颈癌的发病率和死亡率呈现逐年下降趋势[2-4],但在我国一些地区宫颈癌的发病率并未出现下降趋势,并且在75~79岁达到发病小高峰[5],因此绝经后女性宫颈癌及癌前病变的筛查仍值得关注。绝经后女性体内雌激素水平下降,生殖系统萎缩性改变,抵御外界能力下降[6],更容易发生HPV感染和细胞学变化。作为绝经后女性宫颈癌前病变筛查方法,宫颈细胞学检查、高危型HPV(high-risk HPV,HR-HPV)检测、P16/Ki-67免疫组织化学(免疫组化)哪种更具有临床应用价值?本研究对此进行了探讨比较。
1 资料与方法
1.1 临床资料统计2017年10月—2018年9月天津市第一中心医院妇科门诊行阴道镜下宫颈活检患者。选取行宫颈液基薄层细胞学检查(thinprep cytological test,TCT)、HR-HPV检测、阴道镜检查及阴道镜下宫颈活检的113例自然绝经后的女性作为研究对象,年龄 45~79岁,平均(56.9±6.2)岁;绝经时间 1~28年,平均(7.4±5.3)年;孕次 1~6 次,平均(3.2±1.3)次;产次 1~4 次,平均(1.5±0.8)次。入选患者均按照中国优生科学协会阴道镜和宫颈病理学分会(Chinese Society for Colposcopy and Cervical Pathology of China Healthy Birth Science Association,CSCCP)宫颈癌筛查结果异常的管理流程[7]行阴道镜检查及宫颈活检术+宫颈管搔刮术(endocervical curettage,ECC)。将研究对象根据是否存在HR-HPV感染分为阳性组和阴性组,同时根据宫颈细胞学检查结果,将研究对象重新分为高风险组 [细胞学结果级别高于意义不明的非典型鳞状上皮细胞(atypical squamous cells of unknown significance,ASCUS)]和低风险组(细胞学结果级别为ASCUS和阴性)。
1.2 纳入和排除标准纳入标准:①自然绝经1年及以上者;②所有患者均行宫颈多点活检+ECC。排除标准:①既往子宫或宫颈手术、治疗史者;②近期使用激素类药物者;③合并严重内科疾病者;④病史及临床病理资料不完整者。
1.3 检测方法
1.3.1 宫颈细胞学检查 检查前72 h禁阴道冲洗及上药,前24 h禁性生活。暴露宫颈,无菌棉签轻轻擦拭干净宫颈表面分泌物,用一次性宫颈脱落细胞采集刷于宫颈鳞-柱交界转化区处顺时针旋转5圈,置于装有细胞保存液的专用容器内。经制片染色后,由专业细胞学诊断医师阅片诊断结果。
1.3.2 HR-HPV分型检测 一次性宫颈拭子插入宫颈外口,于宫颈管内顺时针旋转5圈留取标本,置于保存液内。采用上海之江生物科技有限公司聚合酶链反应(PCR)扩增技术对宫颈标本的DNA进行扩增,判断HPV病毒基因是否存在及病毒分型。检测到的HPV分型包括HPV6、HPV11低危型和包括 HPV16、HPV18、HPV52、HPV58 等 15 种高危型。
1.3.3 阴道镜下活检 患者检查前48 h内禁性生活、阴道冲洗及上药,在排除生殖道急慢性炎症后,取膀胱截石位,充分暴露宫颈,盐水棉球拭净宫颈表面分泌物,使用光电一体化阴道镜成像系统(欧普原装进口光电阴道镜)观察宫颈表面分别经过5%醋酸溶液和复方碘溶液(卢戈液)处理后的形态学变化,长活检钳对宫颈可疑病变(如醋白上皮、异型血管、碘染不着色区等)处取活检并常规行宫颈管搔刮。活检标本置入10%甲醛溶液(福尔马林溶液)固定后送检病理。标本全部经取材、脱水、组织包埋、切片、染色(HE染色及免疫组化染色)、封片后,由专业病理诊断医师阅片诊断。诊断结果分为炎症、宫颈上皮内瘤变(CINⅠ、CINⅡ、CINⅢ)和宫颈癌。定义免疫组化阳性为P16蛋白阳性及Ki-67蛋白于细胞中上层表达。
1.4 统计学方法采用SPSS 22.0统计软件进行分析。定性资料用率表示,组间比较采用卡方检验,当单元格理论频数<1时,采用Fisher确切概率法。不同细胞学类型组织学结果比较采用秩相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 宫颈细胞学、HR-HPV检测及宫颈活检病理结果113例患者中,宫颈细胞学结果正常(NILM)者23例(占20.35%);细胞学为ASCUS者42例(检出率为37.17%);细胞学高风险组有48例,其中不除外高度鳞状上皮内病变的非典型鳞状细胞(atypical squamous cells cannot exclude HSIL,ASC-H)、低度鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)和高度鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL) 者分别有 18 例(15.93%)、20例(17.70%)和10例(8.85%)。HR-HPV阳性检出率为91.15%(103例),其中HPV16型检出率最高,为 32.74%(37例),其次为 HPV52型(13.27%,15例)和HPV18型(12.39%,14例)。
113例患者中,有37例活检病理结果为CINⅡ及以上(CINⅡ+),其中诊断为浸润癌者有10例(鳞癌9例、腺癌1例),CINⅢ者20例,CINⅡ者7例。活检组织学病理诊断为慢性宫颈炎和CINⅠ者分别有51例和25例,共占67.26%。
2.2 HPV检测在组织学CINⅡ+中的结果比较HPV阳性组中组织学CINⅡ+的检出率为33.98%(35/103)。绝经后女性HR-HPV感染分布与宫颈病变的分布差异无统计学意义(χ2=0.809,P=0.303),见表 1。
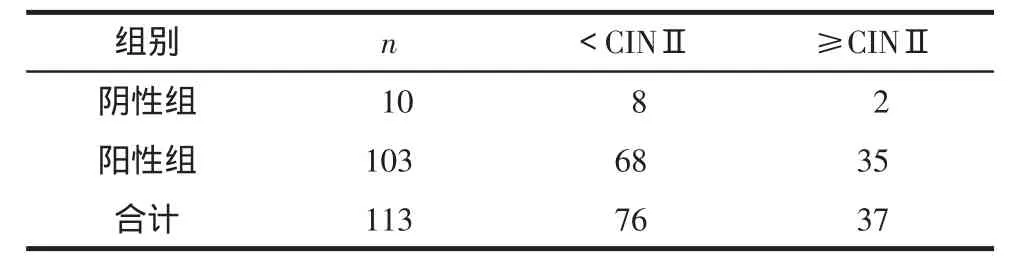
表1 HR-HPV检测在组织学CINⅡ+中结果比较(例)
2.3 不同细胞学类型组织学CINⅡ+结果比较本研究结果显示,细胞学高风险组中组织学CINⅡ+的检出率高于低风险组 [60.42%(29/48)vs.12.31%(8/65),χ2=29.018,P=0.000]。低风险组中宫颈组织学低度病变者占87.69%(57/65),并且宫颈细胞学NILM者有65.22%(15/23)组织学诊断为慢性宫颈炎。细胞学HSIL者宫颈活检后组织学也全部为HSIL(包括CINⅢ和宫颈癌)。宫颈活检组织学病变程度与宫颈细胞学严重程度呈弱正相关(r=0.389,P=0.000)。见表2。
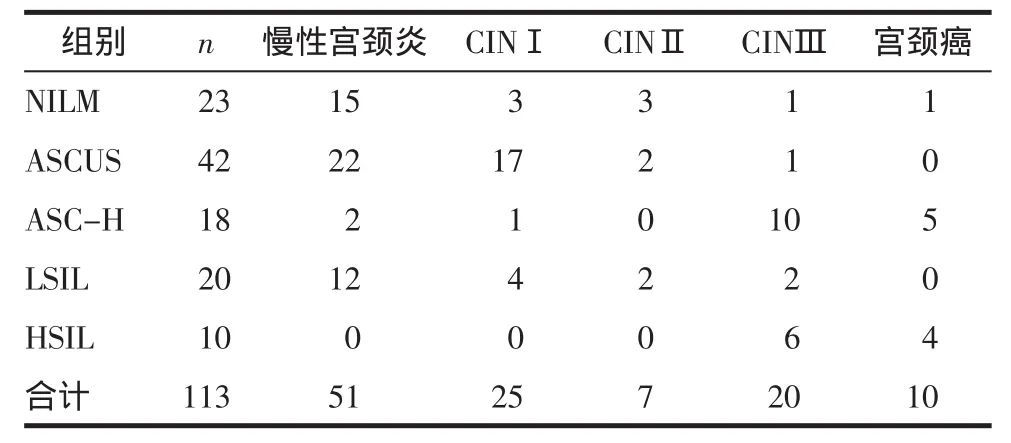
表2 不同细胞学类型组织学结果比较 (例)
2.4 宫颈细胞学与HPV检测对组织学CINⅡ+的作用比较HR-HPV检测的敏感度略高于宫颈细胞学筛查,但其特异度远低于细胞学筛查。细胞学筛查的阳性预测值(positive predict value,PPV)和阴性预测值(negative predict value,NPV)均高于宫颈 HRHPV筛查方法。见表3。
2.5 P16蛋白阳性及Ki-67在不同组织学类型中的分布比较113例患者中有23例免疫组化阳性,全部分布于CINⅢ及宫颈癌。免疫组化阳性组中宫颈高级别病变分布情况多于阴性组,差异有统计学意义[100%(23/23)vs.15.6(14/90),P=0.000]。见表4。
3 讨论
宫颈癌的发生、发展是一个连续的过程,其根本原因是HR-HPV的感染及其与宿主细胞DNA的整合。李威等[5]研究发现,天津市近6年(2007—2013年)内40~49岁和75~79岁是宫颈癌高发的年龄段。Yoo等[8]研究发现,美国南部地区一些种族人群(如非西班牙裔黑人)宫颈癌的发病率和死亡率随年龄的增长而增加。因此,绝经女性宫颈癌前病变的早期发现尤为重要,宫颈癌前病变的筛查应受到广泛重视。
TCT是我国现阶段宫颈病变早期筛查的最重要手段之一,是我国宫颈癌“三阶梯筛查”的主流方式[9]。宫颈TCT标本的采集和制片较大程度保留了宫颈上皮脱落细胞的形态,而且细胞采集刷可插入宫颈外口内,便于采集肉眼不易发现的病变。本研究中绝经后女性宫颈细胞学低风险组占57.52%,其中细胞学ASCUS检出率达到37.17%,这可能与绝经后女性激素水平下降,阴道黏膜萎缩,阴道内微生态环境改变引起的上皮细胞轻度炎症性或异质性改变有关。尽管本研究中宫颈细胞学低风险的女性有87.69%组织学诊断为慢性宫颈炎或宫颈CINⅠ级,但也有个别女性细胞学阴性而组织学为HSIL。绝经后特别是老年女性细胞学检查的难度增加,可能的原因有:①绝经后女性雌激素水平下降,宫颈鳞-柱交界内移至宫颈管内,细胞学取材困难,容易细胞数量不足或取不到病变细胞,致使细胞学标本不满意率增加;②绝经后女性宫颈上皮细胞以底层、旁基底层细胞为主,易受炎细胞的干扰,增加了细胞学判读的难度。本研究中细胞学为HSIL的女性仅占8.85%,但细胞学和组织学均为HSIL的准确度为100%。本研究还发现,细胞学高风险组中组织学CINⅡ+的检出率高于低风险组(P=0.000),提示绝经后女性宫颈细胞学级别越高,宫颈高级别病变检出率可能越高。这与王爱春等[10]、吴艳等[11]研究结果一致。然而,由于绝经后女性生理解剖的特殊性,宫颈癌前病变筛查和阴道镜检查的漏诊率不容忽视,单一的宫颈癌筛查方法并不能完全满足此类人群的筛查需要。
目前公认HR-HPV是宫颈癌的病因,大部分宫颈癌患者存在HR-HPV感染,尤其是HPV16、18型[12]。本研究中绝大多数绝经后女性感染了HR-HPV(91.15%),并且HPV16型为主要感染型别(32.74%),其次为HPV52型(13.27%)、HPV18型(12.39%)。但HR-HPV感染分布与宫颈病变的分布差异无统计学意义(P=0.303)。这表明绝经后女性宫颈HR-HPV感染提示了存在宫颈病变的风险,但高危型别尤其是致病力最强的HPV16和HPV18型对宫颈HSIL的检出率作用并不明显。这可能与本研究纳入的样本量不足和该年龄段人群疾病筛查意识薄弱有关。本研究还比较了宫颈TCT与HR-HPV检测对组织学HSIL检出作用的敏感度和特异度,结果显示宫颈细胞学对宫颈高级别病变检出的特异度优于HPV检测,PPV和NPV也高于HPV检测,能更有效地检出宫颈高级别病变,更具有临床指向作用。宫颈细胞学级别越高,越应引起临床医生的重视,便于早发现、早诊断、早治疗。
P16蛋白是细胞周期中的酶抑制剂,调控细胞周期从G1期至S期的进程[13]。Ki-67蛋白是与细胞增殖及CIN进展相关的核蛋白,正常细胞周期中仅分布于基底层[14]。Silva等[15]认为P16蛋白和Ki-67蛋白对宫颈浸润癌有诊断价值。李绍刚等[16]认为P16蛋白对绝经后女性宫颈癌前病变的诊断有帮助。本研究也比较了免疫组化(P16和Ki-67双阳性)在不同组织学类型诊断中的作用,结果表明,P16阳性及Ki-67于细胞中上层表达提示了宫颈高级别病变。因此,对于绝经后女性,免疫组化阳性需引起临床医生高度重视,应采取更积极的治疗方法。
综上所述,绝经后女性由于体内雌激素水平下降,宫颈上皮萎缩变薄,宫颈转化区内移,增加了阴道镜检查和宫颈癌前病变筛查的难度,容易忽视和漏诊癌前病变的发生。因此,宫颈癌前病变联合筛查的必要性不容小觑。同时,宫颈细胞学级别越高、免疫组化阳性程度越高,越应受到临床医生的重视,及时查明病变部位,减少不必要的损失。

表3 宫颈细胞学与HPV检测对组织学CINⅡ+的作用比较[%(n/n)]
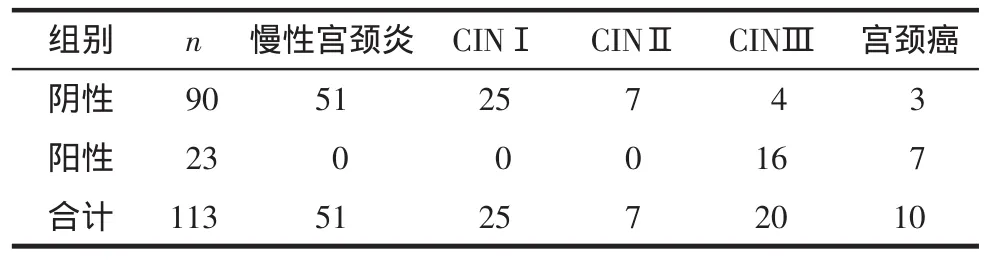
表4 免疫组化在不同组织学类型中的分布比较 (例)
