腹腔镜手术治疗肝脏巨大血管瘤疗效分析
2019-12-26蔡荣耀尹新民姚立波廖春红朱斯维
蔡荣耀,尹新民,姚立波,廖春红,朱斯维
(湖南省人民医院肝胆微创外科,湖南 长沙 410005)
随着人们健康体检意识的增强和检查手段的进步,肝血管瘤的检出率逐年增高,椐统计我国人群发病率为3/1 000~4/1 000[1],其成为肝脏最常见的良性肿瘤,确切的发病机制不详,多数无临床症状,也无需特殊治疗。然而巨大的肝脏血管瘤(直径>10 cm)病人常伴有腹痛、腹胀等临床症状,特别是瘤体生长速度过快,有破裂出血风险,或合并有凝血功能障碍的Kasabach-Merritt综合征病人应积极行手术治疗已成为共识[2]。过去传统的治疗方式是开腹手术,随着近年来腹腔镜手术技术水平的提高和医疗设备的更新,应用腹腔镜手术成功治疗肝血管瘤的报告逐渐增多。现将近3年间我院89例有症状的肝脏巨大血管瘤病人的诊治情况报告如下。
资料与方法
一、一般资料
收集我院肝胆外科2015年3月至2018年6月有症状的肝脏巨大血管瘤病人共89例,其中男性33例,女性56例,年龄28~63岁,中位年龄38岁。所有病人均有腹痛、腹胀不适或消化不良等临床症状,入院后经完善腹部彩超、腹部CT或MRI检查诊断为肝脏巨大血管瘤,瘤体直径为(11.6±1.4)cm(范围为10~16 cm),术前肝功能Child-Pugh分级均为A级,51例病人行腹腔镜手术,其中解剖性肝切除37例,不规则性肝切除和血管瘤剥除术共14例,有15例联合应用吲哚菁绿(ICG)荧光融合技术。38例病人行开腹手术。
二、手术方法
腹腔镜组:所有病人均采用气管插管全身复合麻醉,椐椐手术方式选择不同的体位,拟行右后叶切除者采用左侧倾斜45°~60°,右臂上抬固定;其他手术方式一般采用仰卧分腿位。常用四孔或五孔法,布孔原则是以拟切除肝叶(段)为中心呈扇形分布,观察孔位于其中心,主操作孔接近断肝平面。CO2建立气腹,气腹压保持在12~14 mmHg(1 mmHg=0.133 kPa)。先常规探查腹腔,观察肝脏的形态和颜色,初步了解血管瘤的大小及位置,为了进一步明确瘤体与周围肝脏重要管道结构的解剖关系常借助术中B超,部分病人我们采用了ICG荧光融合影像技术来确定瘤体边界和断肝平面,套通Winslow孔,预置第一肝门阻断带。解剖性肝切除其步骤如下:①游离并切断肝周韧带,而对于前入路右半肝切除可于断肝后再切断右三角、冠状韧带;②解剖第一肝门,必要时切除胆囊,分离出肝左或肝右动脉,夹闭后离断,分离出肝左、右门静脉,结扎或离断,此时一般于肝脏表面可见左右半肝缺血分界线;③解剖第二、三肝门,逐一分离出各支肝短静脉,双重夹闭后离断;④确定断肝表面并予以标记,必要时以Pringle法间断阻断第一肝门,运用“两步分层法”切除肝脏:第一步以超声刀切开肝包膜,由前至后,由下至上,由浅入深逐步薄化肝实质,遇较粗管道夹闭后切断,直至显露Glission鞘,继续以肝静脉为导向深入第二肝门,接近肝静脉根部;第二步以切割闭合器依次离断肝蒂和肝静脉,完成标本的切除。对于多发的、巨大的肝血管瘤,不允许行大范围规则性肝切除的病人,我们则采用不规则性肝切除或血管瘤剥除术,不规则性肝切除一般距离瘤体边缘约1 cm切开肝实质,肝断面以双极电凝逐一止血,较粗血管均夹闭后离断,完整切除瘤体及部分肝组织;若行血管瘤剥除法,则先充分显露肝血管瘤的假包膜,采用钝性推剥法分离瘤体,切勿进入瘤体内,否则会引起难以控制的大出血,必要时可自体血回输或中转开腹手术。标本切除后可予以剪碎装袋,稍稍扩张上腹部较大的切口后取出。生理盐水冲洗肝断面,双极电凝充分止血,较大出血点以Prolene线缝合,检查肝断面无出血、胆漏,留置腹腔引流管关腹。
开腹组:取右上腹J形切口,进腹探查,必要时用术中B超确定瘤体位置,充分游离肝脏,切断肝周韧带,常规用Pringle法阻断第一肝门,以钳夹法离断肝实质,断面较粗管道结扎后离断。解剖性肝切除时肝蒂及肝静脉的离断以门静脉钳夹闭后切断,断端以Prolene线连续缝合。
三、临床指标
统计两组病人术中出血量,手术时间,住院时间,记录胃肠功能恢复时间(肛门排气时间)和下床活动时间,利用疼痛视觉模拟评分(VAS)系统记录病人术后24 h评分,具体方法:让病人将主观感觉疼痛记录在一长10 cm标尺上,0 cm (0 分)表示无疼痛;10 cm(10分)表示剧痛,无法忍受;3分以下表示轻微疼痛,4~6分表示中度疼痛并影响睡眠,7~10分表示疼痛较剧,影响食欲和睡眠。
四、随访
所有病人随访截止时间为2019年6月,随访形式是门诊或电话联系,术后1月余进行第一次复查,以后每6个月复查一次,复查内容为肝功能检查,腹部彩超,上腹部CT或MRI等影像学检查。
五、统计学处理
结 果
一、两组病人观察指标比较
1.临床指标比较 与开腹组相比,腹腔镜组术中出血量明显减少,术后胃肠功能恢复时间、下床活动时间、住院时间均缩短,术后24 h疼痛评分较低(P<0.05),而手术时间差异无统计学意义(P>0.05)。见表1。
2.术后并发症发生率比较 腹腔镜组术后只有3例病人出现胸腔积液,均经保守治疗痊愈,无出血、胆漏等其他并发症,并发症发生率为5.8%;开腹组4例出现胸腔积液,其中1例经胸腔穿刺引流治愈,1例出现肺部感染,1例出现胆漏,1例出现粘连性肠梗阻,保守治疗痊愈,2例出现切口脂肪液化,总并发症发生率为23.7%,明显高于腹腔镜组,两组比较差异有统计学意义(χ2=5.916,P=0.015)。
二、术后情况及随访
89例病人中,术后病理提示海绵状血管瘤者84例,硬化性血管瘤2例,血管内皮瘤3例。两组均无死亡病例。术后随访时间为12~36个月,术后影像学复查未见血管瘤残留,随访期间未见复发。
讨 论
肝血管瘤是最常见的肝脏良性肿瘤,多数无临床症状,目前国内外普遍观点认为对于无症状的肝血管瘤建议以动态观察,定期随访为主[2]。尽管目前对于肝血管瘤的手术指征存在不少争议,但对于下列情况者我们建议应积极手术治疗:①瘤体直径>10 cm,且伴有腹痛、腹胀、消化不良等临床症状或伴有焦虑、精神负担过重等心理因素者;②肝占位病变不符合肝血管瘤典型影像学特征,不能排除恶性肿瘤者;③合并有严重并发症:自发性或创伤性瘤体破裂出血,或伴发Kasabach-Merritt综合征病人,此为手术绝对适应证;④随访期间,发现瘤体进行性增大,直径增速>2 cm/年。本组资料中所有病人血管瘤直径均超过10 cm且伴有不同的临床症状。而肿瘤的大小和位置并不是手术的禁忌证[3]。随着腹腔镜技术水平的提高,肝血管瘤的手术适应证可能还会进一步扩展。
肝血管瘤治疗方式多种多样,已有研究表明,对于肝血管瘤的手术治疗,腹腔镜手术较传统的开腹手术具有出血量少、住院时间短、术后并发症少、恢复快等优点[4-6]。本研究中腹腔镜组较开腹组术中出血量减少,术后胃肠功能恢复时间、下床活动时间、住院时间均缩短,术后疼痛评分较低,差异均有统计学意义,与文献报道一致。我们认为腹腔镜较开腹手术有以下优势:①腹腔镜有视野放大效应,有利于局部精细操作和止血;②由足至头端的视角和操作,有利于第三肝门的解剖;③腹腔镜高压的气腹状态以及低中心静脉压的控制,可有效减少术中出血;④腔镜下联合应用ICG荧光显像技术及术中B超有利于瘤体准确的定位和断肝平面准确的把握;⑤腹腔镜下应用“两步分层法”进行解剖性肝切除,简化了手术操作过程,使手术程序模式化[7-8];⑥双极电凝,超声刀,LigSure,TissueLink等腔镜下能量平台的使用,使止血更为容易;⑦日益娴熟的腹腔镜操作技术保证了手术的顺利进行;⑧腹腔镜在相对封闭的状态下完成手术,防止了术中体液的大量丢失,保证了内环境的稳定;⑨腹腔镜手术术者双手不直接接触腹腔脏器,减少了对胃肠脏器的干扰。近年来,加速康复外科理念在肝胆的应用日益受到重视,有研究表明,加速康复外科理念应用于腹腔镜肝切除可加速病人术后康复,缩短住院时间[9-10],腹腔镜技术本身作为一种微创技术,对病人机体创伤明显降低,有利于机体的恢复,符合加速康复外科基本要求。所有这些综合因素使接受腔镜手术的病人经受较小的创伤,所以病人术后疼痛感较轻,胃肠功能等恢复快,术后并发症也较少。本研究中51例腹腔镜手术病人仅有3例出现胸腔积液,经保守治疗痊愈,而开腹组38例病人除胸腔积液外还出现了肺部感染、粘连肠梗阻及切口脂肪液化等并发症,发生率明显高于腹腔镜组。在腹腔镜手术开展早期,手术时间较开腹稍长,随着操作技术水平的提高,手术时间逐渐缩短,所以总的手术平均时间是相当的,本研究中两组手术时间差异无统计学意义。
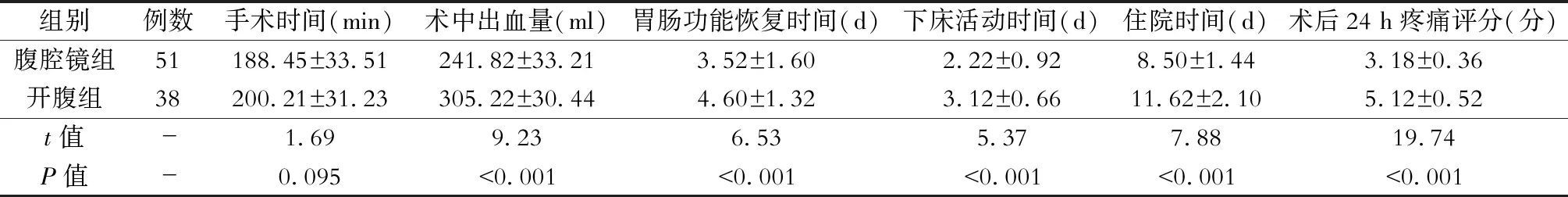
表1 两组病人临床指标比较
腹腔镜下解剖性肝切除治疗肝脏巨大血管瘤是安全可行的,因肝血管瘤病人很少有肝炎、肝硬化背景,其肝功能一般良好,只要残余肝脏体积足够,尽量施行解剖性肝切除,对于多发血管瘤或病变分散在多个肝叶(段)者,宜实行非规则性肝切除或血管瘤剥除术。本组51例腔镜手术病人中,施行解剖性肝切除37例,14例行非规则性肝切除或瘤体剥除术。尽管有研究表明,腹腔镜下肝血管瘤剥除术具有操作简单、安全可靠等优点[11],但对于巨大肝脏血管瘤,特别位于肝中叶或右后叶者,由于剥离面广,创面广泛渗血时有发生,若剥离时偏离正常间隙误入瘤体内,可导致难以控制的大出血,常为中转开腹的主要原因。相比之下,解剖性肝切除更为安全。在我们中心,对于左、右半肝的腹腔镜肝切除术常采用“两步分层法”,实行区域性或全肝血流阻断,采用“15 min+5 min”模式,同时控制中心静脉压在0~5 cmH2O(1 cmH2O=0.098 kPa)之间,可有效减少术中出血[12]。我们团队研究表明“两步分层法”在半肝切除中安全、有效、易行,可缩短手术时间,减少术中出血,减少并发症的发生[8]。
ICG荧光融合影像技术联合腹腔镜肝切除技术越来越成熟[13-14],其为腹腔镜下治疗肝脏巨大血管瘤提供了技术保障。我们中心也陆续开展了此类手术,主要是在肝脏恶性肿瘤和解剖性肝切除方面[15]。本组资料中,共有15例病人联合应用了荧光显像技术,其中3例是术前应用,术前2~7 d开始从外周静脉注射ICG(0.5 mg/kg),因巨大血管瘤挤压周围肝组织,导致ICG延迟排泄而在术中显影,可以此来标记肿瘤的边界。5例是术中应用,术中从外周静脉注射ICG(0.05 mg/kg),因肝血管瘤无正常肝组织,不吸收ICG,与周围正常肝组织荧光显影的背景形成对比(负显影状态)[16],从而为非规则性肝切除或血管瘤剥除术提供断肝平面。另外有7例是应用于术中反染法,在目标肝叶区域血流阻断后仍没有明显缺血分界线情况下,从外周静脉注射ICG,保留侧肝叶会荧光显影,以此作为规则性肝切除的断肝表面。当然由于红外线穿透能力较差,目前ICG荧光显像技术的应用还有一定的局限性,我们要综合术前影像学检查,3D模型的制作,术中B超的应用等来完成腹腔镜下肝脏巨大血管瘤手术治疗。
总之,对于有症状的肝脏巨大血管瘤应采取积极的手术治疗措施,腹腔镜手术安全可行,较开腹手术具有创伤小、恢复快、并发症少等优势,应根椐瘤体的大小、数目、位置选择合适的手术方式,精准的手术操作是手术成功的保证。
