原发性腹膜后平滑肌肉瘤31例诊治分析
2019-12-26杨文昶李睿东张鹏李承果林曜陈鑫王国斌陶凯雄
杨文昶,李睿东,张鹏,李承果,林曜,陈鑫,王国斌,陶凯雄
(华中科技大学同济医学院附属协和医院胃肠外科,湖北 武汉 430022)
原发性腹膜后平滑肌肉瘤(primary retroperitoneal leiomyosarcoma, PRLS)占腹膜后软组织肿瘤的20%左右,仅次于脂肪肉瘤[1]。PRLS位于腹膜后潜在腔隙,部位较为隐秘,早期无典型症状和体征,发现较为困难。关于PRLS的研究相对较少,且多以个案报道为主。本研究对华中科技大学同济医学院附属协和医院8年间收治的PRLS病人临床资料进行分析总结,以期提高PRLS诊治水平,现报告如下。
资料与方法
一、一般资料
收集2010年1月至2018年6月间在华中科技大学同济医学院附属协和医院初诊行手术治疗的PRLS病人的临床资料(表1)。排除标准:①复发PRLS者;②未接受外科手术切除者;③伴发其他恶性肿瘤者;④资料不全者。

表1 31例原发性腹膜后平滑肌肉瘤病人临床特征
二、辅助检查及术前准备
31例病人术前均行腹部B超检查,阳性率为90.3%,29例行CT检查,阳性率100%,15例行MRI检查,阳性率100%。特殊术前检查及准备:5例行CT血管造影(CTA),6例行数字减影血管造影(DSA),6例术前CT、MRI提示肿瘤与输尿管位置关系密切,行双侧输尿管插管。
三、病理与细胞学检查
手术标本在离体30 min内充分固定,标本固定前用染料标识各切缘,体积大的肿瘤分层剖开后再固定。固定液采用中性福尔马林,固定时间不超过48 h。行免疫组化染色检测α-平滑肌肌动蛋白(α-SMA)和Ki-67的表达情况,Ki-67阳性肿瘤细胞比例≤20%为低度表达,>20%为高度表达[2],所有病人的病理标本切片均经本院两位病理医师审阅无误。
四、随访情况
采用门诊、定期电话及好大夫网站随访,随访内容包括:体格检查,复查结果(血常规、肝肾功能、CT、MRI),肿瘤复发转移情况,治疗方式以及生存状况。总生存期(overall survival, OS)定义为原发肿瘤确诊到死亡或最后一次随访时间;无复发生存期定义为原发肿瘤完整切除到影像学复查发现明确复发灶的时间,末次随访时间为2019年6月1日。
结 果
31例PRLS病人均接受手术治疗,所有病人手术过程顺利,无围手术期死亡病例,手术中位时间为180 min(120~300 min)。围手术期共有18例病人输血,中位输血量为925 ml(600~2 000 ml)。切除肿瘤中位直径为8 cm(3~25 cm),10例行联合脏器切除且均完整切除肿瘤,包括单侧肾切除5例,小肠部分切除2例,右半结肠切除1例,左侧输尿管切除1例,膀胱部分切除1例。大体标本中30例有不同程度出血、坏死,29例切面呈旋涡状;31例镜下均表现为梭形细胞排列,细胞密集,细胞核有异型;免疫组化染色示:α-SMA阳性率100%(31/31),结蛋白(Desmin)阳性率91.3%(21/23),细胞角蛋白(PCK)阳性率30.8%(4/13),S-100阳性率6.5%(2/31),Ki-67高度表达有18例(图1)。术后并发症按照Clavien-Dindo分级系统[3]分级,Ⅰ级2例,Ⅱ级3例,Ⅲa级1例为吻合口漏,经影像学引导下置管冲洗治愈。术后中位住院时间为8 d(4~16 d)。
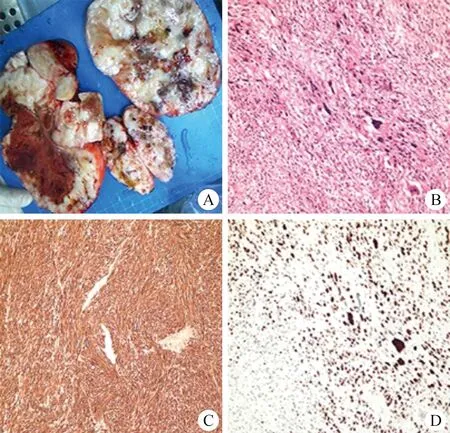
图1 原发性腹膜后平滑肌肉瘤大体标本、镜下HE染色、α-SMA和Ki-67表达情况 A.大体标本;B.HE染色(×100);C.α-SMA表达(免疫组化染色,×100);D.Ki-67表达(免疫组化染色,×100)
截至2019年6月1日,随访28例,随访率90.3%,中位随访时间为56个月(15~111个月)。28例病人中19例(67.9%)出现复发转移,其中8例(28.6%)复发转移后死亡。复发转移病人中13例复发1次,3例复发2次,2例复发3次,1例复发4次,复发间隔呈缩短趋势(图2)。19例复发转移病人中,12例接受再次手术治疗,其复发后中位OS达24个月;7例未行再次手术治疗,其复发后中位OS为13个月。

图2 原发性腹膜后平滑肌肉瘤复发间隔趋势
讨 论
腹膜后潜在间隙大且位置深,因而大多数PRLS早期不易发现,缺乏特征性临床表现。本组病人首发症状以腹痛、腹部不适及体检偶然发现较为常见,并且当症状出现时,肿瘤体积往往巨大。马超等[4]报道50%的肿瘤首次发现时直径超过9 cm,本组病人中,肿瘤直径>8 cm有15例(48.4%)。另外本组病人中女性多见,发病中位年龄为58岁,与文献报道一致[5]。
影像学检查对PRLS的诊断具有重要意义。B超检查无创、廉价,可以对肿瘤大小、数目、部位有初步判断,是术前筛查常用方法。超声引导下细针穿刺活检有助于术前明确诊断,特别是可能需行联合脏器切除者有助于其选择合理的治疗方式。但PRLS常与周边脏器关系密切,穿刺不当会导致出血、肠漏、甚至腹腔种植转移等并发症,因而对于术前评估肿瘤能够完整切除者不常规推荐。CT和MRI检查具有一定特征性表现,PRLS常表现为单发,体积巨大,形态不规则的肿块,中央可见囊变坏死区,因肿瘤血供丰富静脉期强化程度可无明显下降。同时CT和MRI可清楚显示肿块的大小、边界及其与周围各相邻组织的关系,对评价肿瘤是否能完整切除以及手术切除范围具有重要意义[6]。此外,CTA可在横断面、冠状面和矢状面上三维成像,全面直观地显示血管结构,直观地反映肿瘤侵犯周边血管的情况;DSA既可提供肿瘤的血供情况又可在术前指导动脉栓塞,从而有利于减少术中出血,提高手术的安全性和彻底性。需要注意的是,栓塞时间与手术间隔时间不宜超过3 d,否则可能发生栓塞血管再通现象。
当前外科手术仍是PRLS最有效的治疗方法,完整切除是降低肿瘤术后复发风险的关键[7]。PRLS手术难度大,充分的术前准备与多学科团队(multiple disciplinary team, MDT)协作是手术成功的基础。术前改善病人营养状况,并针对病人内科合并症进行对症治疗,同时MDT讨论明确术中相关重要脏器管理的注意事项。对于术前CT、MRI提示肿瘤巨大、与输尿管关系密切者,术前应常规行输尿管插管作为术中辨认输尿管的标志,从而降低术中输尿管损伤风险。手术入路始终遵循侧方入路的原则;对于肿瘤巨大者,足够显露肿瘤的切口是顺利切除肿瘤的关键,可在纵行切口基础上增加一侧(或两侧)的横切口,使切口呈“丁”字形(或“十”字形)[8];出血是术中常见难题,术中先结扎肿瘤滋养血管是控制大出血的关键,对于肿瘤侵及周围血管者,可考虑将肿瘤连同包绕的血管整块切除,然后根据情况行必要的血管重建;PRLS常侵犯邻近脏器,但这并非是手术的绝对禁忌证。本中心对一般情况良好的病人,在充分的术前准备、MDT指导情况下积极行联合脏器切除,从而提高肿瘤的完整切除率,改善病人的预后。对于肿瘤与肠管紧密粘连者,应由具备丰富经验的腹膜后肿瘤手术医师耐心仔细操作,减少腹腔感染与肠瘘发生率。PRLS常压迫腹腔血管占据大部分体腔,术中肿瘤的切除对病人呼吸、循环系统有重要影响。因而术中应与麻醉医生密切配合,严密监测生命体征,并做好维持重要脏器功能的准备。肿瘤切除后病人有效循环容量减少,术后应按出定入、合理补液,维持血流动力学稳定。此外,有文献[9]报道,对于边界清楚、对周围血管或脏器无明显侵犯的腹膜后肿瘤,可考虑行腹腔镜手术。腹腔镜可提供广阔的视野,清楚探查肿瘤与周围血管及重要脏器的位置关系。本研究初步结果显示,对部分边界清楚、周围血管及器官无侵犯、直径<8 cm的PRLS行腹腔镜下手术切除可取得良好的治疗效果。对于肿瘤血供丰富、与重要脏器粘连紧密、术中探查腹腔镜下切除困难者,应及时中转开腹。需要强调的是,开腹手术仍是PRLS主要的手术方式。对首次手术预计不能完整切除者,可行局部活检并根据病理及二代测序结果行放化疗或靶向治疗;放化疗或靶向治疗后评估能完整切除者,应积极行手术治疗[10]。对肿瘤病理分期早、手术切缘阴性者,术后不推荐常规行辅助放化疗,可密切观察,定期复查[6]。
PRLS完整切除术后易发生复发转移,切除范围、病理分级和肿瘤大小是主要的预后因素[11]。对肿瘤病理分级高、肿瘤体积巨大、手术切缘阳性的高复发风险病人,术后可针对性行放射治疗,并定期复查。对能够行再次手术的复发转移病人,Nathenson等[12]报道采用多次连续切除可获得更高的生存率。本组术前评估体力状况良好、无明显手术禁忌的复发转移病人,在MDT指导下也积极选择再次手术治疗,其复发后中位OS显著高于非手术病人。对于肿瘤短期生长迅速、广泛性转移难以手术的病人,可行局部活检并根据病理及二代测序结果采取放化疗、免疫治疗或靶向治疗。有临床研究显示国产新型靶向药物安罗替尼在治疗晚期平滑肌肉瘤方面具有一定疗效和安全性,目前安罗替尼已被纳入中国临床肿瘤学会《软组织肉瘤诊疗指南》(2019)中,成为我国首个获批的软组织肉瘤靶向药[13-14]。
综上所述,PRLS早期诊断较为困难,影像学检查有助于提高术前诊断率及评估手术切除范围,手术完整切除是PRLS最有效治疗方法。PRLS术后复发率高,预后较差。对无明显手术禁忌的复发转移病人,在MDT指导下应积极选择再次手术治疗。
