儿童血清降钙素原参考区间的调查
2019-12-26曹子文文江平
吴 薇,曹子文,文江平△
(1.首都医科大学附属北京同仁医院检验科,北京 100730;2.首都医科大学临床检验诊断学系,北京 100069)
降钙素原(PCT)在正常生理情况下由甲状腺旁C细胞产生,是无激素活性的降钙素前肽物质,可经特异性肽链内切酶裂解生成降钙素[1-2]。在健康成年个体中PCT水平非常低(<0.1 ng/mL),但在细菌感染时循环系统中的PCT水平会快速升高[3],已被广泛应用于细菌感染性脓毒症的诊疗[4-6]。PCT检测方法中化学发光法灵敏度高,最低可检出0.02 μg/L的PCT[7],是检测PCT的最佳方法[8]。临床上普遍认为成年人PCT的参考区间为PCT<0.05 ng/mL。但参考区间存在变异,所以实验室有必要为不同年龄、性别的人群建立PCT的参考区间。儿童与成年人相比,更易发生感染性疾病。报道显示出儿童PCT参考区间可能会高于成年人[9-11]。
本研究参考国际标准化委员会(ISO)15189相关准则,按照实验室医学联盟(IFCC)规定的参考个体标准[12],采用回顾性采样法[13],初步探讨用微粒子酶促化学发光法测定PCT,调查适用于儿童(≤14岁)及本实验室检测系统的PCT生物参考区间,旨在合理利用PCT检测结果诊断儿童是否发生细菌感染,指导抗菌药物使用,为相关疾病诊疗提供帮助。
1 资料与方法
1.1一般资料 选取2018年11月至2019年2月在首都医科大学附属北京同仁医院进行术前检查的儿童,年龄为出生后3 d至14岁。就诊原因仅限于眼科疾病如高度近视、白内障、青光眼、视网膜脱落、角膜移植、斜视、屈光不正,及耳鼻喉科疾病如腺样体肥大、唇裂、先天性耳前瘘、先天性耳聋。入选标准:营养良好,无发热、贫血、黄疸及药物使用或慢性病史。年龄为出生后3 d至14岁。血压、B超、胸片正常,肝功常规、肾功常规、血脂常规、离子常规、血常规,C反应蛋白(CRP)和尿常规检查均正常。具体指标的数值需符合儿童专用的参考区间[14]。排除标准:参考个体排除标准:根据《临床实验室检验项目参考区间的制定》中所规定的要求,排除存在贫血、上呼吸道感染、发热、甲状腺疾病、肿瘤、肝肾疾病、过敏反应、结缔组织病、免疫缺陷病和风湿性疾病等内科疾病的患者。排除严重失血、严重外伤或休克、伤口感染、应激性反应等外科疾病的患者。排除个体肥胖、近期服用药物、有过外科手术、食素、有家族遗传病史的患者。排除年龄为0~3 d的儿童、存在急慢性炎症及近3个月来最近一次实验室检查结果在上述检查项目正常参考区间外的患者。标本剔除标准为:微生物污染的样本;高度溶血、黄疸或乳糜样本,水平以性能验证为准,厂家参考区间为血红蛋白<7.6 mmol/L,胆红素<541 μmol/L,三酰甘油<18.29 mmol/L;冻融1次的全血标本或反复冻融2次以上的血清样本。经以上入选标准和排除标准剔除不合格者,最终入选400例出生3 d至14岁的就诊患者,其中男217例、女183例。再严格按照上述标准在2019年3-4月就诊患者中另选取80例用于参考区间的验证,其中男40例、女40例,年龄均为出生后3 d至14岁。
1.2仪器与试剂 采用美国BECKMAN-COULTER 公司的UniCel DxI800免疫分析系统(仪器序列号为602423;仪器系统号为1965899),应用四川省沃文特生物技术有限公司的降钙素原质控品及配套试剂盒(微粒子酶促化学发光法,试剂批号为435699、配套定标液批号为900101、效期:20200101)。按ISO 17511规定量值溯源至德国BRAHMS公司建立的第2代参考物质PCT115。冻存血清统一复融,高速离心后取上层清液进行检测,操作严格按照仪器和试剂说明书进行。
1.3收集方法 按说明书要求采集所有入选对象空腹静脉血3 mL,1 400×g离心10 min分离血清,待完成其他生化检测后分离收集剩余血清至1.5 mL尖底离心管中,按上述标本剔除标准排除溶血、乳糜、黄疸等样本,将收集到的样本编号后放在试管架上保存于-80 ℃冰箱待测,过程中避免反复冻融,所有冷冻样本仅在检测前于室温中复融1次。
1.4质量保证 严格执行室内质控程序,按照美国临床和实验室标准化协会(CLSI)的EP9-A2文件,采用四川沃文特生物技术有限公司的PCT质控品(水平1批号为900101、水平2批号为900102、水平3批号为900103)进行质控。在进行检测前,对仪器进行重新定标,检测3个水平的质控品,确保在控。使用的仪器按照中国合格评定国家认可委员会的要求校准,性能验证合格。在同一天8 h内完成全部样本检测,避免天间变异。
1.5检测原理 采用微粒子酶促化学发光法,即用已包被特异性抗体的无磁性微粒子作为固相载体与血清中的PCT发生免疫学反应,以碱性磷酸酶作为发光剂。
1.6参考区间验证 检测80例患者血清PCT水平,将检测结果剔除离群值后,保证每组至少有20例样本,计算R值。R=测定结果在参考区间内的例数/总测定例数。如80例参考个体中不超过8例检查结果落在所验证的参考区间外(即R≥90%),则可基本认为该参考区间适用;如果有9例及以上的观测值落在参考区间外,则证明该参考区间不适用。

2 结 果
2.1参考个体的一般实验室检测项目分析 400例参考个体分别测定了肝功常规、肾功常规、血脂常规、离子常规、尿常规、血常规和C反应蛋白等项目。其中白细胞计数(WBC)与C反应蛋白(CRP)检测结果见表1。PCT检测结果与相对应的WBC和CRP结果分别进行Spearman相关性分析,差异均无统计学意义(r<0.3,P>0.05)。说明在本研究参考人群中PCT水平越高,WBC与CRP结果也会相应升高,但是二者的升降趋势与PCT水平无必然联系。同时在检测结果中发现出生后3 d至2岁患儿WBC较2~14岁患儿高,而红细胞计数(RBC)、血红蛋白(Hb)与后者相比较低。符合人民卫生出版社第5版《临床检验基础》所描述的儿童血常规变化趋势,即0~2岁儿童WBC升高明显,2岁后WBC逐渐平稳下降但始终稍高于成人。

表1 不同人群PCT、CRP与WBC检测结果比较
2.2检测系统性能评价 按照EP9-A2文件要求进行检测系统性能评价,结果显示,检测系统的批内精密度、批间精密度、重复性、回收率、线性范围、灵敏度、携带污染率等性能指标均符合临床使用要求。
2.3离群值判断 将所有检测对象的PCT检测结果按年龄升序排列后,疑似最大离群值为0.96 ng/mL,以其计算D/R值为0.185,小于1/3,故保留所有检测数据。
2.4参考个体PCT水平的比较 按照年龄对纳入的参考个体进行分组,经非参数秩和检验分析,发现不同组间检测结果比较差异无统计学意义(P>0.05)。不同年龄段参考个体PCT检测结果以M(Q1,Q3)表示,3 d至1岁、1~<2岁、2~<4岁,4~<6岁、6~<8岁、8~<10岁、10~<12岁、12~≤14岁患者均为50例,其PCT水平分别为[0.140(0.100,0.230)ng/mL]、[0.190(0.150,0.375)ng/mL]、[0.175(0.140,0.288)ng/mL]、[0.170(0.133,0.310)ng/mL]、[0.135(0.103,0.238)ng/mL]、[0.145(0.110,0.260)ng/mL]、[0.130(0.100,0.238)ng/mL]、[0.130(0.070,0.210)ng/mL。同样217例男性与183例女性儿童PCT检测结果分别为[0.160(0.110,0.280)ng/mL]和[0.160(0.110,0.280)ng/mL],差异无统计学意义(P=0.283)。
2.5正态性检验 以所有检测结果绘制频数分布图,使用Kolmogorov-Smirnov法进行正态性检验,数据呈非正态分布,见图1。

图1 出生后3 d至14岁人群PCT检测数据频数分布图
2.6建立生物参考区间 结合400例纳入对象PCT检测结果频数分布及PCT临床意义,以95%分位数为上限确定生物参考区间,即以第380位数据为参考上限,建立本检测系统的儿童PCT生物参考区间为PCT≤0.46 ng/mL。
2.7验证生物参考区间 另选取的80例患者PCT检测结果均通过验证,即检测结果落在本研究参考区间外的个数为0例(R值≥90%),说明本研究建立的参考区间是适用且可被转移的。
2.8与其他文献报道结果比较 目前国内涉及儿童PCT参考区间建立范围仅有重庆医科大学附属儿童医院检验科研究报道的结果为PCT≤0.038 ng/mL,即健康儿童PCT水平≤0.038 ng/mL,较本实验结论相比有较大的出入,其结果的统计分析同样显示PCT检测结果在不同年龄和性别间比较差异均无统计学意义(P>0.05)。在国外研究中,也有少量间接涉及未成年人PCT的相关研究,与本研究结果较为符合,见表2。
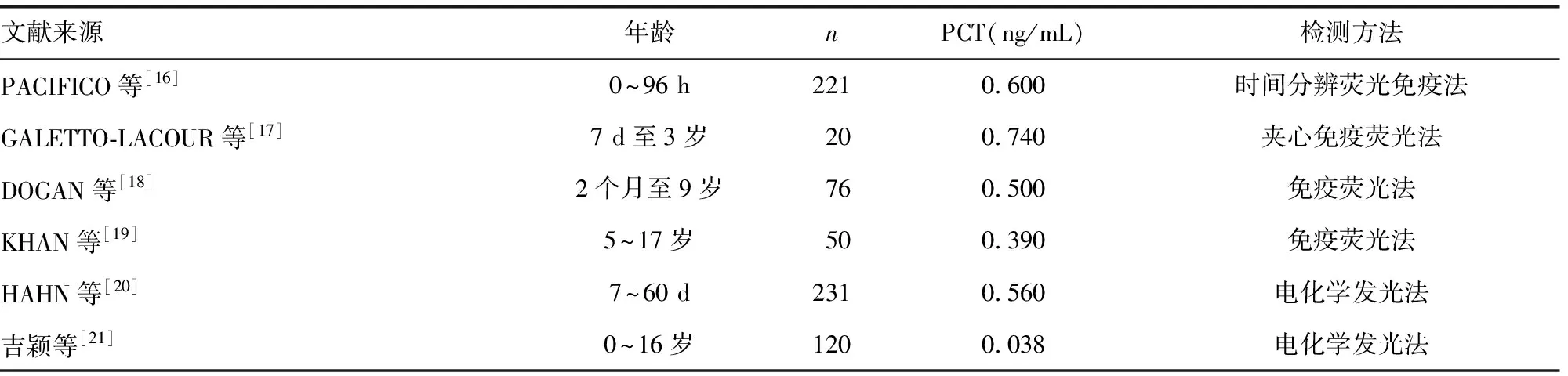
表2 其他文献报道的PCT参考区间
3 讨 论
本研究严格遵守《医学实验室质量和能力认可准则》中的要求,按照CLSI EP28-A3c文件,利用400例参考个体样本的PCT测定结果和统计结果,调查了适用于出生后3 d至14岁人群的PCT生物参考区间,即PCT≤0.460 ng/mL,本结果明显高于健康成年人的参考区间。
国内大部分实验室通常认为成年人PCT质量浓度的正常值应为<0.050 ng/mL,与上述重庆医科大学附属儿童医院的研究结果显示的儿童生物参考区间(≤0.038 ng/mL)没有本质上的区别。也有外国学者认为成年人PCT水平≥0.25 ng/mL时即可确认为细菌感染,建议使用抗菌药物[22]。这些区间上限明显低于本实验所给出的结论,但是在不考虑仪器试剂等差异的情况下,参考区间也会受到生物所固有变异性、生活地区、生活水平影响而发生改变,不可能是一个固定的范围。因此,与实验预期相符,本研究与其他研究所报道的参考区间有一定符合也有一定差异,符合国外文献的报道,但与重庆医科大学附属儿童医院建立的参考区间相比较宽,可能与不同地区儿童饮食习惯差异有关,所以建议各实验室依据不同临床需求把前来本院就诊的儿童当做特殊人群,去建立符合其生理情况的准确参考区间。同样,本研究纳入标准中采用的各年龄段血常规参考区间,也只能覆盖95%人群,入选的参考个体WBC结果即便在参考区间内,也不能确保不存在感染,所以本研究在分析参考人群血清PCT检测结果的同时,对其WBC与CRP结果进行了相关性分析,分析结果显示三者之间无联系,说明纳入的人群不存在会使PCT水平上升的细菌感染,确保了结果的准确。经大量研究确认的是,新生儿的降钙素原水平在出生后短期内会生理性增高[23],最高值可达21 ng/mL,平均值为2 ng/mL,所以国内相关研究所纳入的对象年龄最小也有7个月。但是相关文献同样表明,新生儿出生后3 d PCT水平便会下降并维持相对固定的水平,所以本研究填补了出生后3 d至半年儿童降钙素原参考区间未有人涉及的空缺。其他研究的样本量较小,年龄分组过于宽泛,未满足《儿科学》第6版中推荐的7个年龄段,并且在建立好参考区间后也未进行参考区间的验证,本研究针对以上方面均做出了相应改进。
本研究也存在一定局限性:(1)儿童参考个体虽不易受吸烟、酗酒等不良嗜好的感染,但是本研究未针对儿童饮食习惯设定纳入或排除标准,对于儿童的营养状态也仅通过身高、体质量及一部分实验室检查项目间接评估。(2)本研究采用的是回顾性采样法,用于检测PCT的血清是做完其他生化项目的剩余血清,有些样本可能会在室温或4~8 ℃冰箱中储存一段时间,根据研究表明,在4 ℃保存12 h的血清PCT质量浓度会下降6%[24]。(3)由于化学发光试剂昂贵,本研究经费有限,所以样本量仅有400例,无法再扩大样本进行验证,且男女比例也未能达到1∶1;无法再细化分组,不能调查PCT在胎儿期、新生儿期及婴儿期是否存在差异。(4)今后应在制定并遵守适用于出生3 d内新生儿的纳入标准的前提下,进一步探究新生儿PCT的生物参考区间。(5)建立参考区间最重要的质量保证就是检测方法的溯源性,但PCT目前并不能按ISO 17511溯源至国际单位制(SI),德国BEAHMS公司建立的PCT溯源链,其设定未考虑到年龄、性别、地域的差异,建立适当的参考区间尚需要大量数据积累和相应分析,只有排除潜在的干扰因素才能使生物参考区间具有广泛的适应性,覆盖不同人群,满足临床需要。
针对以上不足,希望在未来有条件的时候,采用多中心、盲法的实验设计;扩大有效样本量;对不同地域进行分组;用诺尔曼PCT检测系统对出生3 d内婴儿末梢血检测,从而建立起与儿童人群免疫系统正常发育规律相符合的生物参考区间。
4 结 论
本研究成功地在更大范围上更精准地建立了出生后3 d至14岁儿童PCT生物参考区间。发现了儿童PCT水平与成人有较大差别,评估儿童感染状况时不能以成人参考区间作为依据。有助于儿童感染性疾病的诊断、辅助用药及预后观察,为完善地建立儿童实验室检查项目的参考区间进一步奠定了基础。
