光学比浊法与血栓弹力图法评价氯吡格雷疗效的一致性研究及氯吡格雷抵抗相关风险因素分析*
2019-12-26张丽敏许惠文孙越红康熙雄张国军
张丽敏,许惠文,李 虓,孙越红,王 丹,王 平,赵 晖,康熙雄,张国军△
(1.首都医科大学附属北京天坛医院检验科,北京100070;2.北京市免疫试剂临床工程技术研究中心,北京100070)
氯吡格雷作为常见的抗血小板药物已经成为心脑血管疾病患者预防不良血管事件发生的基础和一线用药。然而,其抗血小板作用在患者间存在很大的个体差异,部分患者缺乏对氯吡格雷的反应或反应降低,称为氯吡格雷抵抗,而部分患者服用氯吡格雷后血小板聚集功能下降明显,存在一定的出血风险[1]。因此,早期、准确地通过检测血小板的功能来评价氯吡格雷药物疗效对个体化调整用药具有重要的指导价值。目前实验室检测方法主要包括血栓弹力图法(TEG)、维梵纳抗血小板监测系统及光学比浊法(LTA)等,其中LTA是最经典的检测血小板功能的方法,也是专家共识中推荐评价血小板功能的“金标准”[2-5]。
北京天坛医院开展TEG检测已有十余年,检测方法相对成熟,但TEG仪器和耗材昂贵,自动化程度低,影响因素较多,因此应临床需求,为了寻找一种更简便,快捷地评价氯吡格雷疗效的指标,研究者新引进了全自动血小板聚集仪,对血小板聚集功能进行检测和评估。然而此项目的开展是否能够满足本院临床需求,与TEG一致性和相关性如何,尚需临床数据的验证。本院有丰富的脑血管病患者病例资源,故本研究拟以于北京天坛医院就诊的患者为研究人群,以TEG为比对方法,研究LTA检测血小板聚集功能在氯吡格雷疗效评价方面的作用,并根据LTA检测结果,对影响氯吡格雷疗效的可能风险因素进行评估,通过积极控制风险因素,降低不良血管事件的发生,从而提高患者生存质量,最终实现患者的获益。
1 资料与方法
1.1一般资料 本研究入选了2018年11月至2019年5月于北京天坛医院住院治疗并首次服用抗血小板药物治疗的患者67例,其中男49例,女18例,平均年龄为(57±12)岁,包括脑梗死患者39例,颅内动脉瘤患者8例,短暂性脑缺血发作患者7例,颈内动脉动脉瘤患者4例,基底动脉狭窄患者3例,前交通动脉动脉瘤患者2例,基底动脉干动脉瘤患者1例,颈内动脉狭窄患者1例,锁骨下动脉狭窄患者1例和椎动脉动脉瘤患者1例。所有患者均首次入院,每天口服75 mg硫酸氢氯吡格雷片(波立维)和100 mg阿司匹林肠溶片进行双联抗血小板药物治疗。所有患者血小板计数在正常范围(100~300)×109/L。排除标准:(1)患有血液性疾病,恶性肿瘤或活动性出血者;(2)伴有心、肝、肾等脏器功能严重障碍者;(3)近3个月内有出血史或脑血管疾病相关事件者;(4)存在自身免疫性疾病或接受相关药物治疗者;(5)近期服用过甾体、非甾体抗炎药物者或服用质子泵抑制剂患者;(6)凝血功能障碍者;(7)检查依从性较差者。
1.2仪器与试剂 Techlink Biomedical全自动血小板聚集分析仪及配套诱导剂150 μmol/L二磷酸腺苷(ADP);美国Haemoscope公司的TEG 5000及配套试剂盒,试剂包括高岭土、激活剂、二磷酸腺苷等。
1.3方法
1.3.1入组患者临床资料的采集与管理 患者服用氯吡格雷5 d后,空腹安静状态下抽取静脉血,分别采用TEG和LTA进行血小板功能检测。记录TEG相关参数:二磷酸腺苷诱导的血小板聚集抑制率(ADP%)、血凝块形成角(α)值及TEG最大振幅(MA值)及全自动血小板聚集仪测得的ADP诱导的血小板最大聚集率(PAg-ADP%)。查询病历记录患者的一般情况,包括姓名、性别、身高、体质量[计算体质量指数(BMI)]、个人史(吸烟史、饮酒史)、既往史(高血压病史、糖尿病病史)。并记录患者就诊后在给予治疗前首次实验室指标:糖化血红蛋白(GHb)、血浆同型半胱氨酸(pHcy)、血小板计数(PC)、平均血小板体积(MPV)、血小板分布宽度(PDW)、D-二聚体、血浆纤维蛋白原(Fbg)、CYP2C19基因型等用于氯吡格雷抵抗发生的风险因素分析。
1.3.2氯吡格雷抵抗标准 TEG参数ADP%<30%的患者为氯吡格雷抵抗组,ADP%≥30%的患者为氯吡格雷非抵抗组[6-7];LTA参数PAg-ADP%≥50%为氯吡格雷抵抗组,PAg-ADP%<50%为氯吡格雷非抵抗组[7]。

2 结 果
2.1氯吡格雷疗效一致性评价 采用TEG患者的氯吡格雷抵抗率为35.82%(24/67),采用LTA患者的氯吡格雷抵抗率为47.76%(32/67),差异无统计学意义(P=0.152),见表1。PAg-ADP%和TEG参数均符合正态分布,Pearson 相关分析结果显示PAg-ADP%与TEG参数MA和α值之间,差异无统计学意义(r分别为0.068,-0.008,均P>0.05);PAg-ADP%与ADP%之间比较差异具有统计学意义(r=-0.493,P=0.000),二者呈负相关。
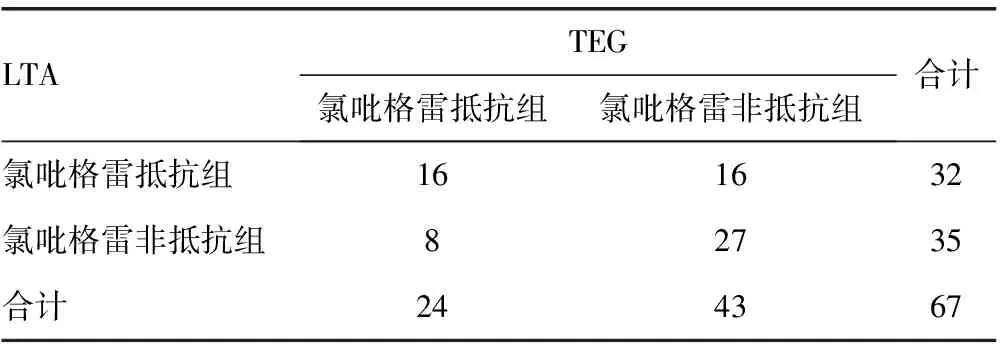
表1 采用LTA与TEG检测氯吡格雷疗效的一致性(n)
2.2两组患者一般情况比较 以LTA划分的氯吡格雷抵抗组和氯吡格雷非抵抗组患者,二者年龄、性别、实验室指标等一般资料情况比较结果见表2。与氯吡格雷非抵抗组比较,氯吡格雷抵抗组患者年龄偏大,MPV偏大,差异有统计学意义(P<0.05)。两组患者性别、BMI、吸烟饮酒史、既往病史及其他实验室指标比较差异无统计学意义(P>0.05)。
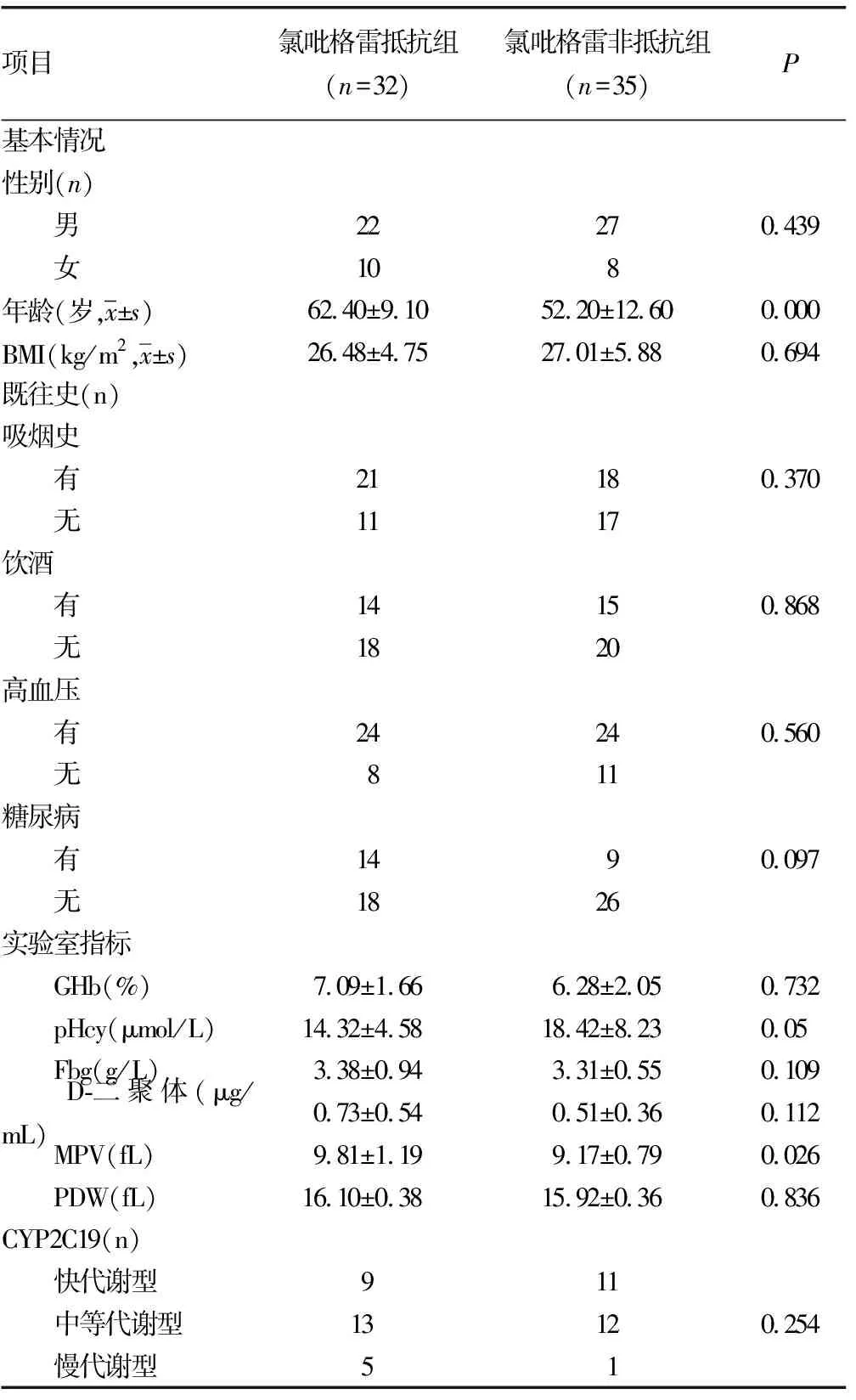
表2 两组患者一般情况比较
2.3氯吡格雷抵抗风险因素分析 Logistic逐步回归分析以氯吡格雷抵抗患者的PAg-ADP%为因变量,将两组的年龄、GHb、pHcy、Fbg、D-二聚体、PC、MPV、PDW及CPY2C19基因型等为自变量,Logistic回归分析结果提示:年龄和MPV构成氯吡格雷抵抗的独立风险因素,其中年龄(OR=1.106,95%CI1.038~1.178,P=0.002),MPV(OR=1.968,95%CI1.079~3.588,P=0.027),见表3。
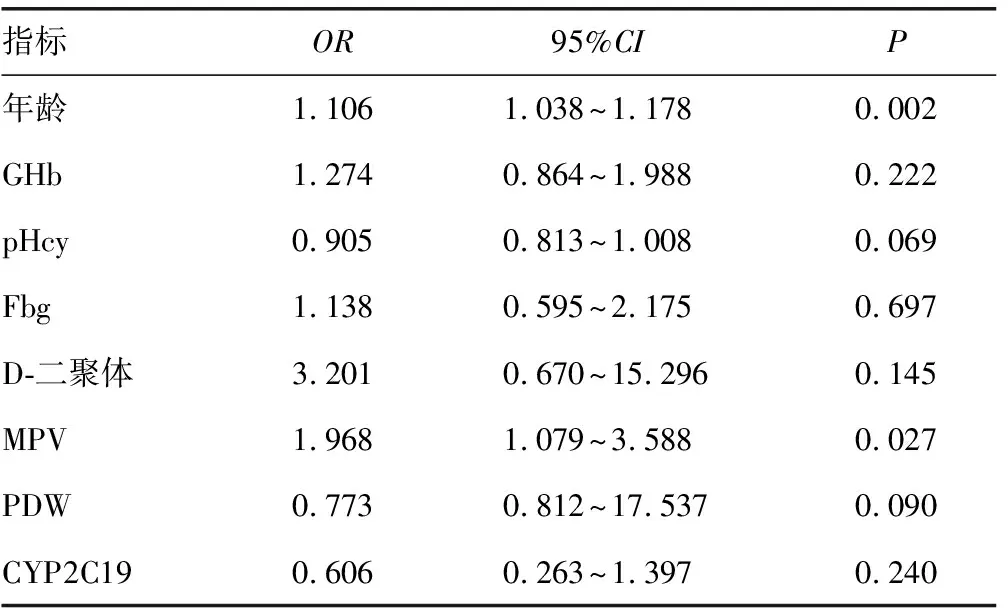
表3 各因素与氯吡格雷抵抗的Logistic回归分析
3 讨 论
氯吡格雷抵抗是增加心血管不良事件再发风险的重要因素之一。因此,如果能够早期、准确地对氯吡格雷疗效进行评价,可及时地通过个体化调整用药来减少不良事件的发生,提高患者的生存质量。
LTA作为血小板聚集功能检测的金标准[5],可以快速的为临床提供实验室的数据支持。目前LTA的主要问题在于加入诱导剂的水平未标准化,但已有多个指南正努力将其操作进行规范[8-10]。LTA 因其收费价格低廉,开展范围广泛,已成为血小板功能检测的常规基础手段。脑血管病患者占据了本院较大的患者人群,尤其是缺血性脑卒中患者,而氯吡格雷是此类患者的常规基础用药。因此为了更好地满足临床需求,本院于2018年11月开展了此项目,为了更好地服务于临床,研究者需要评价项目短期内临床应用效果,由此设计了此项研究。由于新项目开展初期同时开立TEG和LTA的患者例数较少,因此本研究仅纳入了67例患者。随着项目开展的逐渐成熟及临床沟通和宣讲,后期将进行进一步大样本病例的验证。目前数据显示,LTA和TEG在评价氯吡格雷疗效方面具有良好的一致性(P>0.05),并且PAg-ADP%与ADP%呈负相关(r=-0.493,P=0.000),这证明了LTA在评价氯吡格雷疗效方面与TEG有同样的效果。
同时本研究对影响氯吡格雷疗效的相关风险因素也进行了分析。研究结果显示年龄和MPV构成了氯吡格雷抵抗的独立风险因素(P<0.05)。一般来说随着年龄增长,血管基础病变越明显,可能会导致血小板功能异常;另一方面,氯吡格雷是一种前体药物,随着年龄增加,肝脏对药物代谢能力减弱,也是容易出现药物抵抗的原因之一。MPV是反映机体血小板衰亡及生成的指标,在机体的凝血过程中,血栓形成后出现继发性纤溶亢进,使血小板破坏,从而加速血小板的数量急剧下降,同时刺激提高了巨核细胞的再生能力,产生大量年轻的血小板,导致MPV增加[11]。人们普遍认为,血小板释放到血液直至死亡,它们的体积不会发生变化。MPV增加提示血小板的破坏增多。研究表明,血小板的体积大小,一方面反映骨髓巨核细胞增生代谢和血小板的生成情况,另一方面也显示了循环中血小板的年龄,体积大的血小板含有较多的α颗粒,这些颗粒的5-羟色胺和β血栓蛋白等物质的释放增多,血小板黏附功能增加,更易发生血小板聚集,破坏血脑屏障,加重缺血损伤,加速血栓形成[12-14]。研究表明,高水平pHcy及D-二聚体等均是不良血管事件发生的重要因素[15-17],然而本研究结果显示上述指标并未构成氯吡格雷抵抗的独立风险因素,可能原因如下:(1)入组患者较少,结果存在一定偏倚;(2)研究人群均为慢性病患者,患者入院前可能已查出高同型半胱氨酸血症或血糖、凝血指标水平偏高,并接受过相关药物治疗,入院时的上述指标的水平已不能代表患者真实的水平,故研究结果差异不显著。另有研究发现,氯吡格雷抵抗组和氯吡格雷非抵抗组CYP2C19基因型分布存在差异,氯吡格雷抵抗组突变纯合型多于非抵抗组[18],然而在本研究中并无相关结果体现,可能是由于本研究纳入病例有限,不同基因型在人群中分布频率差异较大,而基因型研究更适合对大样本人群的调研,因此后期可通过增加样本量来减少这种偏倚。
4 结 论
LTA作为一种可靠有效的检测方法可以早期评价氯吡格雷疗效,实现个体化给药治疗。年龄和MPV作为氯吡格雷抵抗的独立风险因素,有助于早期识别氯吡格雷抵抗的高风险人群,通过积极干预,可减少临床不良血管事件的发生,提高患者生存质量。
