MALDI-TOF MS在泛耐药肺炎克雷伯菌中的药敏试验的应用评价*
2019-12-26郑光辉赵剑北李斯文张国军
郑光辉,赵剑北,李斯文,张国军△
(1.首都医科大学附属北京天坛医院检验科,北京 100070;2.北京市免疫试剂临床工程技术研究中心,北京100070;3.首都医科大学临床检验诊断学系,北京 100070)
肺炎克雷伯菌是肠杆菌科常见的致病菌[1],目前其耐药形势越来越严峻,对各类抗菌药物耐药率在逐年上升[1-2]。因此,及时、快速地进行肺炎克雷伯菌的药敏试验对指导临床抗菌药物的使用和控制院内耐药菌株的播散均具有重要意义[3]。目前,临床实验室对肺炎克雷伯菌的耐药性监测仍以纸片扩散法和微量肉汤稀释法为主。由于其原理是基于微生物的代谢反应,虽能基本满足临床需求,但是传统的药敏试验方法耗时较长,阻碍了临床的精准用药[4]。基质辅助激光解析电离飞行时间质谱 (MALDI-TOF MS)是近年来用于微生物鉴定的有效工具,因具有快速、简便等优点使其在临床微生物鉴定方面得到广泛应用[3],其在微生物耐药性监测方面也有了一定的报道,利用MALDI-TOF MS进行药敏试验可以提前24 h完成药敏试验且花费较低[5]。因此,为解决肺炎克雷伯菌感染的耐药时效性问题,弥补单一方法的片面性和传统方法人工操作繁琐、耗时长等不足,本实验利用MALDI-TOF MS分别对比不同耐药表型及基因型的肺炎克雷伯菌进行检测,寻找具有特定耐药基因的特征蛋白的指纹图谱,以达到能够快速对耐药肺炎克雷伯菌进行药敏实验的目的,本研究针对临床上最广泛的基因型作为研究对象,对MALDI-TOF MS在肺炎克雷伯菌药敏试验的应用方面做出了探索性研究。
1 材料与方法
1.1菌株来源 收集2018年3-9月首都医科大学附属北京天坛医院微生物实验室临床标本分离得到的肺炎克雷伯菌,其中包含不同耐药机制的肺炎克雷伯菌17株及野生型肺炎克雷伯菌11株。
1.2仪器与试剂 VITEK MS (生物梅里埃公司,法国)、CO2孵育培养箱(热电公司,美国)、Phoenix 9240全自动培养系统(碧迪公司,美国),CapitalBio RTisochip-A恒温扩增检测仪(北京博奥生物有限公司,中国),VITEK MS靶板(生物梅里埃,法国)、VITEK-MS CHCA基质液(生物梅里埃,法国)、哥伦比亚血平皿(天津市金章科技发展有限公司,中国)、一次性接种环(科藩公司,意大利)、QIAGEN DNA Kit试剂盒(凯杰公司,德国)、恒温扩增试剂(北京博奥生物有限公司,中国)。
1.3菌株培养和鉴定 将利用纸片法保存的菌种从-80 ℃冰箱中取出,倒入营养肉汤,置于35 ℃孵育培养箱中恒温培养16~24 h后,转种于哥伦比亚血平皿上,再于35 ℃孵育培养箱中恒温培养16~24 h。采用SARAMIS RUO模式菌株进行鉴定,确认其为肺炎克雷伯菌。
1.4耐药基因检测 采用微流控芯片对细菌的耐药基因进行检测,此项技术基于环介导等温扩增(LAMP)技术进行微生物耐药基因的测定,具体操作方法为抽取100 μL脑脊液细菌培养阳性培养液,置于1.5 mL无菌离心管中,37 ℃、12 000 r/min离心5 min,弃去上清,提取细菌的核酸。吸取26 μL恒温扩增试剂,加入准备好的200 μL离心管中,加入26 μL被检核酸样品,轻摇使其充分混合均匀,离心至管底。吸取50 μL上述配制好的核酸扩增反应体系,加入到芯片主通道中,待其充满芯片主通道即停止加样,用封口膜封闭出样口。将加样后的芯片固定在低速离心机上,以6 000 r/min离心30 s后取下。置于CapitalBio RTisochip-A恒温扩增检测仪上进行检测。50 min后得到检测结果。如果样本测试没有结果或产生一个错误,或测试后没有残留DNA,标本在初始测试24 h内重新测试。测试的基因型包括blaKPC,blaSHV,blaTEM,blaCTX-M-9,ompK35和aadA1[6],其中,耐药基因的序列采用芯片自身的引物序列完成。
1.5MALDI-TOF MS检测方法建立 以CHCA基质液为基准,参数设置:扫描范围200~2 000 m/z,激光打点次数100,激光强度32 A,以212.03和379.09 m/z为基峰建立方法;2 000~20 000 m/z范围以SARAMIS RUO模式自带鉴定参考方法为准。
1.6MALDI-TOF MS检测 将全部的17株耐药肺炎克雷伯菌及11株敏感菌使用一次性接种环分别涂于靶板上,同时以ATCC 8739大肠埃希菌为质控菌种,检测点及质控点均加入饱和CHCA基质液1 μL,待靶板晾干后应用MALDI-TOF MS RUO模式对菌株200~2 000 m/z范围进行检测。重复上述步骤,对菌株2 000~20 000 m/z范围进行检测,将Shimadzu Biotech MALDI-MS软件上得到的峰图使用SARAMIS Premium软件进行评分。重复上述检测,直至SARAMIS Premium软件对所有菌株的峰图评分得到90%以上,收集得到的峰图数据。
2 结 果
2.1肺炎克雷伯菌耐药基因结果 17株耐药肺炎克雷伯菌的基因型微流控芯片检测示意图见图1,检测基因型见表1。
2.2MALDI-TOF MS结果 使用Shimadzu Biotech MALDI-MS软件分析11株敏感菌200~2 000、2 000~20 000 m/z的质谱峰图,其中在200~2 000 m/z范围共筛选出63个峰,2 000~20 000 m/z范围共筛选出83个峰,合计共146个峰。以±0.05%为偏差范围,在偏差范围以内视为同一峰,依次分析每株耐药菌的质谱峰图,弃去同一离子峰,只记录不同离子峰。记录完成后将敏感菌与耐药菌进行对比,在200~2 000及2 000~20 000 m/z范围区间内筛选出耐药菌具有的离子峰,同时在敏感菌中不存在的峰,采用灵敏度进行表征,计算方式:灵敏度=耐药株具有某离子峰数目/耐药菌的总数目,结果显示,在524 m/z,728 m/z的区分灵敏度最高,均达到76.47%。将耐药菌根据不同基因型进行分组比对,筛选出blaKPC基因型、blaCTX-M-9基因型及其他基因型可能存在的特异峰,采用灵敏度与特异度表征,其中灵敏度=具备某基因型且具有某离子峰数目/具有某耐药基因的总数目,特异度=不具备某基因且不具备某离子峰数目/不具备某耐药基因的总数目),见表2。
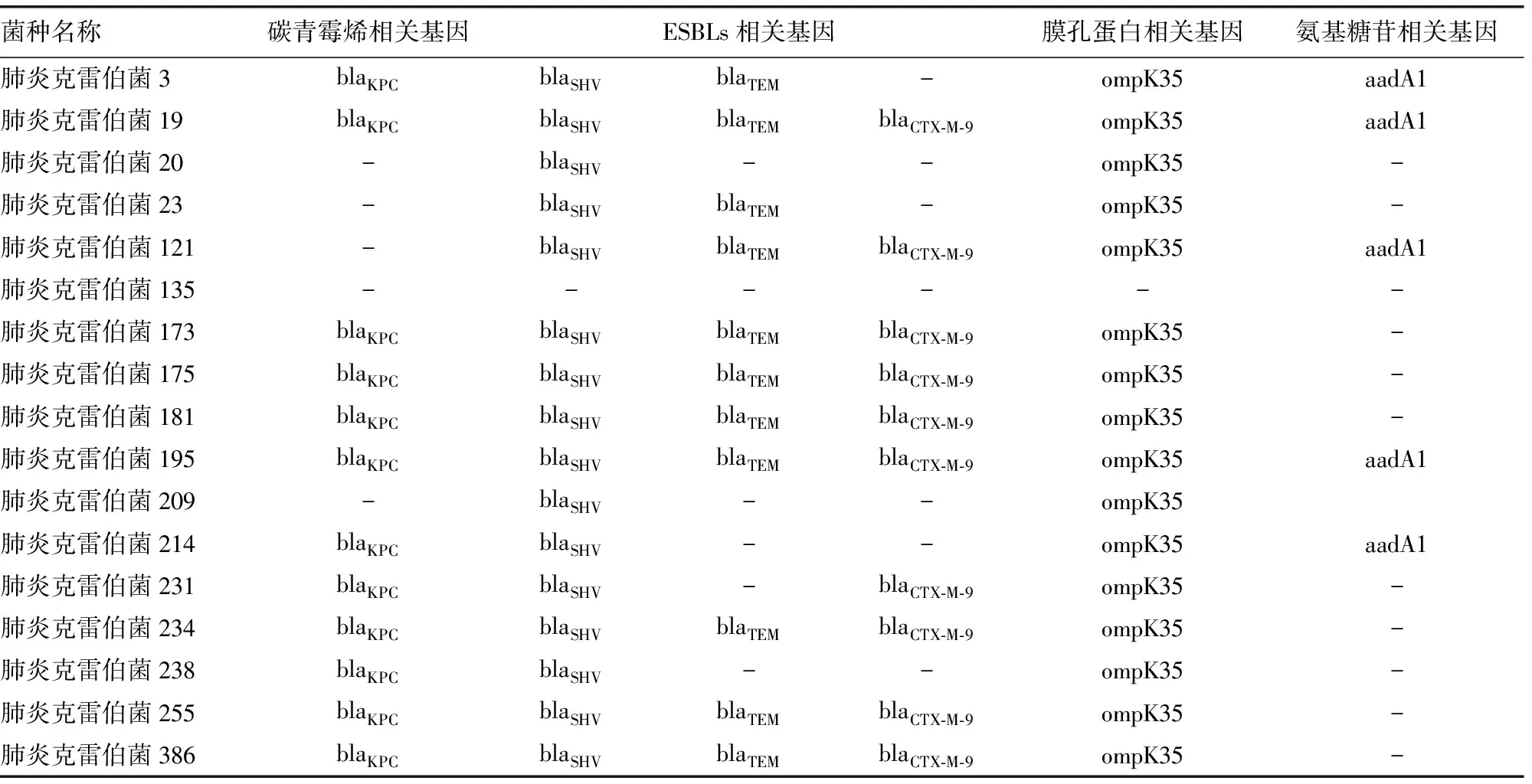
表1 耐药肺炎克雷伯菌基因型
注:-表示未检测出该基因

图1 肺炎克雷伯菌的基因型微流控芯片检测

表2 不同耐药基因型的特异峰
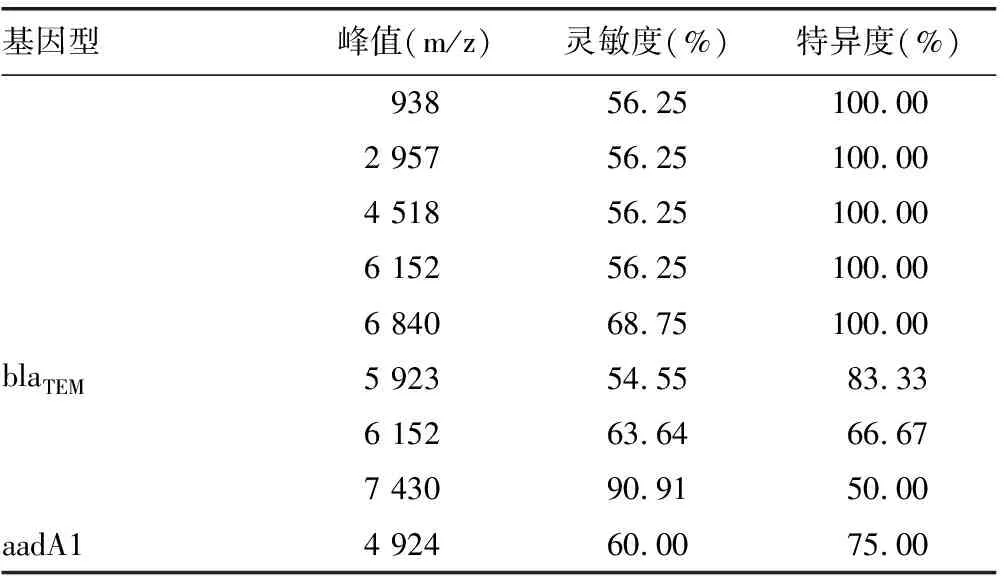
续表2 不同耐药基因型的特异峰
3 讨 论
肺炎克雷伯菌是临床肠杆菌科细菌重症感染的重要细菌之一[7],由于近年来肺炎克雷伯菌的耐药率逐年增加,从而导致临床治疗遇到困难。耐药基因的检测可以解决时间长的问题,且可以实施精准用药,目前检测肺炎克雷伯菌耐药基因的方法主要以多重PCR为主,操作较为繁琐且假阳性率高,在临床微生物实验室开展难度较大[8]。MALDI-TOF MS目前在临床微生物实验室已经成为病原菌鉴定的常规方法,具有快速、简便等特点。通过SARAMIS Premium软件中质量图谱与自带数据库的比对,可获得细菌的种属信息,分别对比具有不同耐药基因的微生物质谱数据,可以获取具有特定耐药基因的特定蛋白峰,进而提供药敏数据[9]。
本研究对比blaKPC基因型与无blaKPC基因型的菌株,分析发现4 518 m/z的峰可能作为blaKPC基因型对应的特异峰,其灵敏度可达到75.00%(8/12),且在非blaKPC基因型的耐药菌中均未发现此峰,因此认为此峰可能与肺炎克雷伯菌对碳青霉烯类抗菌药物耐药关系密切。有研究报道[3],通过肉眼观察特异峰4 521 m/z存在与否对ST11型产blaKPC肺炎克雷伯菌进行鉴别的特异度为95.20%,灵敏度为96.90%。由于可能存在校准差异与峰形位移等,可以将4 521 m/z与本实验中得到4 518 m/z视为同一个峰。但由于本实验没有针对blaKPC基因型进行进一步分型,因此4 518 m/z特异峰的灵敏度只达到75%。即便如此,此峰在临床快速鉴定产碳青霉烯酶型肺炎克雷伯菌仍有巨大应用潜力。
对比blaCTX-M-9基因型与无blaKPC基因型的肺炎克雷伯菌,其中4 518 m/z的灵敏度为80.00%(8/10),特异度为85.70%(6/7),其灵敏度与特异度相较其他特异峰均较好,但通过耐药基因检测结果发现,具有blaCTX-M-9基因型及具有blaKPC基因型的菌株高度重合,因此认为4 518 m/z应与blaKPC基因关联更密切而与blaCTX-M-9基因型关系不大。同时,6 152 m/z特异峰的灵敏度为70%(7/10),特异度为71.43%(5/7),其可能与blaCTX-M-9基因型存在一定关联。但唯一1株只具有blaCTX-M-9但不具有blaKPC基因的121号肺炎克雷伯菌不具有6 152 m/z特异峰,因此其与blaCTX-M-9基因的关联无法确定。因此需增加样本量对其进行检测,才能进一步探讨两者间的关系。同时,将具有blaTEM基因型与无blaTEM基因型的菌株进行对比,7 430 m/z的特异峰虽然灵敏度高达90.91%,但特异度只有50.00%,因此认为其可能与肺炎克雷伯菌存在耐药本身有关。
从基因测序结果来看,只有135号肺炎克雷伯菌的基因中不存在blaSHV和ompK35,其余全部菌株中均存在这两个基因型,导致这两种基因型的阴性株过少。因此,即使在此基因型的对比分析中存在灵敏度高达81.25%的728 m/z的峰,也不能排除是否是由于个体差异或者是随机误差导致的。且即使特异峰的结果具有一定意义,也无法确定其与blaSHV或ompK35基因型其中哪一种基因型有关,或是两种基因型共同作用的结果[10-11]。因此此特异峰在本实验中不具有临床意义。在今后的研究中仍需对这两个基因型进行进一步研究。
有报道称,日本学者发现产blaKPC型碳青霉烯酶肺炎克雷伯菌的特异峰11 109 m/z,该特异峰的本质为PKPQIL-p019蛋白,编码该蛋白的基因与blaKPC毗邻位于PKPQIL型质粒的Tn4401转座子内[12]。然而该质粒仅仅在日本流行,在其他地区流行的不携带该质粒的产碳青霉烯酶型肺炎克雷伯菌无法检测到该特异峰[13]。在本实验中获得的鉴定图谱中亦未发现11 109 m/z的特异峰。据此推测,对于遗传背景不同、同源性相差较大的菌株,其特异峰应也不尽相同,且其他基因型,其他耐药机制的耐药菌应都有一定地区差异性。因此,在此次试验中检测的北京天坛医院的28株肺炎克雷伯菌,说明其可能在本地区流行病学中具有一定临床意义。这也从侧面说明了MALDI-TOF MS检测在区域流行病学里对流行病病原菌的研究中拥有良好的应用前景。
本实验一共纳入了首都医科大学附属北京天坛医院的耐药菌17株,敏感菌11株,对其中存在的多种基因型均分别进行了比对,但实验仍具有一定局限性:(1)样本总量过少,某一基因型的耐药菌及无某一基因型的耐药菌株过少,结果可能在一定程度上反映了相对应的耐药机制,但仍不可避免的具有一定不可控性。blaSHV和ompK35基因型由于阴性对照过少无法得出结论,其余基因型由于阳性标本数量过少而无法得出结论,因此在今后的研究中将进一步增加样本量。(2)临床难以得到单一基因型的耐药肺炎克雷伯菌。复合耐药基因之间可能存在相互干扰,转录产生的蛋白之间有可能会发生反应,从而产生新的特征峰,但由于缺乏单一耐药基因的菌株,从而难以确定特征峰到底是由于几种基因共同存在而产生的还是仅与其中某单一基因型有关。(3)MALDI-TOF MS方法无法定量检测。某些基因型导致的耐药可能是高表达和低表达的关系,并不是“有或无”,但由于MALDI-TOF MS的工作原理,峰的高低只是相较于参比峰的比值,并不是该细菌内此物质的绝对值多少,所以此类耐药机制的基因型可能用此方法难以检测。
综上所述,通过本研究表明使用MALDI-TOF MS来快速鉴定肺炎克雷伯菌耐药方式是实际可行的,且找到了如blaKPC与blaCTX-M-9的质谱相关蛋白。通过检测耐药肺炎克雷伯菌存在的特异峰来快速辨明其耐药机制,具有快速、简便、经济且适用性强等优点,对指导临床用药和流行病学分析具有重要意义。
4 结 论
本研究显示,利用MALDI-TOF MS对具有不同耐药基因型的肺炎克雷伯菌进行耐药性的预测具有一定的可行性,尤其是对于产碳青霉烯酶及ESBLs相关基因,灵敏度与特异度均维持在较高的水准,值得进行深入研究。
