双酶法提取红松籽油及其抗氧化分析
2019-12-26周琪韦家辉盛智丽王金萍刘俊梅王君李晓玉杨雨春
周琪,韦家辉,盛智丽,王金萍,刘俊梅,王君,李晓玉,杨雨春,*
(1.吉林农业大学食品科学与工程学院,吉林长春130118;2.吉林省林业科学研究院,吉林长春130033;3.吉林省露水河林业局,吉林白山134506)
红松(Pinus koraiensis)是长白山阔叶红松林生态系统建群树种,东北主要经济树种,具有较高的经济价值[1]。红松籽仁含有丰富的蛋白质、膳食纤维、碳水化合物等多种营养成分,松仁总脂肪酸中不饱和脂肪酸约占90%,其中包括皮诺敛酸(Pinolenic)。研究表明,皮诺敛酸具有降脂作用,改变各种载脂蛋白基因的表达水平,同时摄入皮诺敛酸可降低血清中血清水平[2]。而且,它会起到一个食欲抑制效应,因为皮诺敛酸在胃肠道中的存在有效地触发近端小肠(十二指肠)中的饱和性肠激素胆汁-囊激酶的释放,并且胰高血糖素样肽-1在远端小肠(回肠)中[3]。此外,它还具有抗炎、解热、镇痛、对抗各种真菌、病痛感染,促进中老年人排泄等功能[4]。松籽油含有的总酚与VE使其具有较强的抗氧化能力,还含有角鲨烯、芝麻素、谷甾醇、虾青素等甾醇类物质,具有优良的营养价值[5-6]。然而,由于红松结实存在大小年现象,导致年量不稳,而且多以粗产品销售为主,致使其利用度差、附加值低。因此,拓展其产品利用价值,成为突破其产业瓶颈的重要途径[7]。
目前提取植物油方法主要有压榨法、索氏抽提、冷浸法、超临界、超声波、水酶法等,其中超声波是一种较好的提取方法,它是利用在液体中产生的空化作用破坏油料细胞壁,使其内容物质得到释放,从而提高提油率,而且对油脂的破坏也小[8]。水酶法是近年才发展起来的一种技术,它是在机械破碎的基础上,通过酶对细胞结构中脂蛋白、脂多糖的分解作用,增加油料组织中油的流动性,从而使油游离出来,其作用条件温和、能耗低、提取的油纯度高、有效的保护了油脂成分[9-10]。蜗牛酶作为一种新型酶,它是含有纤维素酶、果胶酶等多种混合酶的总称,主要用于酵母细胞壁的破碎、山楂汁的澄清和果酱的制作[11]。因此,本文旨在探讨超声辅助和蜗牛酶辅助提取松子油工艺的可行性以及明确红松籽油的抗氧化活性。
1 材料与方法
1.1 材料
脱皮红松籽仁:产自抚松县露水河;Alcalase碱性蛋白酶(活力200 000 U/g):上海将来实业股份有限公司;Snailase蜗牛酶(破壁率90%):北京鼎国昌盛生物技术有限责任公司;1,1-二苯基-2-苦肼基:上海源叶生物科技有限公司;无水乙醇、盐酸、氢氧化钠(均为分析纯):北京化工厂。
1.2 仪器与设备
PTT-B6000型电子天平:福州华志科学仪器有限公司;XBLL-SO1型商用现磨豆浆冰沙调理机:上海帅佳电子科技有限公司;KQ3200DB型数控超声波清洗器:昆山市超声仪器有限公司;pH计:梅特勒托利多仪器有限公司;CHA-S型恒温振荡器:常州国华电器有限公司;SIGMA 3K15国华离心机:北京五洲东方科技发展有限公司;BCD-570WPCJ冰箱:合肥美菱股份有限公司;M200型微孔板扫描分光光度计Tencan Infinite:上海迪奥生物科技有限公司;Agilent7890A液相色谱-质谱联仪(配有电喷雾离子源):美国安捷伦科技有限公司。
1.3 方法
1.3.1 超声波和酶处理
将红松籽仁破乳,取10.00 g松籽乳按1∶5(g/mL)料液比加入蒸馏水,混合均匀后置于超声波清洗仪中,超声波条件依据前人研究结论设置,即超声功率为75.00 W、超声时间为40.00 min、超声温度为45.00℃[12],超声波处理后先加碱性蛋白酶,在前人试验基础上确定试验碱性蛋白酶的最适作用条件为加酶量2 364.00 U/g,温度51℃,时间3.00 h,料液比1 ∶5(g/mL),pH 8.40[13]。碱性蛋白酶处理后,加入蜗牛酶,对酶解时间(30 min~120 min)、加酶量(20.00 mg/10g松子乳~60.00mg/10g松子乳)、酶解温度(30.00℃~50.00℃)和酶解pH值(5.00~9.00)等参数先进行单因素试验初步优化,酶解时间确定为1.00 h,其他因素进行响应面优化。酶解1.00 h后升温至100.00℃灭酶8.00 min,8 000 r/min离心15 min[13],小心吸取上层清油Ⅰ,将乳状液二次离心,分离上层清油Ⅱ,将二次离心后得到乳状液置于-20℃冷冻24.00 h,油相结晶可以刺入水相,从而大幅度降低乳状液稳定性,达到破乳的目的。解冻分离上层清油Ⅲ,合并三部分清油,计算红松籽油得率。
公式如下:
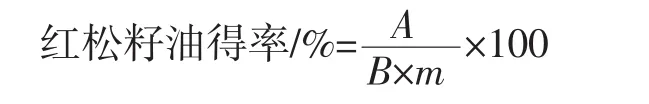
式中:A为总游离油质量,g;B为松籽乳质量,g;m为松籽仁含油脂量,%。
1.3.2 响应面试验设计
在单因素试验的基础上,关键因素得以确认,将蜗牛酶的加酶量、酶解温度和酶解pH值作为自变量,因变量为提油率和皮诺敛酸的量,然后进行响应面试验设计,模型共进行20次试验,14组析因试验,6组中心试验,用以估计试验误差[14]。
1.3.3 皮诺敛酸的测定
红松籽油脂肪酸甲酯的制备:吸取0.20 mL红松籽油,加入4.00 mL 0.5 mol/L的氢氧化钠-甲醇溶液,在65.00℃水浴搅拌大约15.00 min,待油滴完全消失后,再加入3.00 mL 20%三氟化硼-甲醇溶液,继续反应5.00 min,混合液加入10.00 mL石油醚和10.00 mL水,萃取两次后合并石油醚层备用。
色谱条件:Agilent7890A,选用30 m×0.32 mm石英毛细管柱,FID氢火焰离子检测器,进样温度250.00℃,检测器温度250.00℃,载气流速1.00 mL/min,分流比10∶1,升温程序 140.00℃保持 5.00 min,以1.80℃每分钟加热至220.00℃保持20.00 min,进样量1 μL,运行65.00 min。
质谱条件:安捷伦MS5977,EI离子源;离子源温度230.00℃;接口温度280.00℃;电子能量70.00 eV;倍增器电压1.80 kV;溶剂切除时间为3.50 min;质谱扫描方式为SCAN;质量扫描范围30 amu~400 amu。
1.3.4 抗氧化活性测定
依据文献进行DPPH自由基清除活性测定[15]。
1.4 数据处理
采用Microsoft Excel 2010和SPSS 19.0软件处理数据整理数据,并利用SPSS19.0进行进行单因素方差(One-way Anova)和多因素方差分析(Multi-way Anova)分析(Multi-way Anova)检验不同处理之间的差异(LSD,α=0.05),图像采用 Origin 7.5,所有数据为平均值±标准误差。
2 结果与分析
2.1 红松油酸标准品测定结果
对红松籽油脂肪酸甲酯进行了GC-MS分析,根据GC-MS联用仪获得质谱信息,经数据库检索与标准谱图对照,分析了主要脂肪酸含量,对色谱图进行面积归一化,定量了各种脂肪酸的质量分数,见图1。
由图1可知,皮诺敛酸的峰开始时间为39.335min,结束时间为40.558 min。
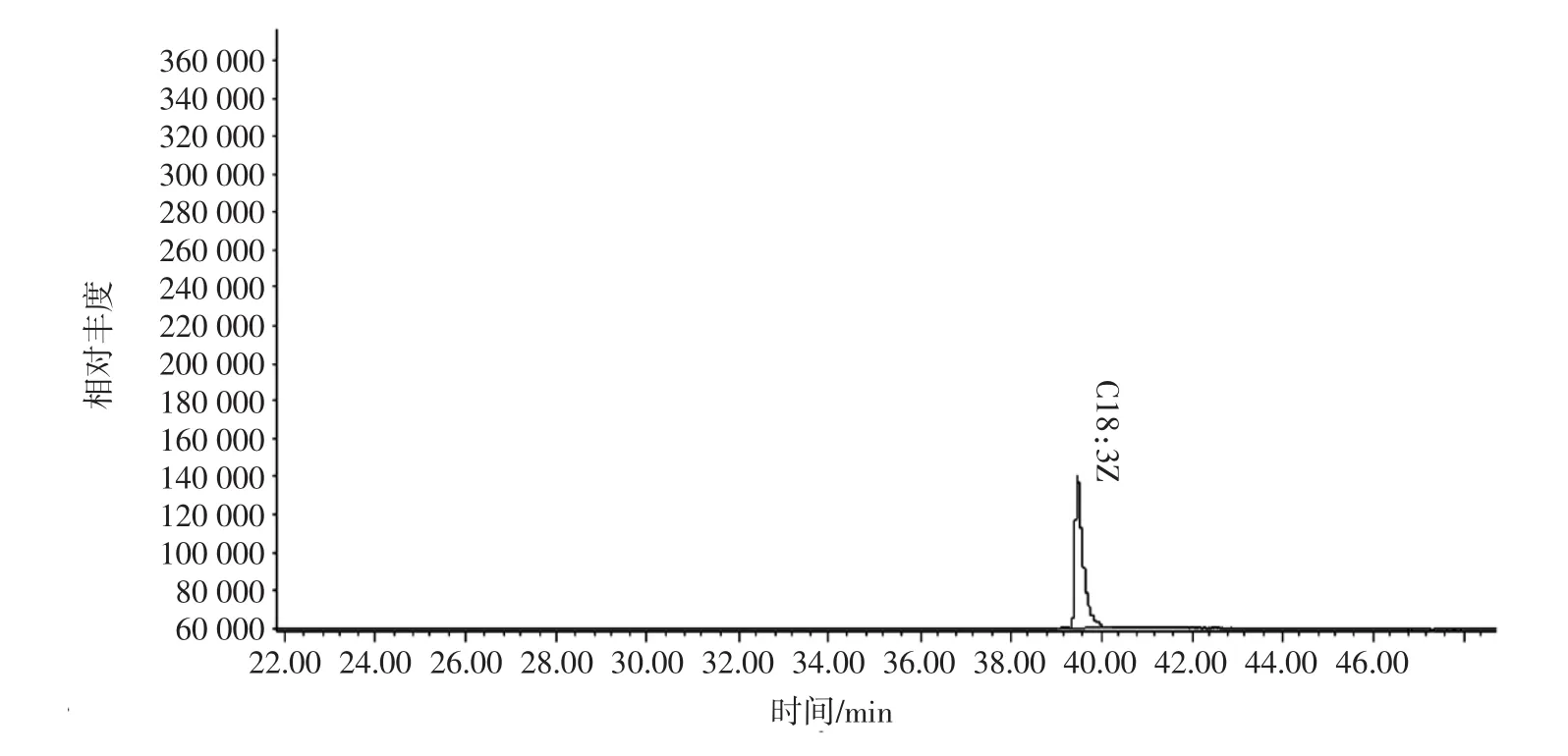
图1 红松油酸标准品GC-MS总离子流图Fig.1 Total ion flow diagram of GC-MS in red pine acid standard
2.2 单因素试验结果
2.2.1 加酶量对提油率和皮诺敛酸量的影响
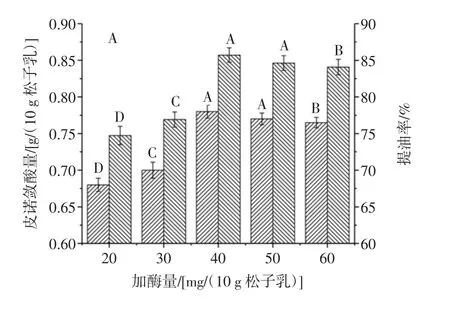


图2 加酶量、温度和pH值对皮诺敛酸量和红松籽提油率的影响Fig.2 The effects of enzyme addition amount,enzymatic hydrolysis temperature and enzymolysis pH on the extraction rate of Korean pine seed oil and the amount of pinolenic acid
加酶量对提油率和皮诺敛酸量的影响如图2A。由图2A可知,在一定范围内,随着酶量的增加,得率增加,主要是因为随着酶量的增加,酶与底物作用的越充分,酶渗透到脂质体膜内,以及酶对脂蛋白、脂多糖的分解作用,有利于油脂从复合体中释放[12];当酶用量超过50.00 mg/(10 g松子乳)时,得率呈下降趋势,这是由于底物量有限,继续增大总加酶量,过量酶会对油脂产生吸附作用,使得率略有下降[15];只有加酶量在40.00 mg/10 g松子乳~50.00 mg/10 g松子乳时,提取量达到最大,并于其他处理差异极显著(p<0.01)。综合考虑到红松籽油的提取率及成本,初步确定40.00 mg/10 g松子乳为最适加酶量。
2.2.2 酶解温度对提油率和皮诺敛酸量的影响
由图2B可知,在低于40.00℃时,得率随着温度的升高而增加;当温度达到40.00℃时,得率达到最高(p<0.01);随着温度继续升高得率降低,这是由于温度超过酶的最适温度,使酶的活性中心结构被破坏,导致酶变性或失活,并且也会加速不饱和脂肪酸的氧化速度,不利于松籽油的提取[16-18],因此初步确定最佳酶解温度为40.00℃。
2.2.3 pH值对提油率和皮诺敛酸量的影响
由图2C可知,随着pH值的增加,提油率逐渐增加;当pH值为6~7时,得率最高,且差异极显著(p<0.01);而后随着pH值的增加,得率逐渐降低,且差异极显著,主要是因为酶和pH值协同作用实现乳状液的破乳,且蜗牛酶的最适pH值在6~7时[8],酶活高,酶对底物作用的效果明显,得率高。反之,会影响酶的活性,同时降低油的乳化性[19-20],因此初步确定最佳酶解pH值为7.00。
2.3 响应面优化提油率和皮诺敛酸的量
2.3.1 响应面分析
在单因素试验的基础上,可以看出,pH值、温度和蜗牛酶的量对提油率和皮诺敛酸的量影响较大,需进一步优化。因此,采用23个全因子中心复合设计,选择这3个因素作为响应面法中的变量,将提油率和皮诺敛酸的量作为响应值,进行优化,结果见表1。
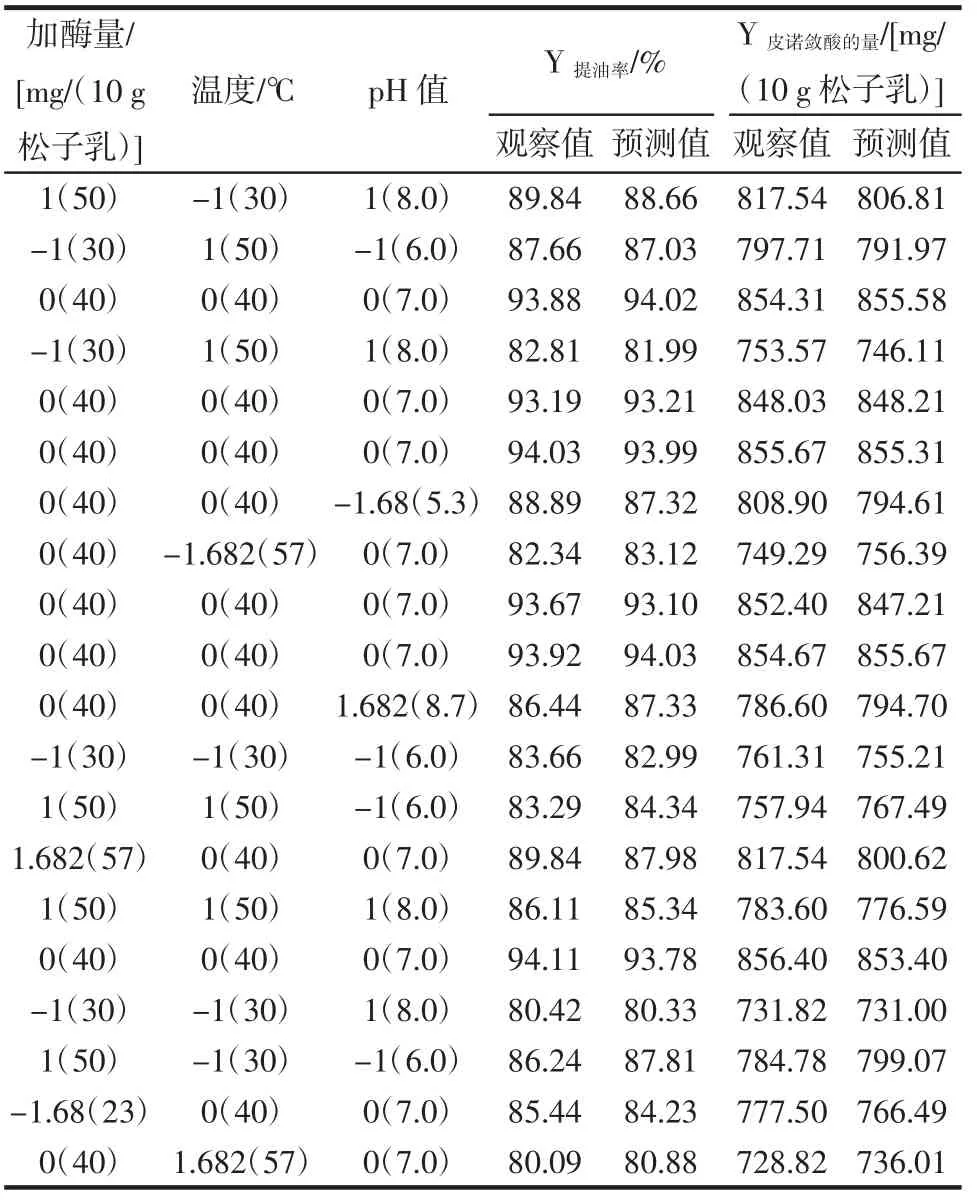
表1 中心组合设计以独立变量的原始和编码形式、提油率和皮诺敛酸的量Table 1 Central composite design setting in the original and coded form of the independent variables and experimental results of extraction rate of Korean pine seed oil and pinolenic acid
通过对二次模型进行分析,方程因变量与自变量之间的线性关系明显,该模型回归显著(p<0.001)。方差分析中可知失拟项不显著,并且该模型R12=99.51%、R22=99.47%,R12Adj=99.06%、R22Adj=99.00%,说明两种模型与试验拟合良好,自变量与响应值之间线性关系显著,试验误差小,可以用此模型来分析和预测水酶法提取红松籽油和皮诺敛酸量的结果。由此可以认为上面给出的二次回归方程模型是合适的。由F检验可以得到因子贡献率为加酶量>pH值>温度。回归方程式如下:

式中:A为加酶量,mg/10 g松子乳;B为温度,℃;C为pH值。
为了进一步研究参数对提油率和皮诺敛酸的量的交互影响,多维的三维轮廓非线性回归模型如图3所示。
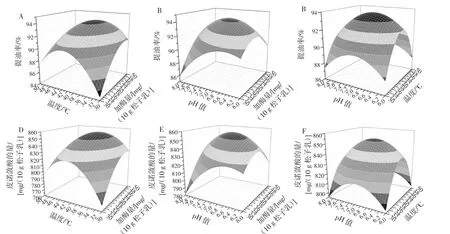
图3 加酶量、温度和pH值对提油率和皮诺敛酸的量的影响Fig.3 The Response surface of the effects of enzymatic hydrolysis temperature,enzyme addition amount and enzymolysis pH on the extraction rate of Korean pine seed oil and the amount of pinolenic acid
通过响应模型的曲面曲线图,可以直观的分析各因素的交互作用[21]。如图3所示,油脂通常与大分子结合,构成脂多糖、脂蛋白等复合体。因此只有将油料组织的细胞壁及脂质复合体破坏,才能将油脂取出。蜗牛酶通过分解细胞壁的纤维素、果胶使得内容物更多的释放出来,同时利用酶解切断脂肪酸与多糖的酯键链接,进而得到更多的各类脂肪酸[22-23]。评估酶的用量需要综合考虑得率和酶使用成本,从图3中的A、B、D、E可以看出,加酶量在40 mg/10 g松子乳左右提油率和皮诺敛酸的量达到最大值,表明40.00 mg的酶足以破坏细胞壁和脂质复合体。
事实上,酶解温度是影响提油率和皮诺敛酸的量的一个重要因素,它能够改变平衡和质量在固液萃取中转移条件[24],温度过高,既会影响酶的活性又会影响油的色泽,温度过低又会影响得率以及蛋白质的回收率[25],由图 3 中的 A、C、D、F 可以看出,随着温度的上升,提油率和皮诺敛酸的量都呈先升高后下降的趋势,表明当温度超过44℃酶的活性受到抑制,且可能会加速不饱和脂肪酸的氧化和分解[19]。
酶和pH值协同作用实现乳状液的破乳,酶解产生的小分子肽竞争吸附到油水界面导致蛋白质膜失去原有的稳定性而实现乳状液的破乳,油和蛋白质的提取机理之间存在着紧密联系,在等电点附近时,蛋白质的溶解度最低,提油率也最低,所以在提取时,既要考虑酶的最适pH值,也要考虑得率的最适pH值。由图3中的B、E可知,pH值在7.00左右提油率和皮诺敛酸的量达到最大值,当pH值超过7.00时,原因可能是影响了酶的活性和不饱和脂肪酸的活性以及蛋白质的乳化性、气泡性和持水性[19]。
2.3.2 松籽油最佳提取条件的确定
应用响应面寻优分析方法对回归模型进行分析,计算出最优响应条件为:温度43.54℃,加酶量为39.00 mg/10 g松子乳,pH7.10,在此条件下,松籽油提取率理论值为94.04%,皮诺敛酸的理论值量为856.06 mg/10 g松子乳。
2.3.3 验证试验
为方便试验操作,将酶解温度和pH值分别调整至44.00℃和7.00,同时为进一步验证提取方法的可靠性,进行了平行试验,结果表明,红松籽油提油率平均值为93.87%,皮诺敛酸量的平均值为855.77 mg/(10 g松子乳),而且与模型预测值差异不显著(p<0.01)。表明该模型能够较好地预测实际红松籽油提取率情况和皮诺敛酸的量。
2.4 自由基清除能力
1,1-二苯基-2-三硝基苯肼(DPPH)是一种自由基化合物,已被广泛用于测试目前存在的各种样品的自由基清除的能力,产生减少50%的样品浓度自由基吸光度(IC50)被用作评估其指数的指标抗氧化活性。不同植物油的抗氧化活性见图4。
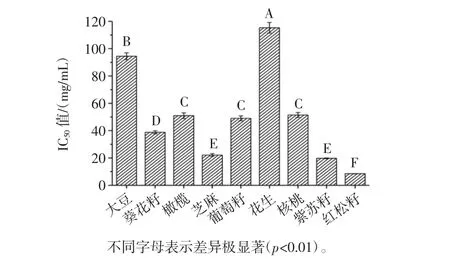
图4 不同植物油的抗氧化活性Fig.4 Antioxidant activity of different vegetable oils
由图4分析可得,采用优化工艺提取松籽油的DPPH IC50值为8.52 mg/mL。而且红松籽油和紫苏籽油与其他植物油的抗氧化活性相比,表现较好(p<0.01)。因此,本试验明确了红松籽油的抗氧化活性,同时由于紫苏籽为栽培作物,在种植过程中难免使用化肥和农药,而且产量较小,而红松为东北主要经济树种,松籽绿色环保且产量巨大,但是目前产品的深加工程度较低,只要改进适当的工艺,就能提高产品的附加值,从而更好地开发和利用该优质资源[7]。
3 结论
利用超声波辅助双酶法两步提取红松籽油,通过单因素试验和响应面优化试验,以提油率和皮诺敛酸的量为指标,得到红松籽油的最佳提取工艺条件为碱性蛋白酶加酶量2 364 U/g、温度51.00℃、时间3.00 h、pH 8.40;蜗牛酶加酶量为39.00 mg/10 g松子乳、温度44.00℃、时间1.00 h、pH7.00,松籽油得率可以达到93.87%,皮诺敛酸的量为855.77 mg/10 g松子乳,明显高于前人的研究结果。在最优条件下,通过自由基清除能力试验测定了松籽油的IC50为8.52 mg/mL,同时,红松籽油的抗氧化活性明显高于紫苏籽油等其他植物油。该工艺提高了红松籽油的提油率和皮诺敛酸的量,为红松籽油的开发和利用的开发提供了科技支持。
