CYP2C19基因多态性在冠心病经皮冠状动脉介入术后一年的随访研究
2019-12-26余东彪马礼坤余晓凡李龙伟
余东彪,马礼坤,余晓凡,李龙伟
[中国科学技术大学附属第一医院(安徽省立医院)心内科,合肥230001]
替格瑞洛及氯吡格雷现广泛用于冠心病患者经皮冠状动脉介入术(PCI)的抗血小板聚集治疗。氯吡格雷是一种前体药物,经肝脏内CYP2C19酶的代谢,转化为具有药效的活性状态,才具有抗血小板聚集的作用。但在临床应用氯吡格雷的过程中,部分患者达不到预期的抗血小板作用,严重者会出现支架血栓、再次心肌梗死甚至死亡等心血管不良事件,称为氯吡格雷抵抗[1]。研究发现,CYP2C19变异主要是CYP2C19*2和CYP2C19*3两型,这两种突变等位基因均能造成CYP2C19酶活性的降低或完全丧失,从而对氯吡格雷的疗效产生重要影响[2]。替格瑞洛是一种新型的口服抗血小板活性药物,能够可逆性结合磷酸腺苷受体,无需经过体内代谢即可发挥抗血小板作用。
但Bauer领导的大规模荟萃分析研究结果显示,CYP2C19基因多态性与氯吡格雷抵抗之间不存在关联性[3]。虽然美国食品与药品监督管理局在氯吡格雷的说明书中提醒临床医师必要时检测CYP2C19基因型以及血小板功能,美国、欧洲及中国的临床指南现已相继加入了在接受冠状动脉支架植入的患者中对CYP2C19基因型及血小板功能进行检测的推荐。但检测结果的实际临床意义及治疗措施调整方法尚不明确[4-6]。
本研究以心脏缺血性事件和出血事件为指标,对分别接受替格瑞洛及氯吡格雷治疗的冠心病PCI患者进行12月后随访,对比观察两者的临床疗效,并进一步探讨两者的药效及其与CYP2C19基因多态性关系。
1 对象和方法
1.1 研究对象 选取2016年4月到2017年5月在我院接受住院治疗并行PCI手术的急性冠脉综合征患者492例。入院标准:(1)行冠状动脉造影术确诊为冠心病,包括不稳定型心绞痛、ST段抬高型心肌梗死和非ST段抬高型心肌梗死;(2)行支架植入术。排除标准:(1)存在替格瑞洛、阿司匹林或氯吡格雷禁忌证或其他原因导致不能耐受者,如合并严重的肝肾功能不全、活动性出血;(2)存在凝血功能障碍或30 d内大手术史、6个月内消化道出血史、既往有颅内出血史;(3)合并恶性肿瘤疾病。
1.2 研究方法 根据患者口服抗血小板聚集药物分为氯吡格雷组和替格瑞洛组。氯吡格雷组:术后每天口服1次75 mg氯吡格雷和0.1 g阿司匹林;替格瑞洛组:术后口服替格瑞洛90 mg(每天2次),联用阿司匹林0.1 g(每天1次)。
1.3 CYP2C19基因型测定 应用CYP2C19基因检测芯片试剂盒(上海百傲科技有限公司)进行基因型检测:EDTA抗凝管采集静脉血2 mL,充分混均(避免凝血或溶血),-20 ℃保存。1周内提取样本DNA,并检测所提取的DNA(利用1.0%的琼脂糖凝胶电泳检测,DNA电泳带整齐,荧光较强)。将总DNA进行PCR扩增,应用基因芯片杂交的方法检测基因型,根据芯片上的位点排列顺序确定CYP2C19基因型。根据人群对氯吡格雷代谢动力学特点,分为野生型快代谢型(CYP2C19*1/*1)、突变杂合子型为中代谢型(CYP2C19*1/*2、CYP2C19*1/*3)和突变纯合子型为慢代谢型(CYP2C19*2/2*、CYP2C19*2/3*、CYP2C19*3/3*)。
1.4 研究终点及随访 服药12个月后对所有患者进行电话或者门诊随访。观察术后1年主要不良事件:心源性死亡、支架内血栓形成、急性心肌梗死、再发心绞痛及靶血管血运重建;出血事件包括大出血:致死的或临床明显的出血,需输血或住院处理的,如脑出血、消化道大出血等;中等出血:较为明显的出血,但是不需要输血或住院处理;小出血:牙龈出血或直径<2 mm的皮下出血如黏膜、皮肤、鼻部等小出血。

2 结果
2.1 两组患者一般资料比较 氯吡格雷治疗组354例,替格瑞洛138例,两组中年龄、性别、体质指数(BMI)、危险因素、肌酐、血红蛋白及左心室射血分数等基数资料比较,差异均无统计学意义(P>0.05)。见表1。

表1 两组患者一般资料比较
注:BMI为体质指数;PT为凝血酶原时间;PT-INR为国际标准化比率;APTT为活化部分凝血活酶时间
2.2 两组患者间MACE事件及出血发生率的比较 在一年随访中,替格瑞洛组和氯吡格雷组,两组死亡人数分别为8个和9个,差异无统计学意义,且两组心肌梗死、心绞痛、脑卒中差异均无统计学意义;随访中两组均无大中出血,小出血替格瑞洛组有增加趋势,但差异无统计学意义。见表2。

表2 两组患者间MACE事件及出血发生率的比较[例(%)]
注:MACE为主要心脏不良事件;-为精确概率检验,无统计量
2.3 各CYP2C19基因亚组1年随访分析 替格瑞洛组和氯吡格雷组中CYP2C19基因快、中、慢亚组分型中,各亚组分型中死亡率、心肌梗死、心绞痛及脑卒中均无统计学意义,大中等量出血均无发生,小出血中慢代谢亚组中,替格瑞洛组有增加趋势,但差异无统计学意义。见表3。
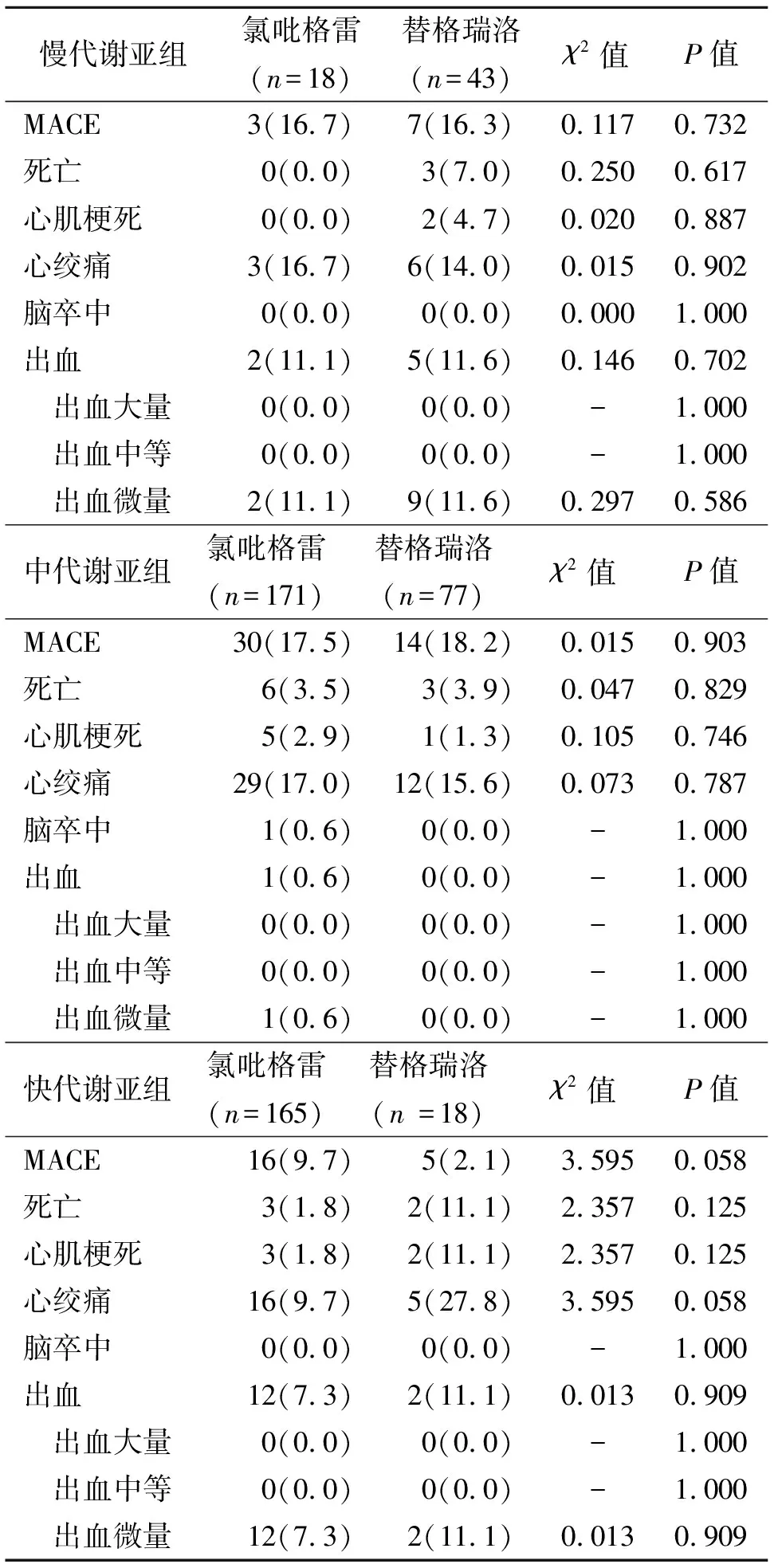
表3 各CYP2C19基因亚组1年随访结果分析[例(%)]
注:MACE为主要心脏不良事件;-为精确概率检验,无统计量
3 讨论
近年来,欧美及中国针对急性冠脉综合征患者均推荐首选替格瑞洛治疗,氯吡格雷作为双联抗血小板聚集治疗的基石有所动摇。PLATO研究证明了替格瑞洛可以降低MACE,然而,在亚组分析中,替格瑞洛仅在30 d后降低MACE事件上[7]。2017年VERCELLINO等学者经过倾向性评分调整之后发现,替格瑞洛和氯吡格雷在一年内降低MACE事件上并无差异[8]。
国内外研究均已证实CYP2C19基因多态性可导致血小板对氯吡格雷反应的可变性。临床上通过对PCI术后患者的CYP2C19基因多态性进行早期检测,希望可以根据其不同基因多态性位点对氯吡格雷作用的影响来合理优化用药方案,实现个体化治疗。但是,对于PCI术后患者常规检测CYP2C19基因多态性指导临床治疗是存在争议的,国内这方面的研究也很少。本研究通过随访ACS患者服用一年的氯吡格雷或者替格瑞洛。替格瑞洛较氯吡格雷小出血风险有增加趋势,但大中出血并无增加,替格瑞洛组较氯吡格雷组一年的死亡率无统计学意义,在CYP2C19快、中、慢代谢亚组中,替格瑞洛与氯吡格雷死亡率仍差异无统计学意义。这与2011年欧洲Bauer等[9]领导的小组对关于CYP2C19基因多态性与不良心血管事件关联性的15项原创性研究进行了荟萃分析的试验结果相同。结论是CYP2C19基因多态性与氯吡格雷的临床效用无实质性关系,分析其原因可能是CYP2C19基因多态性并非个体间对氯吡格雷反应性差异存在的唯一因素,年龄、体质指数、血脂水平、合并用药及氯吡格雷剂量等多种因素可对患者的血小板活性差生影响[10]。另外,CYP2C19的基因多态性分布存在明显的种族和地域差异,亚洲人群中CYP2C19*2的变异型等位基因频率明显高于白人和非洲裔美国人[11]。因此对不同种族及不同地域人群进行氯吡格雷低反应性的基因多态性研究也很有必要。
