重症老年患者伏立康唑血药谷浓度监测回顾性临床分析
2019-12-26徐丙发
王 佳 徐丙发 秦 侃
安徽医科大学第三附属医院药学部,安徽合肥 230061
伏立康唑是第二代三唑类药物,抗真菌谱广,目前临床应用广泛[1-2]。研究表明,伏立康唑血药谷浓度的安全范围为1.0~5.5 mg/L[3],且该药物治疗窗较窄,低于该标准下线会导致药物的临床治疗效果不佳,高于其标准上线会出现一系列不良反应,如视觉改变、肝肾功能异常等。由于伏立康唑血药浓度影响因素较多,特别是老年患者伏立康唑血药浓度的异质性更为明显[4-6]。故本研究监测分析老年重症患者伏立康唑的血药浓度,意为老年重症患者合理用药提供依据。
1 资料与方法
1.1 一般资料
回顾性分析2014 年1 月~2018 年12 月安徽医科大学第三附属医院(以下简称“我院”)收治的老年危重症患者43 例,其中男23 例,女20 例;平均年龄(77.4±9.3)岁。急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分平均(22.91±4.70)分;呼吸系统感染39 例,血液系统感染4 例。
纳入标准:①年龄≥60 岁;②重症患者。排除标准:①对伏立康唑耐药者;②无法评价疗效者。
1.2 治疗方法
43 例患者起始时静滴伏立康唑(辉瑞制药有限公司,批号:Z544001、Z484501),200 mg/12 h,首日给药剂量加倍,平均用药时间(13.3±9.8)d。静脉给药4~5 d 后,次日清晨给药前30 min 抽取空腹静脉血2 mL,置于乙二胺四乙酸(EDTA)抗凝管中,3000 r/min 离心5 min,离心半径为6.0 cm。取上清液。
1.3 研究方法
使用Waters 269 高效液相色谱仪工作站(Waters2489 紫外检测器,美国)。色谱柱:HypersilODS2 C18(4.6 mm×250 mm,5 μm),流动相为乙腈∶0.16%冰醋酸=47∶53,流速为1.0 mL/min,检测波长254 nm,柱温35℃。
1.4 观察指标
1.4.1 伏立康唑稳态血药谷浓度(Cmin)若Cmin不在1.0~5.5 mg/L 的范围内,调整用药剂量,使浓度在推荐范围内。
1.4.2 伏立康唑Cmin的单因素分析 将性别、血浆白蛋白(ALB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、是否合并使用质子泵抑制剂(PPI)等可能影响到伏立康唑Cmin进行单因素分析。
1.4.3 伏立康唑Cmin的多因素分析 将性别、体重指数、是否合并使用PPI、体质量标准化剂量、ALB、AST、APACHEⅡ评分、TBIL 等可能影响到伏立康唑Cmin进行多元线性回归分析。见表1。

表1 多元线性回归分析赋值表
1.4.4 ALB 水平对伏立康唑的临床效果及不良反应发生情况 根据ALB 水平将患者分为ALB<35 g/L 及ALB≥35 g/L,比较ALB 水平对伏立康唑的疗效及不良反应的发生情况。
1.5 疗效评定标准
有效:临床症状体征基本消失,复查实验室及病原学检查均显示正常;无效:用药72 h 后病情无显著好转甚至加重。
1.6 统计学方法
采用R 3.5.3 统计学软件进行数据分析,计量资料用均数±标准差()表示,两组间比较采用t 检验;计数资料用百分率表示,组间比较采用χ2检验。相关分析采用Pearson 相关分析。采用多元线性回归分析血药浓度的危险因素,以P <0.05 为差异有统计学意义。
2 结果
2.1 伏立康唑Cmin分布情况
伏立康唑的Cmin共测试78 次,其中测试两次35 例,1 次8 例,平均浓度(4.13±2.43)mg/L;54 次(69.2%)Cmin浓度为1.0~5.5 mg/L,平均(3.45±1.21)mg/L;11 次Cmin浓度为(14.1%)>5.5 mg/L,平均(6.13±1.78)mg/L;13 次(16.7%)Cmin浓度为<1.0 mg/L,平均(0.76±0.14)mg/L。
2.2 伏立康唑Cmin的单因素分析
ALB、AST 是影响血药谷浓度的危险因素,而性别、ALT、TBIL、合并PPI 不是影响血药谷浓度的危险因素。TBIL≤24 μmol/L(我院肝功能正常值的上限)和TBIL>24 μmol/L 的平均Cmin比较,差异无统计学意义(P >0.05)。PPI 在体内主要经过CYP2C19 酶代谢,而伏立康唑不仅是CYP2C19 酶的底物,也是其抑制剂,故二者联用可能会产生相互作用[7],故使用PPI 和未使用PPI 比较,差异也无统计学意义(P >0.05)。见表2。
2.3 ALB 及AST 与Cmin相关性分析
结果显示,ALB 与Cmin呈负相关(r=-0.903,P=0.0003);AST 与血药谷浓度呈正相关(r=0.872,P=0.0005)。见图1~2。
2.4 伏立康唑Cmin的多因素分析
结果显示,ALB、AST 是影响伏立康唑Cmin的独立危险因素,其中ALB 的回归系数为-0.675(P=0.029),而AST 的回归系数0.792(P=0.018)。多元线性回归方程为C(μg/ml)=1.45+67×10-2×ALB(1>35 g/L,0≤35 g/L)+79×10-2×AST(0>80 U/L,1≤80 U/L)。见表3。
2.5 ALB 水平对伏立康唑的临床效果及不良反应发生情况比较
结果显示,ALB<35 g/L 患者有效率低于ALB≥35 g/L,不良反应发生率高于ALB≥35 g/L 组,差异有统计学意义(P <0.05)。见表4。

表2 伏立康唑Cmin的单因素分析

图1 ALB 与Cmin的相关性分析
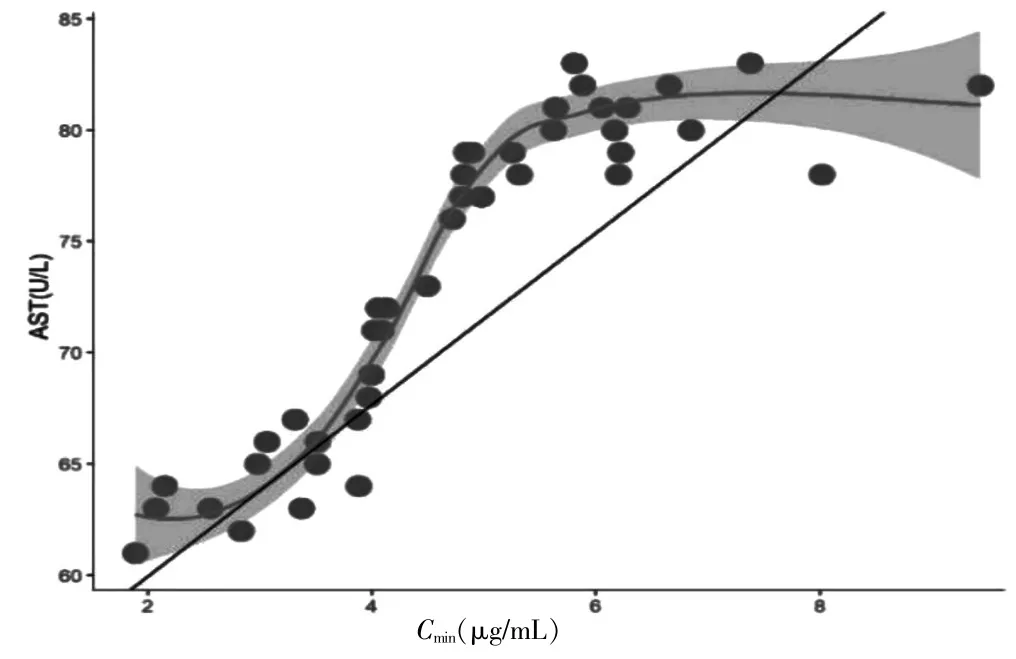
图2 AST 与Cmin的相关性分析
3 讨论
大量的研究表明,伏立康唑的治疗窗范围较窄[4-8],由于伏立康唑血药浓度的影响因素较多,特别对于老年患者,血药浓度的异质性就更为明显[9-12]。本研究发现,54 次(69.2%)Cmin浓度为1.0~5.5 mg/L,而30.8%老年患者的血药谷浓度不在目标范围内。多元线性回归分析发现影响伏立康唑Cmin的危险因素为ALB、AST。重症老年患者更易出现负氮平衡,进而引起低蛋白血症。低蛋白血症同重症患者的死亡率密切相关,国外研究发现ALB 每减低5 g/L,重症患者死亡率将增加10%,因而低蛋白血症可作为重症患者预后的一个重要的指标[13-16]。本研究结果显示,ALB 与Cmin呈负相关,同时发现ALB<35 g/L 患者其Cmin明显高于ALB≥35 g/L,这与国内学者报道的结果一致[17-21]。然而梁培等[13]报道白蛋白水平不是影响伏立康唑的Cmin因素,其原因可能为38.2%的患者是60 岁以下,同时其平均Cmin均低于老年患者,而本研究只分析了60 岁以上的老年患者,导致差异出现。此外,研究还发现发现ALB<35 g/L 患者的有效率低且不良反应发生率高,差异有统计学意义(P <0.05)。

表3 伏立康唑血Cmin的多因素分析

表4 ALB 水平对伏立康唑的临床效果及不良反应发生情况比较[例(%)]
研究显示,AST 是影响Cmin的危险因素,其水平同Cmin呈正相关。伏立康唑Cmin同碱性磷酸酶(ALP)密切相关。匹兹堡大学的感染研究的报道209 例同肝功能的AST 的Spearman 秩相关性分析发现其具有明显的相关性[22]。本研究结果同样发现上述的相关性。
综上所述,由于重症老年患者的机体内环境及相应的病理生理情况的变化,导致其药代动力学情况复杂。因此影响伏立康唑的血药浓度的因素较多,个体情况差异较大,在伏立康唑给药时,应充分考虑各种因素,同时应密切监测其血药浓度,提高临床用药的安全性。
