综合康复训练对老年慢性肾脏病并发肌少症的效果
2019-12-25张勃吴春薇桂沛君马清张通谢瑛
张勃,吴春薇,桂沛君,马清,张通,谢瑛
1.首都医科大学康复医学院,北京市 100068;2.首都医科大学附属北京友谊医院,a.康复医学科;b.老年医学科,北京市 100050;3.中国康复研究中心北京博爱医院神经康复科,北京市 100068
慢性肾脏病(chronic kidney disease,CKD)已经成为威胁人类健康的重要公共卫生问题,世界范围的患病率约为8%~16%[1],我国CKD 的患病率已高达10.8%[2],且患病率随年龄的增长而升高。已有研究显示[3],肌少症在CKD 患者中很常见,并且随着CKD严重程度的增加,发病率也随之增加。肌少症也是随着年龄的增长而出现的综合性退行性病征,会导致肌力减弱,运动和平衡能力下降,跌倒风险增加,最终增加CKD患者的整体病死率[3-4]。
有研究表明[5],骨骼肌质量的减少可导致患者身体活动能力衰退,并可能与肾小球滤过率的下降相关,从而影响CKD 患者的预后。目前国内外关于老年CKD患者并发肌少症的运动干预报道并不多见。
本研究以低中强度有氧运动联合抗阻运动作为干预手段,观察老年CKD 并发肌少症患者运动前后生理功能和肾功能变化,提供运动有效性的循证医学依据,以指导临床制定更安全、有效的运动处方。
1 资料与方法
1.1 一般资料
选取2018 年至2019 年在本院老年科就诊的CKD并发肌少症的患者。
CKD诊断标准:符合国际肾脏病基金会肾脏疾病转归质量(National Kidney Foundation-Kidney Disease Outcomes Quality Initiative,NKF-K/DOQI)慢性肾脏疾病临床实践指南(2002)中CKD 3~5 期诊断标准。肌少症诊断标准:四肢骨骼肌质量指数(appendicular skeletal muscle mass index,ASMI)男<7.0 kg/m2;女<5.4 kg/m2。
纳入标准:年龄65岁以上,生命体征稳定,意识清楚,可配合研究。
排除标准:①有认知功能障碍、严重行为问题或精神错乱,不能配合训练;②各种疾病导致的四肢关节疼痛、活动受限;③伴有重要的器官(心、肺、肝等)衰竭、恶性肿瘤、病情不稳定;④急性肾损伤、慢性肾功能不全急性加重;⑤正在进行或预计1 年内接受肾替代治疗。
最终纳入11 例患者。全部为老年男性,年龄74~89岁,平均(80.27±4.98)岁;高血压肾损害8例,慢性肾小球肾炎3 例;估算肾小球滤过率(estimated glomerular filtration rate,eGFR)为(46.45±11.09)ml/(min ▪1.73 m2)、血红蛋白(130.63±10.47)g/L、尿微量白蛋白4.57(1.94,8.86)mg/dl。
本研究经首都医科大学附属北京友谊医院医学伦理委员会审批通过。
1.2 方法
在常规内科治疗的基础上给予低中强度有氧运动联合抗阻运动干预。
常规内科治疗包括药物和饮食管理。运动干预为医院内监管下治疗,患者来治疗室按运动方案训练,每周3次。
每个运动单元包括30~50 min 有氧运动联合20~30 min 抗阻运动,每周3 次,共12 周。有氧运动为跑台训练,根据6 分钟步行测试(6-minute Walk Test,6MWT)结果估算的峰值摄氧量(VO2peak)为依据设计个性化的低中强度有氧运动,有氧训练方案[6]见表1。抗阻训练为结合使用弹力带及手持负重进行的渐进抗阻训练。每次肌力训练包括核心肌群的8~10组训练,重复10~15个循环。

表1 有氧运动训练方案
1.3 评定方法
运动功能指标包括VO2peak、睁眼单腿站立时间、座椅前伸试验距离。肌肉衰减指标包括ASMI、握力指数和6米步速。
1.3.1 6MWT
测试场地为采光和通风良好的走廊,取30 m长作为往返行走路段,并以每3 米做一个标记,测试期间保持通道无障碍。向受试者说明测试方法,受试者保持最快的速度,力所能及地完成6MWT,最后记下6 min 完成步行测试时的停止点,准确记录6 min 步行距离。
1.3.2 VO2peak
由6MWT测得距离(X),计算VO2peak。
VO2peak(ml/min)=0.05X-6.331[7]。
1.3.3 握力指数
受试者坐位,双足自然置于地面,屈髋屈膝90°,肩内收中立位,屈肘90°,前臂中立位,屈腕0~30°,并保持0~15°尺偏。用利手握3 次(两次间隔15 s),取平均值,计算握力指数。握力指数=握力(kg)/体质量(kg)×100。握力指数>50为正常。
1.3.4 6米步速
用胶带在地面标出6 m 的直线距离,测试区域前后保留0.5 m 的无障碍空间。受试者可借助拐杖等工具完成6 m 行走,要求受试者用平常步速行走。≥0.8 m/s为正常。
1.3.5 ASMI
使用双能X 线吸收测试仪测得四肢骨骼肌质量(appendicular skeletal muscle mass,ASM)。ASMI=ASM(kg)/身高2,ASMI 男性>7 kg/m2、女性>5.4 kg/m2为正常。
1.3.6 座椅前伸试验
选取椅面高度为43 cm 的椅子靠墙放置。嘱患者坐在椅子边沿,脱鞋,一侧腿膝关节伸直,足跟着地,踝关节尽量背屈,双手手背向上重叠放置,同侧手掌在上。治疗师将尺子放置于脚尖,并与小腿平行,告知患者将重叠的双手沿着尺子向下缓慢滑动,记录患者指尖能够达到的最远处,并且能最少保持2 s的读数,即所能够及的最远点与脚尖的距离。测试2次,取最小值。
1.3.7 睁眼单脚站立平衡测试
受试者站立,任意一只脚抬离地面且屈髋屈膝90°,双手自然下垂放在身体两侧。记录受试者单足站立的最长时间,当发生下面任意情况即停止计时:①双手离开身体两侧;②支撑脚移动,产生调整反应;③除支撑脚外身体任何部分接触地面。进行2 次预测试,再进行2次正式试验,取最大值。
1.3.8 实验室检查
通过血、尿实验室检查测得肾功能指标(肌酐、eGFR 和尿微量白蛋白)和生化指标(超敏C 反应蛋白、总胆固醇、高密度脂蛋白和低密度脂蛋白)。
1.4 统计学分析
采用SPSS 22.0 统计软件进行分析。计量资料首先采用Shapiro-Wilk 检验是否正态分布,若符合正态分布,采用(xˉ±s)表示;若不符合则采用M(QL,QH)表述。计数资料采用频数表示。比较6 周和12 周各参数的差异,若数据符合正态分布,采用重复测量方差分析;若不符合正态分布,采用Friedman 检验分析。比较首次运动后的干预效果,若数据符合正态分布,采用配对样本t检验分析;若不符合正态分布,采用Wilcoxon signed-rank test分析。显著性水平α=0.05。
2 结果
2.1 运动24 h后生化和肾功能指标比较
与运动前比较,首次运动24 h 后超敏C 反应蛋白、总胆固醇、高密度脂蛋白、低密度脂蛋白和肌酐、eGFR、尿微量白蛋白均无显著性差异(P>0.05)。见表2。
2.2 运动6 周和12 周后生化、肾功能指标及运动功能比较
与运动前比较,运动6 周和12 周后超敏C 反应蛋白、总胆固醇、高密度脂蛋白、低密度脂蛋白和肌酐、eGFR、尿微量白蛋白均无显著性差异(P>0.05)。见表3。
与运动前比较,运动6 周后座椅前伸试验距离改善(P<0.05);运动12 周后,ASMI、握力指数、6 米步速、VO2peak、睁眼单腿站立时间、座椅前伸试验距离均改善(P<0.05)。与运动6 周比较,运动12 周后,握力指数、6 米步速、VO2peak、睁眼单腿站立时间改善(P<0.05)。见表4。
3 讨论
长期以来临床医生倾向于限制肾脏疾病患者的运动,考虑急性运动会导致肾血流量和肾小球滤过率下降,使病情进一步恶化。对肾功能影响最大的是肾血流量,它与运动强度和心率呈负相关。肾脏在机体安静时接受心输出量的1/5 血液,平均组织单位质量的血液灌流量比其他脏器多,而运动时血液向肌肉、肺、心脏的分配增加,使得肾血流量下降,剧烈运动时下降达50%~75%[8]。临床有剧烈运动后造成急性肾功能衰竭的病例报道[9]。日本肾脏学会在《基于证据的CKD 诊疗指南2009》中表明,目前尚无为了不引起CKD 患者蛋白尿、肾功能恶化而限制运动的临床依据,且适度的运动不会使肾功能障碍加重,反而会有所改善[10]。本研究从低强度有氧运动开始,在低强度有氧运动联合抗阻运动干预24 h 后观察到各项生化指标和肾功能指标无明显变化,提示该运动量没有造成肾功能的急性损害。
不同于急性运动,近些年来许多基础研究的结果显示,长期的慢性运动对肾脏疾病有一定的保护作用。吴学敏等[11]报道不同强度和时间的有氧运动对于5/6 肾摘除高血压自然发病大鼠肾功能不全模型肾功能的影响,结果显示,4 周的中度强度有氧运动后,肾小球硬化程度显著降低,8 周运动后较4 周时尿蛋白量、血肌酐和肾小球硬化程度进一步降低,提示长期运动的肾保护作用。Yoshida等[12]报道,高血压自然发病糖尿病模型大鼠通过长期中度运动强度的跑台训练,肾小球硬化程度改善。本研究显示,老年CKD患者进行长期低中强度有氧运动并未加重肾功能损伤。
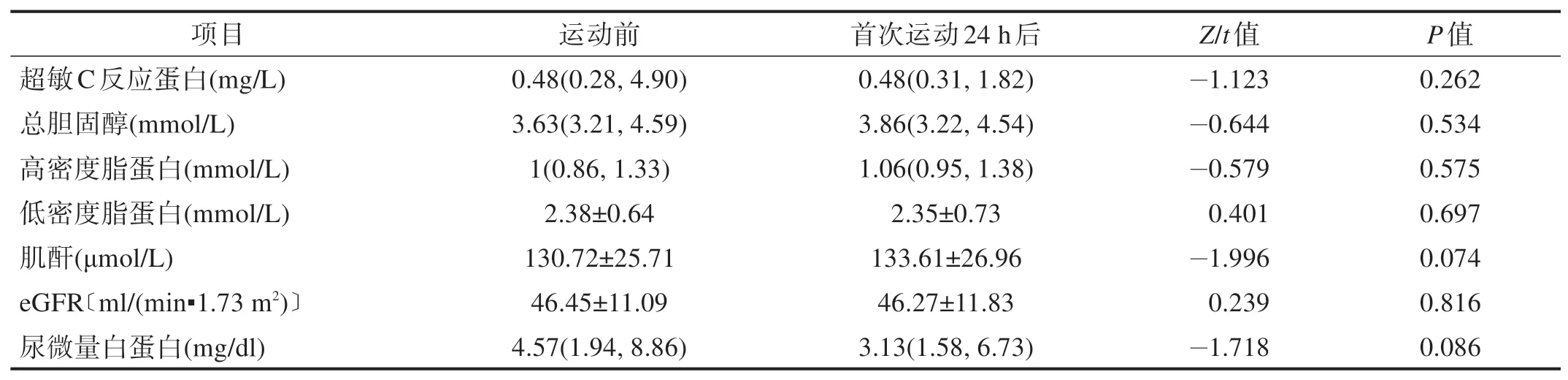
表2 首次运动前后各生化和肾功能指标比较
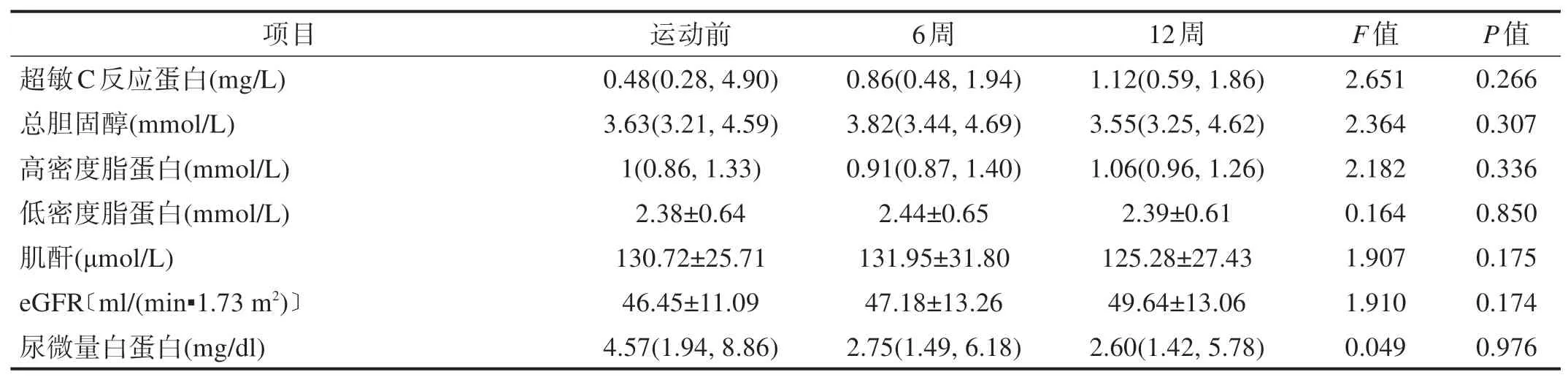
表3 运动6周和12周后各生化和肾功能指标变化
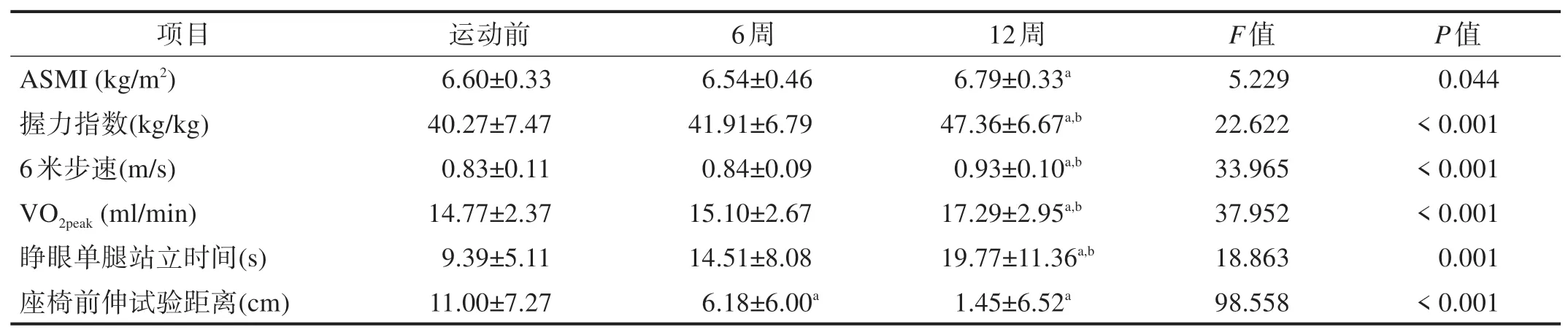
表4 运动6周和12周后肌肉衰减指标和运动功能变化
本研究还显示,低中强度的运动可提高老年CKD患者的运动功能。虽然近年来许多临床研究证明[13-17],运动训练能增加慢性肾脏疾病患者的VO2peak,增强体力,提高步行能力等运动功能及提高其营养状况和生活质量;但这些研究的人群都是成年CKD 患者,针对高龄老人的研究并不多见。本组患者平均年龄(80.27±4.98)岁,通过低中强度有氧运动联合抗阻运动亦观察到类似结果。有研究提示,运动能力低下者出现eGFR 快速下降的风险较运动能力高者增加28%[18],CKD 2~4 期的患者步速>1.3 m/s,肾功能快速进展的风险下降18%~26%[19]。因此提高老年CKD 患者的运动能力很有意义,在康复医生指导下的低中强度有氧运动联合抗阻运动能达到提高运动功能,提高VO2peak、平衡功能和柔韧性的目的,从而提高老年CKD患者的生活质量。
CKD是导致肌少症常见的慢性病之一。与同龄对照人群相比,CKD 患者的肌肉质量减少更为显著[20]。有研究显示[21],在CKD 早期肌少症患病率约5%~9%,CKD 3b~5 期患病率约为65%。肌少症与CKD 的患病率和死亡率相关,可导致CKD患者VO2peak的下降,活动能力下降,跌倒风险和骨折的风险增加,进而导致生活质量下降,依赖医疗服务及残疾等,最终导致死亡风险增加[22]。有研究显示[23-24],在门诊患者中实施设计良好的递增式抗阻运动训练计划,有明显改善CKD各期患者的肌力,轻度改善下肢肌肉横截面积的效果。
改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)指南提出需要将运动纳入CKD 非透析患者的综合管理中,CKD 患者需要每周至少进行4~5 次、每次30 min 低中强度的活动量。运动能力下降可导致CKD 患者的不良预后,尤其是并发肌少症的老年患者。欧洲最优肾脏临床实践组织(European Renal Best Practice,ERBP)临床实践指南提出运动对改善老年CKD 3b 期或以上患者的功能状态有积极作用,建议选择系统化和个性化的方式进行运动训练,老年患者可以通过有质量的运动,降低死亡风险,且没有致命性的运动相关不良事件的报道[25]。因此,应对老年CKD患者进行运动能力评估并给予积极的康复干预,改变CKD 患者不运动的生活方式,进行循序渐进的运动训练以改善CKD 患者的运动功能、肌肉质量和肌肉力量,提高生活质量和改善预后。本研究显示,CKD 3~5 期老年患者通过运动干预可以改善其肌肉质量和肌肉力量,减轻患病老人运动功能障碍,降低老人跌倒及骨折风险。
本研究仍存在一些不足之处,如样本量较少,缺乏长期跟踪随访,在今后的研究中仍需扩大样本量并且观察运动的远期效果,为肾脏康复的临床应用提供更有力的循证学依据。
