丰富环境对缺氧缺血性脑损伤新生大鼠海马神经元凋亡及脑源性神经营养因子/酪氨酸蛋白激酶受体信号通路的影响
2019-12-25赵彬唐强朱路文王艳梁碧莹
赵彬,唐强,朱路文,王艳,梁碧莹
1.黑龙江中医药大学附属第二医院,黑龙江哈尔滨市 150001;2.黑龙江中医药大学,黑龙江哈尔滨市 150040
围产期缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是新生儿死亡的主要原因,存活下来的新生儿也往往遗留运动障碍、认知障碍和癫痫等神经系统后遗症,给家庭和社会造成极大负担[1]。据国外统计[2],一半以上的患儿存在神经系统功能障碍。越早对HIBD 患儿进行治疗,其中枢神经系统功能障碍严重程度越低,患儿的运动和认知功能也会越早提高[3]。
早期干预中,丰富环境刺激最为常见和有效,包括视听觉刺激和婴儿抚触。美国Hebb[4]最早对丰富环境进行报道,此后在动物神经可塑性领域被大量研究和应用。在形态学(如脑皮质厚度的变化),神经网络的重建,神经元及其树突、轴突再生,新突触连接形成和重塑等方面,丰富环境对非新生动物起显著作用[5]。近几年研究发现[6-10],丰富环境对HIBD 的运动、记忆能力和空间认知等都有改善作用,同时海马CA1区微管相关蛋白(microtubule-associated protein-2,MAP-2)阳性细胞和成纤维细胞生长因子-2(fibroblast growth factor-2,FGF-2)表达增加,还增加海马区树突棘的密度,促进内源性血管生成。已有研究提出[11-12],损伤后发挥神经元的保护作用,防止神经元的变性和坏死与脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)/酪氨酸蛋白激酶受体(tyrosine kinase receptor B,TrkB)信号通路相关。HIBD 发生后细胞变性坏死主要是通过细胞凋亡的形式发生,因此对细胞凋亡的通路和机制进行研究,找到抗凋亡的新方法成为目前研究的关键问题。
本实验通过建立HIBD 大鼠模型,探讨丰富环境对海马神经元凋亡及BDNF/TrkB信号通路的影响,并探讨可能作用机制,为临床HIBD 治疗提供有力证据和方法。
1 材料与方法
1.1 实验动物及分组
48 只7 日龄新生Wistar 大鼠幼仔,体质量(12.5±0.7)g,雌雄比例1∶1,按照科技部《实验动物管理条例》进行饲养。将大鼠按照随机数字表法分为模型组、假手术组和丰富环境组,每组再分为14 d、28 d两个亚组,每个亚组8只。
1.2 主要试剂及仪器
1.2.1 试剂
水合氯醛:天津光复科技发展有限公司。4%多聚甲醛:武汉博士德公司。浓缩型BDA 试剂盒:北京中杉金桥生物技术有限公司。蛋白酶k:上海如吉生物技术有限公司。BDNF 一抗:沈阳万类生物科技有限公司。TrkB一抗:武汉博士德公司。一抗二抗去除液:上海碧云天生物技术有限公司。PVDF 膜:美国MILLIPORE 公司。脱脂奶粉:伊利。兔抗大鼠多克隆抗体:北京博奥森公司。
1.2.2 仪器
RM2265 型全自动轮转式切片机:德国LEICA 公司。Eppendorf Researchplus 移液器:德国EPPENDORF 公司。H-2050R 型超高速冷冻离心机:湖南湘仪实验室仪器开发有限公司。CX31 型生物显微镜:日本OLYMPUS 公司。W1OLVF 超纯水系统:香港HEALFORCE 公司。DHG-9030A 型电热恒温鼓风干燥箱:上海一恒仪器有限公司。8%O2+92%N2混合气体:哈尔滨黎明气体集团。
1.3 模型制作
新生大鼠HIBD 模型制备采用Rice-vannucci 经典方法,新生Wistar 大鼠10%水合氯醛0.3 g/kg 麻醉,常规消毒后颈正中切口,将左侧颈总动脉分离,永久性结扎,对合皮肤后缝合。术后2 h 置于含8%O2+92%N2有机玻璃缺氧箱中缺氧2 h,同时记录新生鼠一般行为。大鼠出现夹尾尖叫或者自发向左转圈,说明模型制备成功,将其重新放回笼中继续由母鼠进行母乳喂养。
假手术组仅分离左侧颈总动脉,不进行结扎和缺氧,随后放入原笼中母乳喂养。
1.4 建立丰富环境刺激模型
制作70×60×50 cm 的透明玻璃环境[13]。此环境中摆放不同颜色、气味和形状的物品,包括各种质感的纱布、刷子,低温物品和有刺激性气味的菠萝干、榴莲球等,还有积木、塑料通道、楼梯、绳子、跷跷板、松土盒、玻璃球等“玩具”,同时用红色灯光刺激活动区,在玻璃笼中用音乐盒播放音乐进行声音刺激,考虑到大鼠的昼息夜出习惯、生存温度、摄食等因素,3 d后对环境进行重新布置。
1.5 干预方法
假手术组和模型组术后24 h 置于无任何刺激笼中饲养,保持笼中清洁,大鼠正常摄食、饮水等,予以同等条件抓取。
术后24 h,丰富环境组每天与母鼠分离4 次,每次30 min,放入丰富环境笼,进行早期抚触和视听觉刺激,气味和不同温度刺激。
1.6 检测
各组于造模后14 d、28 d,10%水合氯醛0.3 g/kg麻醉后,常规消毒腹腔开口,破坏膈肌造成气胸,暴露心脏,右心耳开口,将0.9%氯化钠注射液100 ml及4%多聚甲醛溶液灌入,观察肺部和肝脏呈现白色,期间大鼠可出现四肢抽搐最后僵直状态。迅速切头后取脑,分离海马,将分离的海马浸泡在4%多聚甲醛溶液中固定,48 h 后乙醇脱水,常规石蜡包埋,冠状切片,厚3~5 μm。
1.6.1 TUNEL法
每只大鼠随机选取5 张切片,烤片、脱蜡、乙醇水合后,蛋白酶k 常温下消化30 min,PBS 漂洗液3次,加入TUNEL 反应液,37 ℃暗温盒中放置60 min。荧光显微镜下观察凋亡细胞。苏木素复染、返蓝、乙醇脱水、二甲苯透明封片、镜检、拍照。每张切片选取5 个不重复视野,显微镜下计数TUNEL 阳性神经元,取均数。
1.6.2 双重免疫荧光染色法
每只大鼠随机选取5 张切片,脱蜡、水化、抗原修复后,常温下PBS 和FBS 封存后,滴加兔抗大鼠切割半胱天冬酶-3(cleaved caspase-3)多克隆抗体(美国SANTA BIOTECHNOLOGY 公司)和大鼠抗神经元特异性核蛋白抗体(1∶1000,美国CHEMICON公司),保湿盒中4 ℃孵育12 h,PBS 洗涤3 次,滴加二抗(上海碧云天公司)室温下孵育1 h,PBS 洗涤3 次,干燥过夜封片。每张切片取5 个不重复视野,正置荧光显微镜观察,拍照,Image-Pro Plus 6.0软件分析。
1.6.3 免疫组化法
每只大鼠取5 张切片,60 ℃烤干、脱蜡入水,内源性过氧化物酶活性3% H2O2溶液灭活,滴加一抗(BDNF 或TrkB),4 ℃过夜(阴性对照用PBS 代替),隔日以室温恢复,滴加生物素化二抗工作液,37 ℃孵育10~15 min,滴加辣根酶标记链霉卵白素工作液,37 ℃孵育10~15 min;DAB 显色,苏木素复染,分化、返蓝、脱水、干燥,封片并拍照记录。CX31 型显微镜下观察,阳性以棕黄色或棕褐色呈现,阴性细胞以蓝色呈现。每张切片取5 个不重复视野,记录视野内BDNF、TrkB阳性细胞数,取平均值。
1.7 统计学分析
采用SPSS 19.0 软件包进行统计学分析。计量资料以(xˉ±s)表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。显著性水平α=0.05。
2 结果
2.1 海马神经元凋亡
2.1.1 TUNEL法
造模后14 d、28 d,与假手术组比较,模型组海马区TUNEL 阳性细胞数显著增加(P<0.001);与模型组比较,丰富环境组海马区TUNEL 阳性细胞数显著减少(P<0.001)。见图1、表1。
2.1.2 双重免疫荧光染色
造模后14 d、28 d,与假手术组比较,模型组双标记阳性细胞数显著增加(P<0.001);与模型组比较,丰富环境组双标记阳性细胞数显著减少(P<0.001)。见图2、表2。
2.2 海马BDNF表达
造模后14 d、28 d 后,假手术组海马BDNF 阳性细胞表达不明显;与假手术组比较,模型组海马BDNF 阳性细胞表达显著增高(P<0.001);与模型组比较,造模后28 d,丰富环境组海马BDNF 阳性细胞表达显著增加(P<0.001)。见图3、表3。
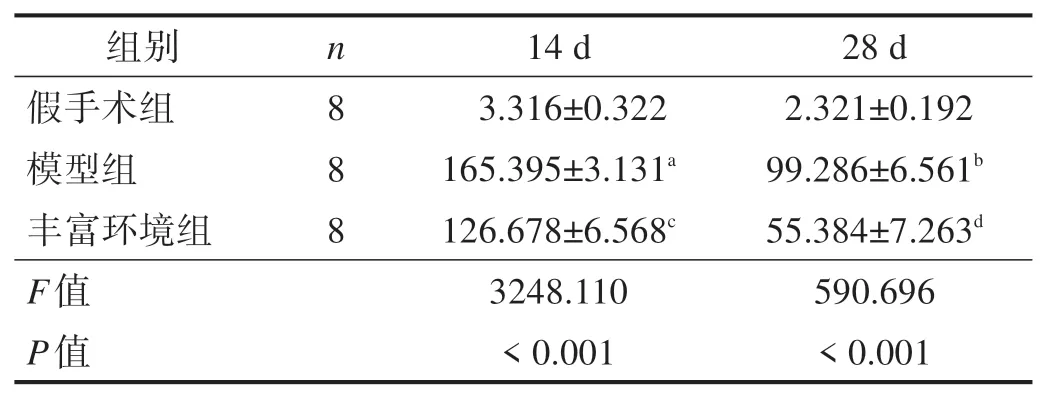
表1 各组造模后14 d、28 d后海马区TUNEL阳性细胞数(n/视野)
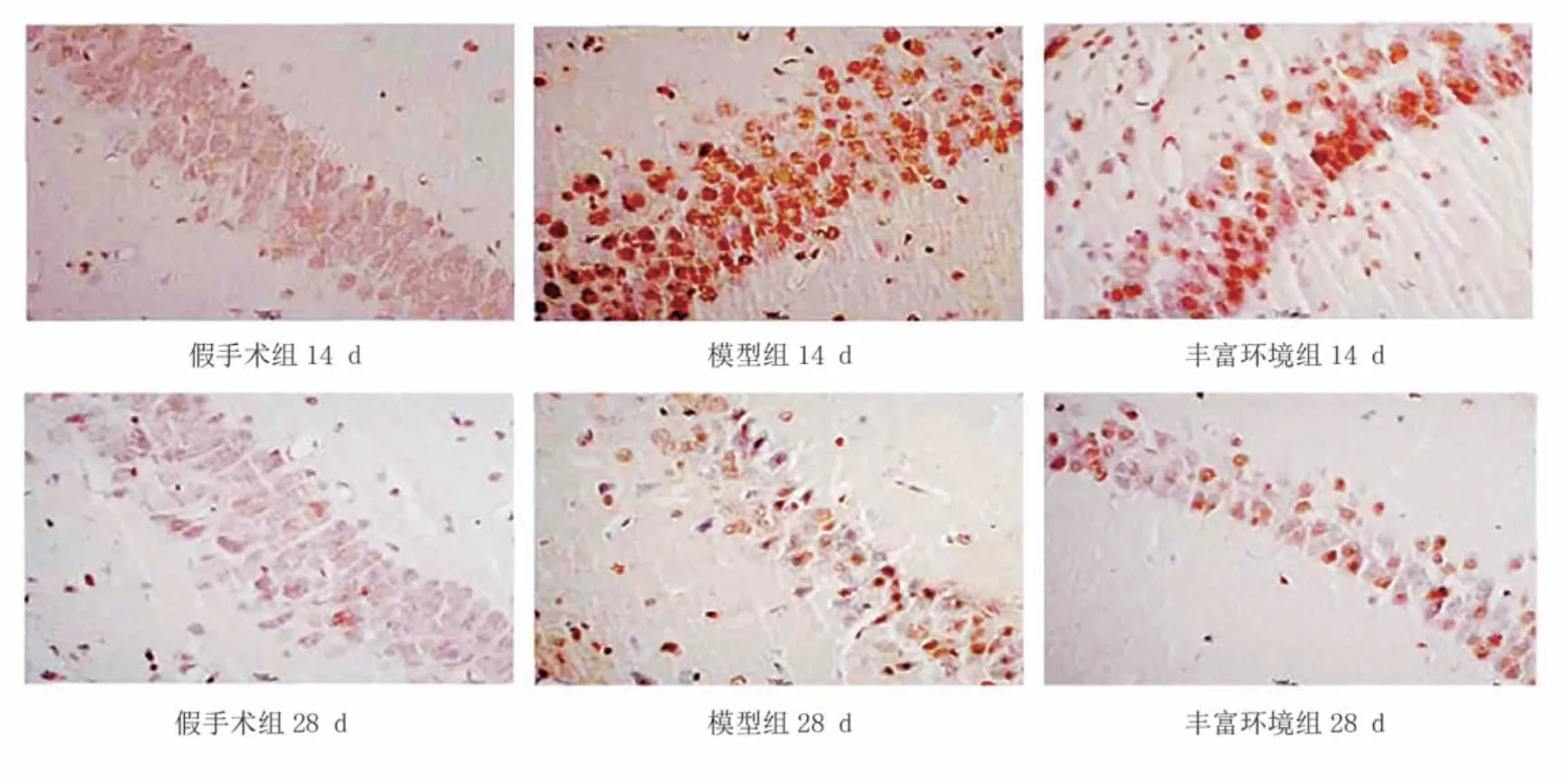
图1 各组造模后海马区细胞凋亡情况(TUNEL染色,×400)
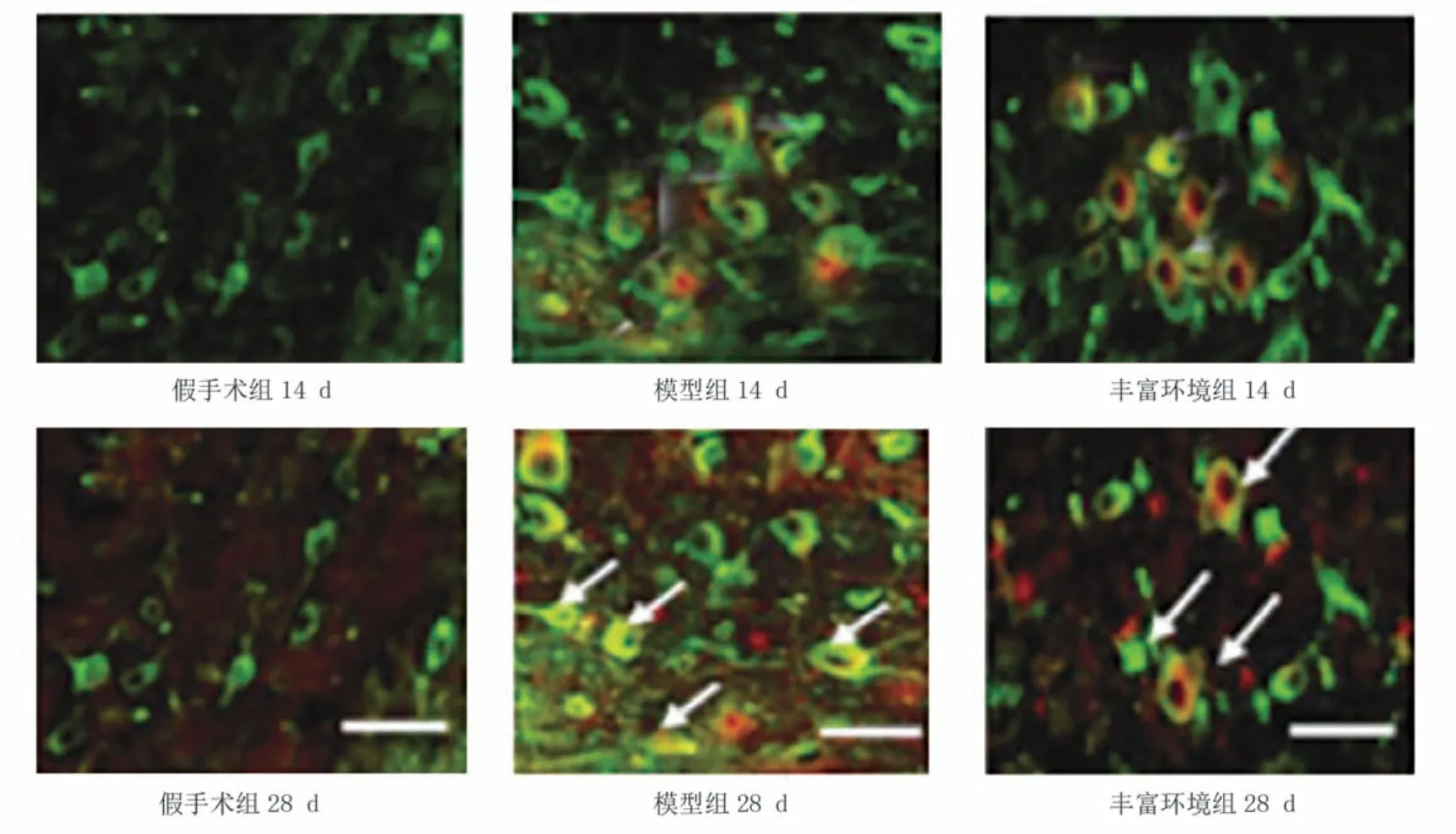
图2 各组造模后神经元表达(双重免疫荧光染色,×800,bar=100 μm)
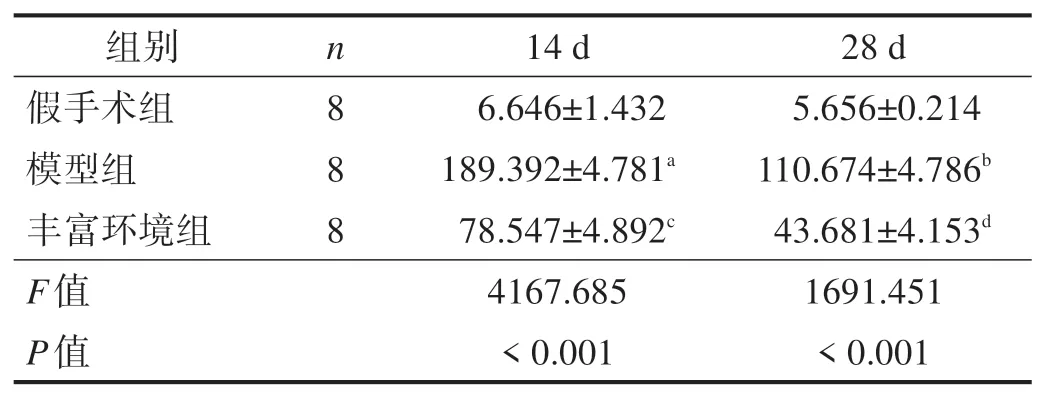
表2 各组造模14 d、28 d后海马区双重免疫荧光染色阳性细胞数(n/视野)
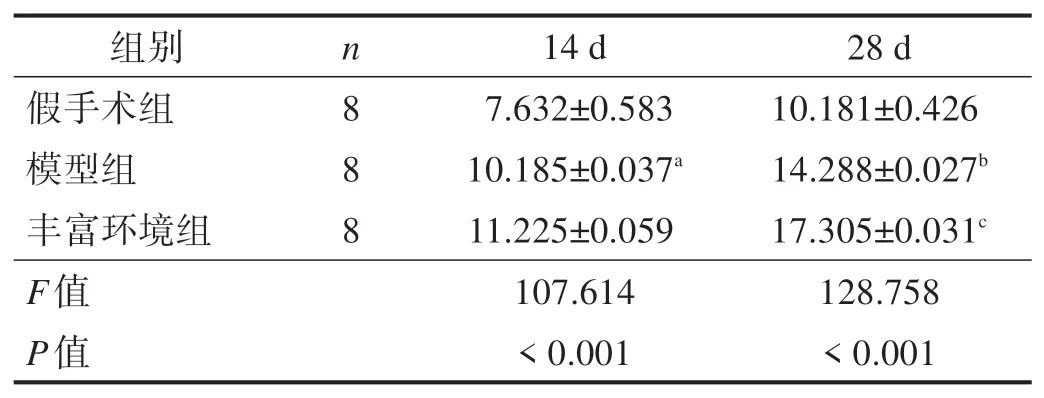
表3 各组造模14 d和28 d后海马BDNF阳性细胞计数(n/视野)
2.3 海马TrkB表达
造模后14 d、28 d,假手术组海马TrkB 阳性细胞表达不明显;与假手术组比较,模型组海马TrkB 阳性细胞表达显著增高(P<0.001);与模型组比较,造模后28 d,丰富环境组海马TrkB 阳性细胞显著增加(P<0.001)。见图4、表4。
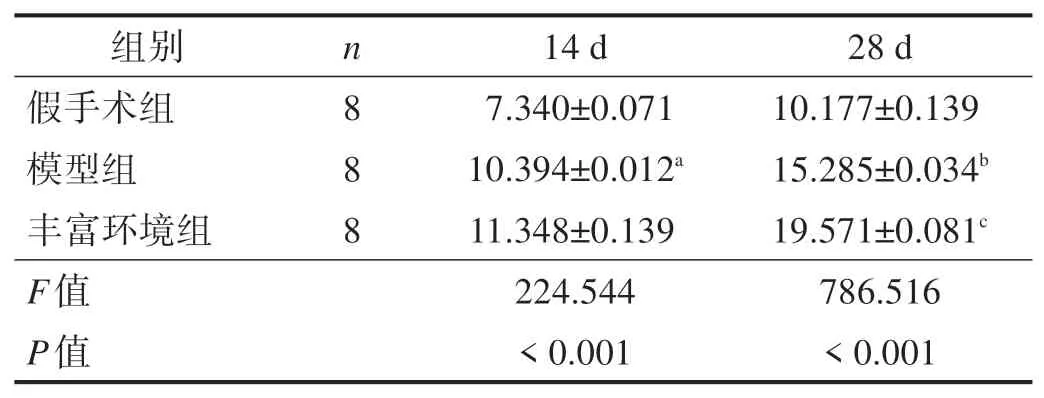
表4 各组造模14 d和28 d后海马TrkB阳性细胞计数(n/视野)
3 讨论
新生儿HIBD 主要由围产期宫内病理因素和窒息引起,可以造成新生儿死亡和神经系统后遗症[13]。丰富环境刺激通过颜色视觉刺激,接触物触觉刺激,滚筒、台阶、秋千等的平衡刺激,促进神经元发育,提高认知功能[14]。丰富环境干预不仅可以使神经突触可塑性增强,还可以调控营养因子和再生因子浓度[15-16],其中BDNF激活释放以及与特异性受体TrkB结合使神经再生,细胞间突触重建或重组,减轻脑损伤[17]。当TrkB 与BDNF特异性结合后,激活产生复合物,产生某些小G 蛋白,包括Ras 蛋白和Rap-1 等[18]。李亚琴等[19]研究发现,静脉注射BDNF 后HIBD 小鼠脑内TrkB mRNA 和蛋白表达明显增强,对脑内神经细胞的保护和修复作用明显强化。相关报道表明[20-21],BDNF 在各种原因导致的缺氧缺血后可以避免神经元凋亡,预实验显示当给予TrkB 受体的选择性激动剂29d7 处理后神经元的存活能力显著增加。当BDNF 与全长型的TrkB 受体结合,BDNF/TrkB 信号通路才能被激活,BDNF/TrkB 信号通路激活后可以改善神经功能,减少梗死体积以及修复受损神经元[22]。本研究发现,造模28 d后,丰富环境组海马BDNF和TrkB表达高于模型组。
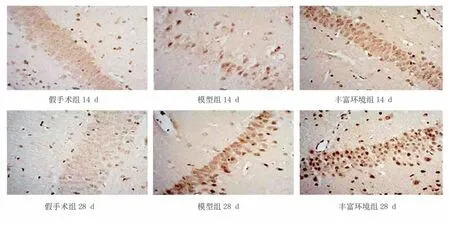
图3 各组大鼠海马区BDNF细胞表达(免疫组化染色,×400)
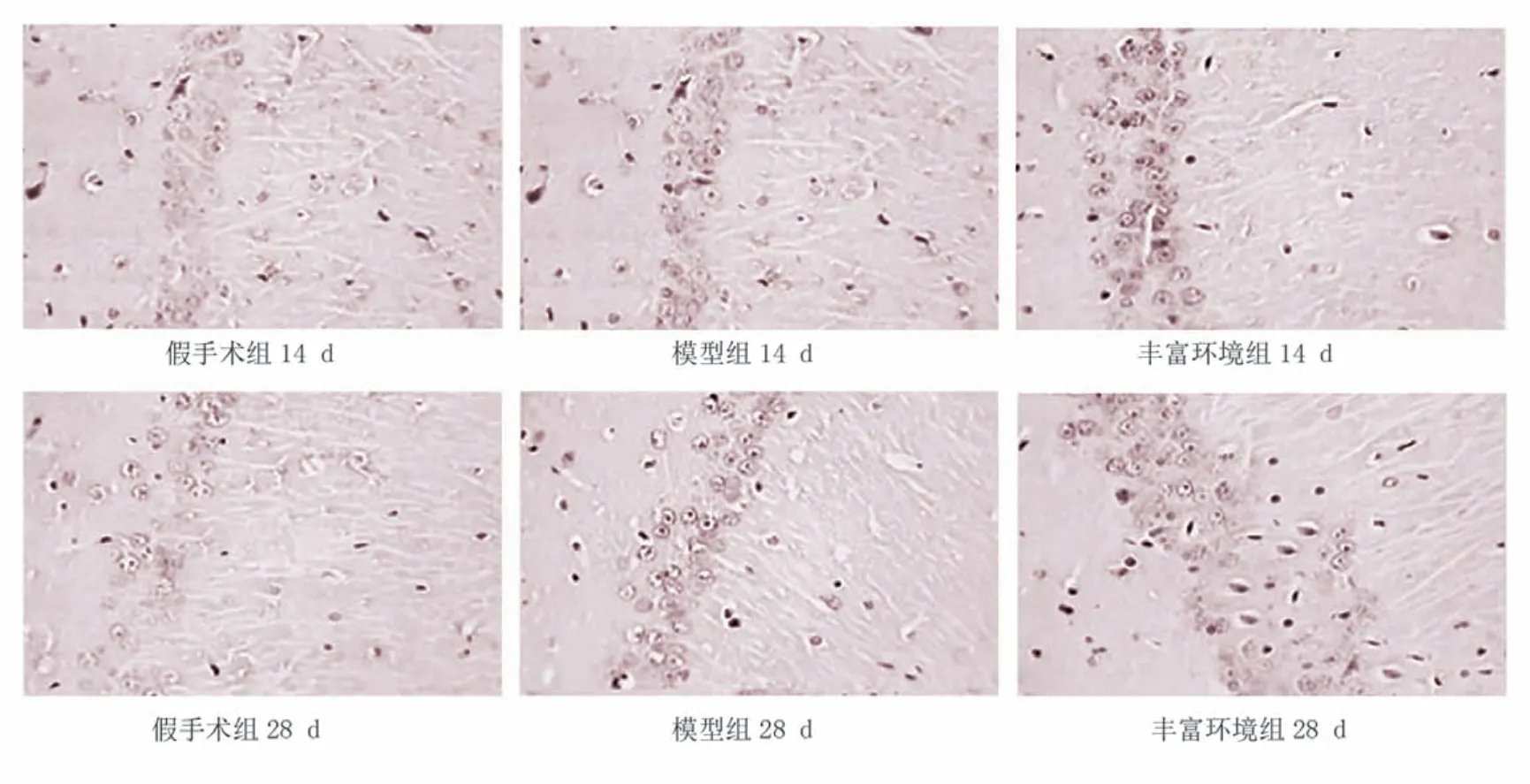
图4 各组大鼠海马区Trkb细胞表达(免疫组化染色,×400)
细胞凋亡是由基因调控的一系列介导、调控并且有程序性和主动性细胞死亡过程。凋亡和调控的对抗决定细胞最终的结果。在有限的“时间窗”内有效调控细胞的凋亡信号能大大保留神经功能。徐晓虹等[23]研究发现,丰富环境干预可抑制脑缺血后神经细胞凋亡,抵抗缺血再灌注损伤,认为丰富环境是抗细胞凋亡、改善脑功能的一条有效途径。本实验应用TUNEL 法和双重荧光染色对神经元内细胞凋亡标记物cleaved caspase-3 和成熟神经元标记物NeuN 进行标记,结果显示,各时间点丰富环境组双标记阳性细胞数少于模型组。说明细胞凋亡主要发生在神经元内,丰富环境是通过调控海马区神经细胞凋亡来抑制脑组织损伤。
综上所述,丰富环境在新生儿HIBD 后上调BDNF、TrkB 蛋白的表达,抑制海马区细胞凋亡,发挥保护、修复脑内神经细胞,抑制细胞凋亡,改善脑功能的作用。但新生儿HIBD 是个复杂的过程,其下游通路和信号及蛋白表达还需进一步探究。
