siRNA下调星形胶质细胞中PTEN表达对缺氧复氧诱导细胞凋亡影响
2019-12-25孙屹屹杨丽华李瑞俭王景涛
孙屹屹 杨丽华 李瑞俭 王景涛
1)鹤壁市人民医院ICU,河南 鹤壁 458030 2)郑州大学第一附属医院神经内科,河南 郑州 450000
星形胶质细胞是中枢神经系统中体积最大的胶质细胞,在哺乳动物体内的分布极为广泛,传统的观点认为其具有支持神经元、形成血脑屏障、物质运输等作用,近年来的研究显示,星形胶质细胞还具有维持内环境稳定、参与突触形成、神经分化等功能[1-4]。缺氧复氧条件下,星形胶质细胞凋亡增多,进而引起神经功能损伤[5-6]。第10号染色体同源缺失性磷酸酶-张力蛋白(phosphatase and tensin homolog deleted on chromosome 10,PTEN)是一个具有双磷酸酶活性的抑癌基因,其不仅参与细胞生长、周期进展等过程,还具有诱导细胞凋亡的作用[7]。研究显示,PTEN参与缺氧复氧神经损伤发生,在神经元修复、过氧化氢诱导的脊髓星形胶质细胞损伤中有重要作用[8-11]。本研究探讨小干扰RNA下调PTEN表达对缺氧复氧星形胶质细胞凋亡的影响,为进一步研究缺氧复氧神经损伤机制提供参考。
1 材料与方法
1.1材料清洁级出生2 d以内的SD乳鼠,由郑州大学实验动物中心提供;PTEN抗体购自美国Santa Cruz Biotechnology;细胞周期依赖性蛋白激酶4(cyclin-dependent kinase 4,Cdk4)抗体、p21抗体和细胞色素C(Cytochrome C)抗体购自美国Abgent;SYBR Green Real time PCR试剂盒购自上海索莱宝生物科技有限公司;引物由金斯瑞生物科技有限公司合成;RNA提取试剂盒购自北京TIANGEN;胞质蛋白提取试剂盒购自江苏凯基生物技术股份有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)含量测定试剂盒购自武汉默沙克生物科技有限公司。
1.2星形胶质细胞分离培养参照文献[12],无菌将出生2d以内的SD乳鼠处死以后,用75%的酒精消毒,将头部的皮肤和颅骨剪开以后,取出大脑组织,放在D-Hanks液中,在显微镜下把大血管、海马、脑膜等去除以后,取大脑皮质,将皮质组织剪碎成1 mm3的碎块,置于15 mL的离心管中,800 g离心2 min,取沉淀,加入等体积的0.25%的胰酶,消化5 min,加入含有血清的培养液,200目滤网过滤以后,1 200 g离心10 min,添加新鲜的含有10%胎牛血清的培养液。细胞接种到0.01%多聚赖氨酸包被后的细胞培养瓶内,接种密度为5×105个/mL,培养2 d以后换液,细胞长满瓶底以后,以220 rpm,37 ℃振荡培养18 h,将小胶质细胞等杂细胞去除,更换细胞培养液继续培养,经FITC标记的GFAP、DAPI染色鉴定为星形胶质细胞,纯度超过97%。
1.3缺氧复氧模型构建取星形胶质细胞,进行缺氧复氧模型构建,参照文献[13],步骤为:星形胶质细胞用PBS洗涤2次以后,更换成缺氧液,在94.8%N2、5% CO2、0.2% O2、37 ℃的培养箱中培养6 h,再更换成10%胎牛血清的DMEM置于37 ℃,5% CO2培养箱中培养12 h。缺氧液配制方法为:取6.80 g Nacl、0.36 g Na2HPO4、12H2O、0.4g Kcl、0.20g MgSO4、7H2O、0.39g CaCl2、6H2O、5.69g HEPES、2.20 g NaHCO3溶解至800 mL去离子水中,pH为7.4,定容1 000 mL,用0.22 μm微孔过滤,保存在4 ℃。
1.4PTENsiRNA慢病毒感染及细胞分组取星形胶质细胞接种到12孔细胞培养板中,细胞密度为40%左右时,进行慢病毒感染,在细胞中添加适量的慢病毒颗粒,调整慢病毒感染复数为20,同时在细胞中加入10 mg/L的Polybrene继续孵育24 h后,更换新鲜的细胞培养液,72 h后观察GFP表达情况,感染效率高于85%。将感染携带PTEN siRNA的慢病毒载体的细胞经缺氧复氧处理后记为si-PTEN+H/R,将感染阴性对照慢病毒载体的细胞经缺氧复氧处理后记为si-NC+H/R。把没有感染慢病毒的细胞经缺氧复氧处理后记为H/R,把正常培养的细胞记为Control。用Real time PCR和Western blot检测H/R、si-PTEN+H/R、si-NC+H/R细胞中PTEN的表达水平,确定PTEN siRNA 沉默效果。
1.5RealtimePCR测定PTENmRNA表达H/R、si-PTEN+H/R、si-NC+H/R细胞依照RNA提取试剂盒提取RNA,RNA溶解在适量的DEPC水中,保存至-80℃。逆转录体系为:总RNA 2 μg、 dNTP 1 μL、随机引物2 μL加水共12 μL,置于65 ℃反应5 min,在冰上冷却,继续添加Reaction Buffer 4 μL、1 μL DTT,放在37 ℃反应2 min后,添加1 μL的M-MLV逆转录酶,混合均匀以后,25℃反应10min,37℃反应 50min,70℃反应 15min,合成的cDNA保存在-20℃。Real time PCR步骤同Real time PCR试剂盒,每个反应设置3个复孔,共40次循环,内参为β-actin,检测反应的CT值,按照2-△△Ct方法计算待测PTEN水平。引物序列如下:PTEN F-5’-CATTATGACACCGCCAAA-3’,R-5’-AACCGGGCTACATTATTT-3’。β-actin F-5’-GTGGGGCGCCCCAGGCACCA-3’,R-5’-CTCCTTAATGTCAGCACGATTTC-3’。
1.6Westernblot测定PTEN蛋白表达H/R、si-PTEN+H/R、si-NC+H/R细胞中加入细胞裂解液(约106个细胞中加入100 μL),超声仪破碎细胞后,4℃高速离心,用BCA法对蛋白上清定量以后,进行SDS-PAGE蛋白电泳。常规方法配制5%的浓缩胶和10%的分离胶,每孔上样30μg,浓缩胶中90V电压电泳,分离胶中120V电压电泳,电泳时间为3h。用半干法将凝胶上的蛋白在4℃转移到PVDF膜上,转膜持续50min,电流用80mA。取出PVDF膜,进行免疫荧光染色,PTEN抗体稀释倍数为1:100,β-actin内参抗体稀释倍数为1:600,二抗稀释倍数为1:3000。最后用Odyssy扫描图像,用Image J软件定量,结果按照PTEN和内参光密度值比值表示。
1.7MTT测定细胞增殖活力无菌取星形胶质细胞,种植到96孔板,细胞接种密度为3×105个/mL,每孔100 μL。按照Control、H/R、si-PTEN+H/R、si-NC+H/R处理后,在每孔中添加MTT染液,孵育4h后,每个孔中加入150 μL的DMSO,低速振荡10min后,结晶物完全溶解,测定570nm的OD值,用空白调零孔调零以后,计算细胞存活率。存活率=(H/R或si-PTEN+H/R或si-NC+H/R细胞OD÷Control细胞OD)×100%
1.8二硝基苯肼比色法检测LDH漏出率Control、H/R、si-PTEN+H/R、si-NC+H/R按照上述方法处理以后,用PBS将细胞洗涤3次,添加1%的Triton X-100在室温中将细胞裂解后,用LDH检测试剂盒检测裂解液和培养液中LDH含量(二硝基苯肼比色法)。LDH漏出率=100%×培养液中LDH水平÷(培养液中LDH水平+细胞裂解液中LDH水平)
1.9流式细胞术测定周期H/R、si-PTEN+H/R、si-NC+H/R细胞用0.25%的胰酶消化以后,加入冰预冷的70%的乙醇溶液,在-20℃过夜。1 000 g离心10 min后,把乙醇吸除,添加PI染液,终浓度为50 μg/mL,4℃避光反应30 min,流式细胞仪检测周期分布水平。
1.10流式细胞术测定凋亡Control、H/R、si-PTEN+H/R、si-NC+H/R按照上述方法处理以后,用0.25%的胰酶消化,用PBS将细胞悬浮,细胞浓度调整到106个/mL,1 000 g离心5 min以后,加入冰预冷的PBS将细胞悬浮3次,用200 μL的结合缓冲液重悬细胞,添加10 μL的Annexin V-FITC孵育15min后,加入5 μL的PI和300 μL的Binding Buffer,200目筛网过滤以后,用流式细胞仪检测凋亡。
1.11Westernblot测定细胞中Cdk4、p21和CytochromeC蛋白水平收集H/R、si-PTEN+H/R、si-NC+H/R细胞,用Western blot方法测定细胞中周期蛋白Cdk4、p21表达水平和细胞胞质中Cytochrome C蛋白水平,步骤同1.6,胞质蛋白提取同胞质蛋白提取试剂盒。
1.12JC-1法测定线粒体膜电位收集H/R、si-PTEN+H/R、si-NC+H/R细胞,把上清液吸除以后,在细胞中分别加入0.5 mL的JC-1工作液,放在培养箱中反应20min。将上清液吸除以后,再加入JC-1染液缓冲液,混合后,激光共聚焦显微镜下观察荧光强度。用红色荧光/绿色荧光的比值表示线粒体膜电位。

2 结果
2.1携带PTENsiRNA的慢病毒载体感染后缺氧复氧星形胶质细胞PTEN沉默效果si-PTEN+H/R细胞中的PTEN mRNA和蛋白水平均显著低于H/R和si-NC+H/R(P<0.05)。携带PTEN siRNA的慢病毒载体能够成功下调缺氧复氧星形胶质细胞中PTEN的表达。见图1、表1。
2.2敲低PTEN表达对缺氧复氧星形胶质细胞存活率和LDH漏出率影响与Control比较,H/R细胞存活率降低,LDH漏出率升高,差异有统计学意义(P<0.05)。si-PTEN+H/R细胞存活率升高,LDH漏出率降低,与H/R和si-NC+H/R比较,差异有统计学意义(P<0.05)。敲低PTEN能够提高缺氧复氧星形胶质细胞活力,减少细胞损伤。见表2。
2.3敲低PTEN表达对缺氧复氧星形胶质细胞周期分布及Cdk4、p21蛋白水平影响与Control比较,H/R细胞G1期比例升高,p21蛋白水平升高,Cdk4蛋白水平降低,差异有统计学意义(P<0.05)。si-PTEN+H/R细胞G1期比例降低,p21蛋白水平降低,Cdk4蛋白水平升高,与H/R和si-NC+H/R比较,差异有统计学意义(P<0.05)。敲低PTEN能够减弱缺氧复氧星对形胶质细胞周期阻滞作用。见图2、表3。
2.4敲低PTEN表达对缺氧复氧星形胶质细胞凋亡影响与Control比较,H/R细胞凋亡率升高(P<0.05)。si-PTEN+H/R细胞凋亡率低于H/R和si-NC+H/R(P<0.05)。敲低PTEN能够减少缺氧复氧星形胶质细胞凋亡。见图3、表4。
2.5敲低PTEN表达对缺氧复氧星形胶质细胞线粒体膜电位和胞质中CytochromeC水平影响与Control比较,H/R细胞线粒体膜电位降低,胞质中Cytochrome C蛋白水平升高(P<0.05)。与H/R和si-NC+H/R比较,si-PTEN+H/R细胞线粒体膜电位升高,胞质中Cytochrome C蛋白水平降低(P<0.05)。敲低PTEN能够减少缺氧复氧星对形胶质细胞线粒体膜电位及胞质中Cytochrome C蛋白水平影响。见图4、表5。

图1 Western blot检测携带PTEN siRNA的慢病毒载体对缺氧复氧条件下星形胶质细胞中PTEN蛋白水平影响Figure 1 Western blot analysis the effect of lentiviral vector carrying PTEN siRNA on PTEN protein levels in astrocytes under hypoxia-reoxygenation conditions

表1 携带PTEN siRNA的慢病毒载体感染对缺氧复氧条件下星形胶质细胞中PTEN表达水平比较
注:与si-NC+H/R和H/R比较,*P<0.05
注:与Control比较,&P<0.05;与si-NC+H/R和H/R比较,*P<0.05

图2 Western blot检测敲低PTEN对缺氧复氧条件下星形胶质细胞中周期相关蛋白Cdk4、p21表达影响Figure 2 Western blot analysis the effect of knockdown of PTEN on the expression of Cdk4 and p21 in astrocytes under hypoxia-reoxygenation

图3 流式细胞术测定敲低PTEN对缺氧复氧条件下星形胶质细胞凋亡影响Figure 3 Flow cytometry analysis the effect of knockdown of PTEN on astrocyte apoptosis under hypoxia-reoxygenation

表3 敲低PTEN对缺氧复氧条件下星形胶质细胞周期分布及Cdk4、p21蛋白水平影响

组别G1(%)S(%)G2/M(%)p21Cdk4Control60.14±5.1727.45±2.2412.41±1.050.26±0.020.68±0.06H/R78.26±4.23&14.85±1.18&6.89±0.78&0.85±0.09&0.41±0.03&siNC+H/R79.14±5.3215.69±1.545.17±1.110.87±0.070.40±0.05siPTEN+H/R68.76±2.56*22.86±2.64*8.39±1.47*0.36±0.05*0.51±0.02*F值12.10927.57922.45877.40927.351P值0.0020.0000.0000.0000.000
注:与Control比较,&P<0.05;与si-NC+H/R和H/R比较,*P<0.05

表4 敲低PTEN对缺氧复氧条件下星形胶质细胞凋亡率影响
注:与Control比较,&P<0.05;与si-NC+H/R和H/R比较,*P<0.05

表5 敲低PTEN对缺氧复氧条件下星形胶质细胞线粒体膜电位及线粒体中Cytochrome C蛋白水平影响
注:与Control比较,&P<0.05;与si-NC+H/R和H/R比较,*P<0.05
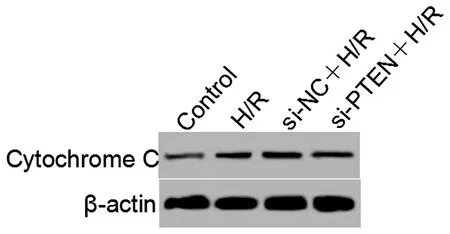
图4 Western blot检测敲低PTEN对缺氧复氧条件下星形胶质细胞胞质中Cytochrome C蛋白水平影响Figure 4 Western blot analysis the effect of knockdown of PTEN on the cytoplasmic Cytochrome C protein in astrocytes under hypoxia-reoxygenation
3 讨论
脑卒中的发病机制与兴奋性氨基酸毒性、炎症损伤、酸中毒、细胞凋亡等有关,卒中发生以后,缺血半暗带神经细胞凋亡是细胞急剧减少的主要原因,减少细胞凋亡可以减轻脑组织损伤[14-18]。星形胶质细胞是一种中枢神经系统细胞,在脑缺血发生后会过度凋亡,导致组织神经功能受损[19-21]。本实验的结果表明,缺氧复氧处理后的星形胶质细胞活力降低,细胞中LDH漏出率升高,细胞凋亡率升高,细胞G1期比例增多,说明成功构建了缺氧复氧星形胶质细胞损伤模型。
PTEN的蛋白质晶体分析结果显示,其氨基端含有一个磷酸酶区域,其与蛋白质丝氨酸/苏氨酸磷酸酶及酪氨酸磷酸酶催化中心同源性极高,具有双特异性磷酸酶活性,在PTEN的N端含有一个175个氨基酸组成的序列,该序列同辅助蛋白及张力蛋白具有较高的同源性,PTEN蛋白还含有一个C2结构域,能够与磷脂膜结合,参与细胞运动、调控蛋白质磷酸化等过程[22-25]。PTEN具有调控细胞生长、周期及凋亡等作用,在心肌组织、脑组织、肾组织等各种组织中均有表达[26-29]。最近的研究表明,PTEN具有调控神经系统细胞生长作用,参与神经元损伤修复,对于星形胶质细胞损伤也具有重要作用[30]。有研究显示,PTEN表达下调可以减轻过氧化氢诱导的星形胶质细胞损伤,PTEN表达下调可以减轻神经损伤[31]。本实验的结果显示,下调PTEN表达可以提高缺氧复氧星形胶质细胞活力,减少细胞LDH漏出率,降低细胞凋亡率,减少细胞G1期比例,下调PTEN具有减轻缺氧复氧星形胶质细胞损伤的作用。
细胞周期、细胞凋亡与细胞生长密切相关,其受到细胞内多种基因的严格调控,是一个十分复杂的过程。细胞周期进展中G1期向S期转变是细胞周期的检查点,受到Cdk4、p21等的调控作用,Cdk4具有促进细胞从G1期向S期进展的作用,p21具有抑制细胞从G1期向S期进展作用[32-36]。线粒体凋亡途径是细胞凋亡发生的经典途径,其中线粒体中的Cytochrome C释放至胞质中是关键,当细胞受到凋亡等信号刺激以后,细胞线粒体膜电位下降,导致细胞内的Cytochrome C进入胞质中与细胞凋亡相关因子结合,促进细胞凋亡发生。PTEN参与调控细胞周期和细胞凋亡发生[37-40]。本实验的结果显示,敲低PTEN后的星形胶质细胞中Cdk4蛋白水平升高,p21蛋白水平降低,胞质中Cytochrome C蛋白水平降低,线粒体膜电位升高,提示敲低PTEN可能通过调控周期蛋白及线粒体途径降低缺氧复氧对星形胶质细胞周期阻滞和凋亡诱导作用。
PTEN参与缺氧复氧星形胶质细胞凋亡发生,敲低其表达可以减少缺氧复氧星形胶质细胞凋亡,减少缺氧复氧诱导的星形胶质细胞周期阻滞,敲低PTEN表达具有保护缺氧复氧星形胶质细胞作用,这对于以后研究缺氧复氧神经损伤具有重要意义。
