被中饱私囊的脂肪
——非酒精性脂肪性肝病
2019-12-21陈轶妍陆炎
陈轶妍,陆炎
复旦大学 附属中山医院内分泌代谢病科,上海 200032
1 NAFLD的危害
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是指在无过量饮酒史条件下,除病毒感染、自身免疫性肝炎、药物性肝损伤以及其他原发疾病之外导致的肝脏甘油三酯沉积的一类慢性疾病[1]。NAFLD的疾病谱包括单纯性肝脏脂肪沉积、非酒精性脂肪性肝炎(NASH)、肝纤维化、非酒精性脂肪性肝炎相关的肝硬化。NAFLD不仅能造成肝脏损伤,还可以引起心血管疾病、2型糖尿病、慢性肾病、高血压和恶性肿瘤等肝外疾病[2-3]。
随着现代饮食和生活环境的变化,肥胖和代谢综合征的流行,NAFLD已成为全球最常见的肝病[4],全球患病率为24 %。南美洲(31 %)和中东(32 %)的发病率最高,其次是亚洲(27 %)、美国(24 %)和欧洲(23 %),而在非洲(14 %)较少见[5]。NAFLD在中国的发病率也在10年内显著上升,达到了每年6.3 %[6]。全国NAFLD患病率已达到29.2 %,在肥胖人群中发病率甚至达到51.6 %,几乎是非肥胖人群的5倍[7]。亚洲肠道和肥胖症(GO ASIA)工作组统计发现,58.9 %的中国大陆NAFLD患者表现出NASH的组织特征[8]。
2 肝脏甘油三酯代谢途径
肝脏在甘油三酯代谢的多个环节具有重要作用,参与其合成、消化、吸收、运输、分解等过程。肝脏中甘油三酯的来路主要分为游离脂肪酸摄取和肝脏内源性合成,去路则可以归纳为氧化分解以及合成极低密度脂蛋白(VLDL)释放入血。肝脏既可以将储存的体脂分解利用,也能将消化吸收的脂肪储存为体脂,这在正常人群中是动态平衡的。但在代谢紊乱时,这一平衡被打破,甘油三酯沉积于肝脏内,形成脂肪肝(图1)。
2.1 游离脂肪酸摄取
脂肪组织是能量储存的中转站:饥饿状态下脂肪分解供能,进食后血中的脂肪酸合成甘油三酯被储存。Donnelly等人[9]将同位素标记与肝活检相结合,评估了空腹和餐后状况下NAFLD患者进入肝脏的游离脂肪酸来源。他们发现,肝细胞中沉积的甘油三酯59 %来自脂肪组织分解的脂肪酸,26 %来自肝脏脂肪从头合成,饮食因素仅占到15 %。脂肪组织的分解在健康人群中受到胰岛素的抑制,但NAFLD患者脂肪组织胰岛素抵抗,在饱食状态下,游离脂肪酸并没有被脂肪组织摄取,而是进入了外周血和肝脏[10]。最为典型的是,脂肪组织特异性胰岛素受体基因敲除的小鼠,表现出了高脂血症和NAFLD[11]。
脂肪酸跨膜转运过程中,脂肪酸结合蛋白家族(FABP)、脂肪酸转运蛋白(FATP)、脂肪酸转位酶(FAT/CD36)等载体蛋白的表达增加,都能增加脂肪酸摄取和肝脏脂质沉积[12]。例如,肝脏FABP敲除的小鼠在高脂饮食条件下,和对照组小鼠有相同程度的胰岛素抵抗,但肝脏脂肪含量较少[13]。

图1 肝脏甘油三酯的代谢途径
2.2 内源性脂质从头合成
肝脏甘油三酯从头合成(de novo lipogenesis,DNL)首先以乙酰辅酶A为原料,经由乙酰辅酶A羧化酶(ACC)和脂肪酸合酶(FAS)催化合成脂肪酸,再进一步加工成为甘油三酯。肝脏DNL受到固醇调节元件结合蛋白-1c(SREBP-1c)、碳水化合物反应元件结合蛋白(ChREBP)和过氧化物酶体增殖物激活受体(PPARγ)等转录因子的调控[14]。肥胖和胰岛素抵抗状态下,肝脏中SREBP-1c的表达升高[15],促进了甘油三酯合成基因的表达[16]。小鼠中的SREBP-1c基因缺失时,饱食后肝脏中脂肪酸和甘油三酯的合成减少[17]。由此可见,SREBP-1c介导的甘油三酯从头合成途径,在肝脏脂质沉积中亦扮演着重要的作用。
2.3 肝脏甘油三酯分解减少
脂肪酸氧化主要通过线粒体β氧化释放能量,产生的乙酰辅酶A可以完全氧化为二氧化碳和水,也可以作为前体生成固醇,还可以转化为酮体。核转录因子PPARα在脂肪氧化基因表达的调控方面起到重要作用[18]。研究表明,PPARα全身敲除小鼠肝脏中脂肪酸氧化基因的表达下调,导致肝脏甘油三酯蓄积[19]。同样地,肝细胞特异性PPARα敲除小鼠在1年的正常饮食下,自发出现脂肪肝和高胆固醇血症[20]。
2.4 肝脏脂质转运异常
在肝脏内质网中,微粒体甘油三酯转移蛋白(MTP)将载脂蛋白B(Apo B)和肝脏内的甘油三酯结合为极低密度脂蛋白(VLDL)并分泌[21]。NAFLD时,VLDL合成和分泌相对减少。Fabbrini等人[22]发现,健康人群中,随肝脏甘油三酯的含量升高,肝脏VLDL分泌的量是线性增加的,但是当肝脏甘油三酯浸润超过10 %时,VLDL的分泌不再上升。胰岛素抑制Apo B合成,即使胰岛素敏感性轻度受损,VLDL分泌也受到抑制[23]。活性氧也可以引起Apo B合成障碍,抗氧化剂处理可以逆转活性氧引起的VLDL分泌减少[24]。肝功能障碍时,磷脂及脂蛋白合成不足,胆固醇酯化障碍,转运能力降低,胆固醇转化为胆汁酸的能力下降,导致血浆胆固醇升高,这又进一步导致肝内甘油三酯的蓄积。
3 NAFLD的发生机制
3.1 “二次打击”“多重打击”学说
NAFLD的发病机制中,最广为人知的是20年前提出的“二次打击学说”。第一次打击是指脂质代谢紊乱和胰岛素抵抗,之后继发产生的肝脏氧化应激、DNA损伤和ATP耗竭等形成第二次打击。肝脏在双重打击下,产生肝细胞炎症及损伤、肝纤维化乃至终末期肝病[25]。由于肝脏单纯脂肪变性和NASH在病程发展中风险和恶性程度明显不同,近年来“多重打击学说”逐渐取代了“二次打击学说”,即肠道菌群和内毒素血症、肝脏内质网应激和线粒体功能障碍甚至遗传因素[26]等多重打击因素,共同促进了肝脏脂肪变性和炎症发生(图2)。
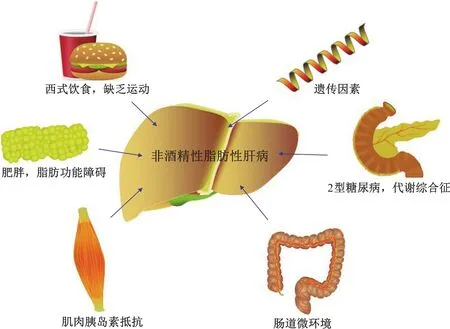
图2 非酒精性脂肪性肝病的发生机制
3.2 遗传因素
全基因组关联研究发现,PNPLA3基因(I148M)和TM6SF2基因(E167K)变异与肝脏脂肪沉积和NASH易感性增加密切相关[27]。带有这两种基因变异的人作为肝移植供体,会增加受体NAFLD的风险[28]。
Patatin样磷酯酶结构域蛋白3(PNPLA3)又称为脂肪滋养蛋白,在肝脏中丰富表达,同时具有甘油三酯脂肪酶和酰基甘油转酰基酶的活性,主要促进脂肪合成。其序列变异后,自身免于被蛋白酶体降解[29],从而在低密度脂蛋白(LDL)上积累[30]。PNPLA3基因变异不仅使得脂滴内的甘油三酯动员受损[31],促进肝脏甘油三酯沉积[32],还活化肝脏星状细胞,促进肝脏纤维化[33]。2008年首次通过全基因组关联分析发现PNPLA3基因变异与NAFLD的关系,并证实西班牙裔人群中该变异远高于非洲、欧洲裔人群[34],这和西班牙裔人群内脏脂肪含量较高可能也相关[35]。这种基因变异在肥胖儿童中就能造成肝酶水平升高,影响胰岛素敏感性[36]。一项包含了2 675例NAFLD患者的统计发现,PNPLA3基因突变后,只有肥胖群体肝脏内的甘油三酯含量明显升高,提示肝脏炎症的血清ALT(谷丙转氨酶)含量大幅上升,表明肥胖加剧了遗传因素对肝脏的损伤[37]。
TM6SF2位于内质网和高尔基体复合体中,与胆固醇和甘油三酯代谢的调节相关。小鼠肝特异性过表达或者敲除TM6SF2,则血浆中总胆固醇和低密度脂蛋白胆固醇水平相应升高或降低[38]。TM6SF2基因敲除小鼠表现为肝脏甘油三酯含量增加数倍,VLDL分泌显著降低[37]。这表明TM6SF2的活性对于极低密度脂蛋白(VLDL)的正常分泌是必须的。虽然TM6SF2遗传突变的患者胰岛素抵抗、BMI增高和血脂紊乱并不明显,但外周循环中磷脂酰胆碱缺乏[39],肝脏脂质输出不良,肝脏甘油三酯沉积明显[40]。但中国一项包含920例的队列调查显示,仅0.4 %的NAFLD患者带有此突变,提示它对中国人群NAFLD的发病影响有限[41]。
3.3 环境因素
在高热量饮食和缺乏运动的现代生活方式影响下,肥胖症患者增多,人体内游离脂肪酸(FFA)、神经酰胺等代谢产物聚积,会诱发慢性低度炎症及代谢性炎性综合征(MIS)。这种慢性炎性状态参与了非酒精性脂肪性肝病、动脉粥样硬化、2型糖尿病等多种疾病的发生发展进程[42-43]。
饮食结构的改变与NAFLD发展有关。高蛋白、总脂肪、饱和脂肪[44]、红肉[45]、omega-3不饱和脂肪酸[46]、过氧化物质[47]的摄入量和比例都对胰岛素敏感性、肝脏脂肪聚集、肝脏炎症发生作用。果糖作为饮食中常用的甜味剂,不知不觉中被我们大量摄入。比起摄入相同能量的葡萄糖,果糖会增加脂肪从头合成,促进异位脂肪的形成,造成内脏脂肪沉积和腹型肥胖[48]。人群数据表明,摄入果糖在导致肥胖前就已经促进了肝脏纤维化发生[49]。小鼠模型中,果糖增加了肠道壁的通透性,血浆细菌内毒素水平上升[50];同时果糖还可以诱导小鼠铜缺乏[51],进一步造成NAFLD。
3.4 脂肪因子和肌肉因子
脂联素和瘦素是与NAFLD发病密切相关的脂肪因子。肥胖患者常以低脂联素水平和高瘦素为特征。脂联素由脂肪组织特异性分泌,可作用于神经中枢,增加能量消耗控制体重[52]。研究表明,脂联素水平与内脏脂肪增加呈负相关[53]。瘦素主要由脂肪组织分泌,在能量供应充足时,抑制食欲、抑制脂肪合成和异位脂肪积聚[54]。肥胖患者常发生瘦素抵抗,食欲并没有被抑制,从而摄入了过多能量[55-56]。最新研究发现,无论通过转基因小鼠模型还是给小鼠注射瘦素中和抗体,降低循环瘦素水平后,小鼠摄食量均下降且胰岛素和瘦素的敏感性明显提升,提示瘦素中和抗体是潜在药物靶点[57]。脂肪因子NRG4属于神经调节蛋白,在脂肪组织中高度表达。人群研究表明NRG4在NAFLD患者血清中显著降低[58]。动物实验则证实:Nrg4可有效抑制LXR和SREBP1c介导的甘油三酯从头合成过程[59],表明Nrg4对NAFLD的发生具有保护作用。
肌肉因子Irisin是一种新发现的肌动蛋白。运动或者寒冷环境中的寒颤可以刺激骨骼肌中PGC1-α的表达,使FNDC5的表达增加,FNDC5进而水解释放Irisin。Irisin改善脂代谢的机制包括通过p38 MAPK和ERK途径刺激白色脂肪褐色化,增加脂肪分解产热[60-61],以及通过激活AMPK,改善胰岛素抵抗状态下的肝细胞死亡等[62]。人群研究表明,FNDC5(rs3480)基因变异与NAFLD的组织学损伤程度相关,且与PNPLA3和TM6SF2变异造成的危害具有叠加性[63]。Irisin过表达小鼠则免受高脂饮食诱导的肥胖和胰岛素抵抗[64]。
3.5 线粒体功能障碍
脂肪酸β-氧化主要发生于线粒体。通过高分辨率呼吸计(HRR)量化肝线粒体功能,结合线粒体含量一起分析,发现所有肥胖人群线粒体呼吸速率都会增加,肝脏线粒体代偿性活跃。NAFLD发展为NASH过程中,患者的呼吸控制比(RCR)逐渐降低,泄漏控制比(LCR)升高,线粒体解偶联出现障碍。而氧化性DNA损伤的标志物8-OH-dG仅在NASH中升高,提示线粒体结构损害和失代偿[65]。
肝细胞中线粒体的活性取决于其结构的完整性、营养物质和能量供需、氧化剂和抗氧化剂的平衡等。NAFLD患者中,较高的氧耗与较差的组织学分级相关[66],且与三羧酸循环活性正相关,表明线粒体功能障碍受到脂质超负荷的诱导[67]。小鼠和NASH患者的血浆中线粒体DNA和氧化DNA含量增加,激活Toll样受体9(TLR9)[68],驱动肝脏枯否细胞产生IL-1β,导致脂肪变性、炎症和纤维化,而TLR9基因敲除小鼠则免受IL-1β介导的肝脏炎症[69]。
3.6 内质网应激
内质网应激在高血糖、高血脂[70]、氧化应激、线粒体损伤、钙离子耗竭[71]等情况下都会被激活。内质网应激是肝细胞凋亡、坏死的重要诱因,加速NASH、纤维化。在缺乏ATP以及供能障碍的情况下,内质网内未折叠蛋白积累,称为“未折叠蛋白反应”(UPR)。这是一种适应性机制,令蛋白质合成减少,内质网对于蛋白的转运能力增加,蛋白质降解途径激活[72]。但与此同时,UPR不仅激活了主导炎症和细胞凋亡的c-jun末端激酶(JNK),加速了胰岛素抵抗和非酒精性脂肪性肝炎的发展,还通过诱导Caspase-2上升,激活SREBPs,使得甘油三酯和胆固醇积累[73]。伴侣葡萄糖调节蛋白78(GRP78)是UPR的主要调节器之一。在非应激态时,GRP78和UPR的效应器(ATF6、IRE1、PERK)结合,这些效应器处于无活性状态;应激态下,GRP78释放这些效应器,激活UPR。GRP78杂合子小鼠能量消耗增加,高脂饮食下也不容易肥胖[74]。ob/ob小鼠肝脏过表达GRP78可有效减少SREBP-1c的活化,肝甘油三酯和胆固醇含量降低[75]。
3.7 胆汁酸
胆汁酸来源于胆固醇,是胆汁的重要组分,不仅在脂质代谢中促进胆固醇和脂溶性维生素的吸收,也作为信号分子调节代谢。法尼醇X受体(FXR)是重要的胆汁酸核受体,在肝脏、小肠等组织丰富表达,参与糖脂代谢。胆汁酸激活FXR后,可降低血清和肝脏中的甘油三酯水平,改善血糖和胰岛素敏感性[76]。FXR的活化还激活了成纤维细胞生长因子FGF19,增加糖原合成和脂肪酸氧化,同时减少了糖异生。FXR在抑制炎症方面也有作用[77]。在高脂喂养诱导的NAFLD大鼠中,虽然胆汁酸产生增加,但胆汁酸信号传导受到抑制[78]。抑制回肠胆汁酸转运蛋白、抑制胆汁酸摄取可预防高脂喂养小鼠发生NAFLD[79]。肠道菌群对小鼠胆汁酸组分变化以及FXR活性也有影响[80]。
3.8 肠道微生态
人类肠道里有数万亿的微生物,这些微生物与人类经历了亿万年的共演化过程,帮助人类消化吸收营养物质,也调节代谢和免疫[81]。肠道菌群对于营养物质消化吸收和能量摄入具有至关重要的作用。动物实验表明,即使摄入食物热量略少于无菌小鼠,常规饲养的小鼠体内脂肪和肝脏甘油三酯含量也比无菌小鼠高42 %[82]。菌群不仅能促进脂肪合成增加,也增加了脂肪的储存。用相同高脂饮食喂养肠道菌群不同的小鼠,在肥胖和NAFLD易感性方面就大不相同,这提示肠道菌群独立于肥胖对NAFLD的发展起作用[83]。
由于NAFLD合并T2DM患者数量并非小数目,而高血糖对肠道屏障受损和肠道感染的助推作用是确定的[84],NAFLD患者中有一定比例会发生肠道菌群紊乱。肠道菌群失调后,微生物群驱动的肠上皮屏障和肠血管屏障破坏,小肠通透性增加,脂肪酸吸收增加,炎性细胞因子如TNF-α、IL-6的分泌增加,这是NASH发展的前提[85]。
4 NAFLD的治疗
4.1 改变生活方式
饮食控制和加强运动是改善NAFLD的有效生活方式。非酒精性脂肪性肝病患者应坚持科学合理的饮食,控制总的能量摄入,建议低热量低脂平衡饮食。限制热量、控制体重对于延缓病程发展乃至逆转病程、消退纤维化都有作用,也能减少诸如2型糖尿病、动脉粥样硬化等合并症的发生。而运动的好处包括但不限于以下方面:增强组织对胰岛素的敏感性,加速脂肪分解从而调节血脂血糖,改善凝血功能从而降低心血管风险。对于无明确禁忌(心功能不全、严重感染、新发心脑血管事件等)的患者,均推荐中等强度有氧运动或抗阻力运动[86-87]。但由于大幅度减重难以达到且难以维持[88],肥胖症患者中又有相当比例的人存在肌肉减少[89],或者合并不能剧烈运动的并发症,所以药物治疗有时也是需要的。
4.2 药物治疗
针对NAFLD的上述发病机制,目前已研发了一系列药物以改善胰岛素抵抗和代谢失调、降低促炎因子、消除纤维化、抗氧化、改善内质网应激、调节肠道菌群和免疫状态。目前进入临床三期的药物有Elafibranor、Obechicholic acid、Resmetirom、Cenicriviroc和Selonsertib(表1),均为口服制剂[90]。
4.3 改善代谢类药物
新型胰岛素增敏剂Elafibranor(GFT-505)作为双重的PPAR-α/δ激动剂,能改善肝脏以及外周的胰岛素敏感性。由于不会激活PPARγ,Elafibranor不会像噻唑烷二酮类药物一样引起体重增加。目前正在三期RESOLVE-IT临床试验中。

表1 进入临床三期的NASH药物
FXR激动剂奥贝胆酸(Obechicholic acid)在临床三期研究REGENERATE中,对于NASH纤维化有良好的疗效[91],但其常见不良反应有瘙痒、低密度脂蛋白-胆固醇(LDL-C)增加等。
甲状腺素受体β选择性激动剂Resmetirom,在降低血清甘油三酯、低密度脂蛋白胆固醇的同时,不会引起甲状腺毒症。但由于其可能促进有丝分裂,长期安全性未知。在NASH上的三期临床试验于2019年3月开始。
4.4 抗炎、抗纤维化类药物
单核细胞浸润是NASH进展的关键机制,特别是纤维化和肝硬化阶段,CCR2+细胞在门静脉周围积聚[92]。CCR2+单核细胞衍生的巨噬细胞从外周血进入肝脏,分泌包括TNF-α在内的炎性细胞因子,驱动炎症并激活HSC,促进血管生成和纤维化进展[93]。Cenicriviroc(CVC)是一种口服的免疫调节剂,具有双重CCR2/5抑制作用,拮抗CCR2/5介导的巨噬细胞募集[94]。基于289名NASH和纤维化患者的二期临床试验发现,Cenicriviroc具有良好的安全性和对纤维化的改善作用。目前,三期临床试验正在进行中。值得注意的是,因为Cenicriviroc不涉及改善脂质沉积,而脂质沉积是慢性炎症和纤维化的前提条件,所以Cenicriviroc和改善代谢的药物联合使用才能针对NAFLD源头,达到事半功倍的效果[94]。
4.5 抗凋亡类药物
肝脏纤维化是NASH的病理特征,与肝细胞凋亡相关。凋亡信号调节激酶1(Ask-1)抑制剂斯隆色替(Selonsertib),在原理上可以抑制肝纤维化,但针对肝纤维化四期的NASH患者的三期临床试验以失败告终,针对肝纤维化三期NASH患者的临床试验正在进行中。
4.6 调节肠道微环境类药物
胃肠道中的共生微生物群有助于调节宿主代谢健康,因为肥胖等代谢性疾病与肠道菌群的失衡有关。某些特定菌群例如Akkermansia muciniphila(AKK)可以减弱肠壁的通透性,增强肠道屏障,从而提高糖耐量,提升糖和脂等营养物质在代谢性器官中的利用率[95]。除此之外,该菌群还能在体内调节肠道适应性免疫应答[96]。作为新型的口服微生物补充剂,经过巴氏灭菌的AKK在3个月的治疗中,虽然对体重和内脏脂肪没有改善,但使得患者的肠屏障功能增强,从而显著降低GGT和AST,提高胰岛素敏感性,改善血脂,降低血浆细菌产物脂多糖[97-98]。
益生元和益生菌对NAFLD的治疗作用仍在研究探索中。益生元补充剂可以在不改变体重的情况下,改善肝脂肪变性、肝酶功能和血脂,并对胰岛素抵抗也有改善作用。常用的益生菌有双歧杆菌和乳杆菌,它们可以通过产生乳酸和其他抗微生物的物质来抑制革兰氏阴性病原菌的扩增,改善胆固醇水平、内脏脂肪和胰岛素抵抗。益生菌还可调节肠道通透性,抑制促炎细胞因子TNFα,IL-1和IFN-γ等等的产生[99]。
4.7 减重手术
虽然手术对于降低体重、维持血糖稳定、减少心血管事件的效果是药物无法比拟的,但术后贫血、低铁蛋白血症常见,且风险和并发症难以规避[100],所以需要严格把握手术指征,谨慎实施。目前仅推荐伴有2型糖尿病的肥胖症患者,在药物和生活干预效果不良的情况下考虑实施[101]。术式包括胃限制术、胃肠旁路术、胆胰分流并十二指肠转置术以及小肠切除等。手术治疗必须与饮食、运动相结合,并在术后密切随访。
5 结语与展望
NAFLD在全球广泛流行,但由于缺乏有效而特异的治疗药物和干预手段,使得其成为公共卫生领域一项巨大的挑战。由于NAFLD的发病是多因素的共同作用,单一的治疗方法往往难以获得很好的效果。但我们相信,随着对其病理生理机制的不断深入了解和药物靶点的发现,NAFLD能在未来得到有效的防治。
