燃烧我的卡路里
——产热脂肪的前世今生
2019-12-21陈鑫李国强孟美瑶徐凌燕
陈鑫,李国强,孟美瑶,徐凌燕
华东师范大学 生命科学学院/上海市调控生物学重点实验室,上海 200241
生命中的挑战并不是要让你陷于停顿,而是要帮助你发现自我。
——约翰森·里根
在中国经济社会高度发展的今天,衣食住行都变得非常方便,享受生活的同时,不知道大家是否发现自己身材的变化呢?

据2015年国家健康委员会统计:中国18岁及以上成人超重率为30.1 %,肥胖率为11.9 %;6~17岁儿童和青少年超重率为9.6 %,肥胖率为6.4 %,且该数据呈不断上升趋势[1]。由此可见,中国肥胖率的范围及严重程度都在不断扩大。
放眼整个地球村,肥胖也是肆虐全球的公共卫生问题,是冠心病、高血压、非酒精性脂肪肝、2型糖尿病和高脂血症等多种慢性代谢性疾病的常见诱发因素[2]。肥胖率居高不下给人类健康和社会经济带来巨大的压力。因此,肥胖问题亟待解决,刻不容缓。
导致肥胖的因素是复杂多样的,遗传、疾病和生活方式等都可造成肥胖。在过度加工的高热量食物与久坐不动的生活方式影响下,机体能量摄入长期超过能量消耗,能量收支的不平衡,更促进了肥胖的高发[3]。究其本质,肥胖是由全身或者局部脂肪过度堆积造成的。目前认为脂肪细胞存在三种类型:第一种是构成了大多数动物脂肪组织主体的单房性白色脂肪细胞,典型的例子是镶嵌在牛排上具有大理石般纹理的白色纹路,中年发福后圆滚滚的肚子里也积攒了许多白色脂肪;第二种是高度特化的棕色脂肪细胞,它们以热能的形式消耗储存的化学能,典型的棕色脂肪细胞聚集在啮齿动物的肩胛间区和肾周区,具有丰富的神经支配和血管供应;第三种米色脂肪细胞是最近发现的新型脂肪细胞,富集在皮下脂肪中,在静息态表现出白色脂肪细胞的特点,而在寒冷和β3肾上腺素刺激条件下又表现出棕色脂肪细胞的特质,因而具有极大的可塑性[4]。生理或病理条件下,白色脂肪细胞数量的异常增多、胞内脂质的累积过多,或棕色和米色脂肪产热功能降低导致的能量消耗异常减少,均可以导致肥胖(图1)。

图1 脂肪细胞的三种类型
对肥胖治疗的现状,也即“减肥”而言,目前已有的FDA批准的减肥药抑制摄食中枢(如利拉鲁肽)或抑制肠道脂肪吸收(如奥利司他),均通过降低能量摄入来达到减肥的目的。然而,这些药物往往会引发严重的副作用,包括抑郁、油性肠蠕动等。因此,开发新的肥胖治疗策略迫在眉睫。最新研究进展表明,棕色/米色脂肪细胞的数量与身体质量指数和肥胖呈负相关,增加棕色/米色脂肪细胞的数量或增强其产热功能导致机体的体重下降,提示其在控制能量稳态方面发挥着关键作用[5]。因此,研究棕色/米色脂肪组织的发育以及功能调控有望为治疗人类肥胖提供新的策略。
1 棕色脂肪的发育起源及解剖学特征
有意思的是,遗传学脂肪定位实验表明,肩胛间区和骨骼肌中的棕色脂肪细胞来自表达生肌决定因子Myf5的细胞群[6]。同时,棕色脂肪细胞与骨骼肌细胞的转录谱和线粒体蛋白组学也体现出棕色脂肪和骨骼肌的相关性[7-8]。
典型的棕色脂肪组织分布在啮齿类动物的肩胛间、肾周和主动脉周围。在人类中,棕色脂肪存在于婴儿的肩胛间,该棕色脂肪组织的发育主要在产前阶段完成,以便在婴儿出生后通过非震颤产热方式产生热量,维持婴儿体温。啮齿类动物的棕色脂肪组织则终生存在。人类肩胛间棕色脂肪组织随着年龄的增长逐渐缩小,因此曾一度认为成年人体内不存在有活性的棕色脂肪组织,直到使用氟-18-去氧葡萄糖正子断层扫描(18F-FDG-PET)结合计算机断层扫描(CT)对人体进行临床观察时,意外发现成人体内存在明显活跃的棕色脂肪组织,从而改写了这一说法[9]。目前,利用18F-FDG-PET/CT扫描技术,在成人颈椎、锁骨和腋窝处均发现了活跃的棕色脂肪组织。从进化角度来看,成年人类和非人灵长类动物脖颈处的棕色脂肪可能起到加热脑部血液供给、保护大脑的作用。
2 米色脂肪的发育起源及解剖学特征
米色脂肪是哺乳动物中除棕色脂肪以外的另一种热原性脂肪(thermogenic,能够产热的脂肪)。米色脂肪细胞主要分散存在于啮齿类动物皮下白色脂肪组织中,其在静息态时形态与白色脂肪细胞类似,寒冷、锻炼及长期使用过氧化物酶体增殖物激活受体γ (PPARγ)激动剂等因素可以激活米色脂肪细胞。激活态的米色脂肪细胞在形态与功能上类似于棕色脂肪细胞,大量表达UCP1并表现出UCP1依赖的产热能力,这种现象因此被称为白色脂肪棕色化或褐变[10]。
米色脂肪细胞的发育起源尚未完全阐明。附睾白色脂肪中表达UCP1的米色脂肪细胞在分化前期表达PDGFRα、CD34和SCA1[11]。此外,Spiegelman研究小组研究表明,有10%~15%的UCP1阳性米色脂肪细胞,与表达Myh11的平滑肌细胞选择性标记的前体细胞具有同源性[12]。总之,这些结果表明米色脂肪细胞与棕色脂肪细胞有着不同的细胞起源,并且不同解剖学部位的米色脂肪可能具有异质性的细胞前体。有研究表明,成熟的白色脂肪细胞可直接转化为米色脂肪细胞。例如,在冷刺激过程中,可以观察到含有“多室”脂滴、介于白色和米色中间状态的脂肪细胞[13]。一方面,皮下脂肪中新形成的米色脂肪细胞有很大一部分对BrdU或Ki67呈阴性,提示低温诱导的米色脂肪细胞是由成熟的白色脂肪细胞直接转化而来,并且不具备有丝分裂增殖的能力[14];另一方面,Scherer研究组对成熟脂肪细胞进行了脉冲追踪脂肪图谱实验,发现大部分新发育的米色脂肪细胞是由皮下脂肪前体细胞分化而来[15]。
米色脂肪组织与棕色脂肪组织具有不同的组织细胞异质性。肩胛间和肾周棕色脂肪主要由棕色脂肪细胞组成,通过一层结缔组织与周边白色脂肪分离[16]。相比之下,皮下脂肪中,米色脂肪细胞与单房脂滴的白色脂肪细胞共同存在,没有明显的结缔组织分离。在冷刺激下,酪氨酸羟化酶神经纤维(去甲肾上腺素能)密集分布的区域出现激活的米色脂肪细胞[17]。同时,米色与棕色脂肪细胞在基因表达水平上也有明显差异。虽然米色脂肪细胞和经典的棕色脂肪细胞共享许多特异性或富集基因,如Ucp1、Pgc1a、Cidea和Prdm16,但是米色脂肪细胞也表达反映其发育起源的独特标记基因[18]。例如,米色细胞不表达Zic1、Lhx8和Epstl1等肌细胞富集基因,而表达Cited1、Tmem26、CD137和Tbx1等特异性富集基因。同时,从人体中包括锁骨上区和腹膜后区在内的多个身体部位分离出来的脂肪组织大量表达米色脂肪细胞标记物,而从婴儿肩胛间区域或成人颈部区域获得的人类脂肪组织具有与棕色脂肪细胞相似的分子特征[18-19]。综上所述,这些发现表明人类棕色脂肪中米色脂肪细胞和棕色脂肪细胞可能混合共存(图2)。
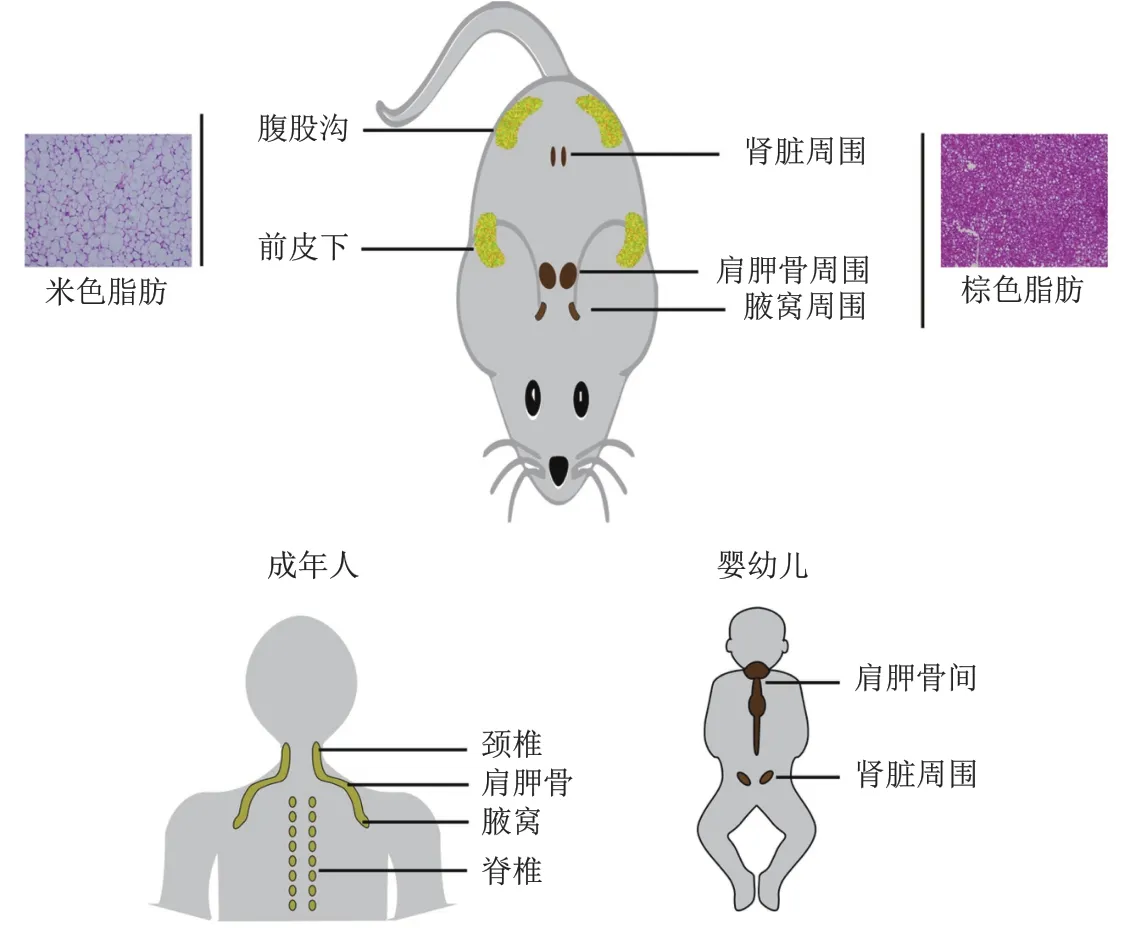
图2 棕色和米色脂肪在啮齿类和人体内的分布
3 调控棕色和米色脂肪发育和功能的因素
3.1 调控棕色和米色脂肪细胞发育的转录调控
以PPARγ和CCAAT增强子结合蛋白(C/EBP)为主导的脂肪细胞分化调控通路最初在白色脂肪中得到了详细的研究[20],这一转录级联调控通路在棕色和米色脂肪细胞的分化中也同样重要。基因敲除PPARγ可以完全扰乱白色脂肪细胞和棕色脂肪细胞的分化。C/EBPα只参与白色脂肪细胞的形成,不参与棕色脂肪细胞的分化。C/EBPβ在棕色脂肪细胞中高度表达,在调节产热的基因程序中起着重要的作用[21]。有趣的是,棕色脂肪细胞的分化需要PPARγ,但在成纤维细胞或间充质细胞中过表达PPARγ只诱发其向白色脂肪细胞分化,这都表明棕色脂肪细胞的分化成熟需要额外的因素诱导[22]。
高中生的地理教学十分重要,应该引起所有教育事业者的注意。同时也应该加强学生的核心素养的培养,坚持对学生进行素质教育,以将学生培养为高素质、高学识、高修养的“三高”人才而努力奋斗。
近年来发现了许多棕色脂肪细胞和米色脂肪细胞发育的转录调控因子,其中以PGC-1α和PRDM16为主形成的代谢转录调控复合物对于棕色和米色脂肪细胞代谢尤为重要。PGC-1α最初在棕色脂肪细胞中发现。作为PPARγ转录共激活因子[23],PGC-1α是线粒体生物合成的关键转录调控因子,并参与包括棕色脂肪和骨骼肌等细胞中的氧化代谢。在白色脂肪细胞中过表达PGC-1α可以诱导线粒体基因和产热相关基因的表达[23-24]。PRDM16是一种在棕色和米色脂肪中高表达的锌指蛋白,可以与PGC-1α和PPARs形成复合物[25]。PRDM16是棕色细胞基因程序的重要开关。在白色脂肪前体、成肌细胞以及成纤维细胞中过表达PRDM16可以诱导棕色脂肪细胞中相关基因启动,包括诱导线粒体生物合成、增加细胞呼吸作用和表达棕色脂肪选择性基因等,形成功能齐全的棕色脂肪细胞。将该细胞移植到小鼠体内,可形成具有棕色脂肪形态和生化特征的异位脂肪垫,并具有与内源性棕色脂肪类似的葡萄糖摄取功能[26]。目前大部分棕色和米色脂肪代谢研究围绕PRDM16/PGC-1α/PPARs代谢调控复合物进行,例如HSF1、ZFP516等分子促进,而FOXC2、TLE3和FOXA3等分子负调控该复合物蛋白组分功能,影响脂肪代谢和肥胖的发生发展[27-30]。
3.2 调控棕色和米色脂肪细胞的信号通路
棕色/米色脂肪的生理功能是保持体温和抵抗肥胖,因此棕色和米色脂肪细胞的发育和功能受到温度和营养需求变化的高度调控。其中调控棕色和米色脂肪细胞的重要信号通路主要包括β肾上腺素受体、一氧化氮(NO)、瞬时受体电位、PI3K和非依赖UCP1的肌酸(creatine)信号通路等。
(1) β肾上腺素受体(AR)有三个亚型:β1、β2和β3。去甲肾上腺素作用于脂肪细胞β3-AR,提高细胞内cAMP水平,导致cAMP依赖的蛋白激酶A(PKA)的磷酸化水平升高,随后激活p38 MAPKs和促进UCP1和PGC-1α的表达[31]。β1-AR在棕色脂肪细胞前体增殖中起到至关重要的作用,而β3-AR在功能成熟的棕色脂肪细胞产热和米色脂肪细胞发育方面扮演主要角色[32]。
(2)一氧化氮(NO)是由内皮细胞等多种细胞合成的一种气体信号分子。NO可以自由进出细胞膜,激活细胞内环鸟苷二磷酸(cGMP)参与神经、循环等生理及病理调节。NO可以在棕色脂肪细胞中激活cGMP依赖蛋白激酶(PKG)从而诱导UCP1表达和线粒体的生物合成[33],也可以在白色脂肪中激活cGMP信号诱导米色脂肪细胞发育[34]。
(3)TRPV是一类瞬时受体电位离子通道。其中TRPV1可由高温和辣椒中的刺激性化合物激活。在人类[35]和啮齿动物[36]中,辣椒素类可以激活胃肠道TRPV1的表达并诱导BAT产热;而TRPV4则负调PGC1α和UCP1的表达,并抑制细胞呼吸作用,还能有效地抑制炎症。TRPV4作为细胞自主调节因子在脂肪细胞的产热和抗炎过程中的作用,为治疗肥胖和相关代谢性疾病提供了新的靶点[37]。
(4)磷脂酰肌醇激酶PI3K是胰岛素、胰岛素样生长因子和其他生长因子的主要激酶介质,它的活性可以被同源性磷酸酶PTEN抑制。PTEN通过阻断PI3K通路,正向调控BAT的产热机制。研究表明:小鼠胚胎成纤维细胞过表达PTEN基因可以使UCP1表达升高,小鼠棕色脂肪组织活性增高;PI3K抑制剂也同样可以增加棕色脂肪产热和全身能量消耗[38]。
(5)UCP1非依赖的肌酸通路。在啮齿类动物模型中,肌酸水平的降低与热内稳态失调有关[39]。2015年哈佛医学院的Spiegelman教授发现肌酸可以促进米色脂肪组织的产热,并且是不依赖于UCP1的新产热途径[40]。随后,Spiegelman教授将肌酸合成的限速酶GATM在脂肪组织特异性敲除。相比于野生型和杂合小鼠,GATM脂肪特异性敲除小鼠在高脂喂养后体重和体脂含量均明显增加。GATM脂肪特异性敲除小鼠基础代谢率降低,回补肌酸后,基础代谢率明显升高。这说明肌酸参与了机体的“进食热效应”,当机体能量摄入过多时,肌酸会促进机体提高代谢率抵抗肥胖的发生[41]。
3.3 控制棕色和米色脂肪细胞发育和功能的分泌型蛋白和多肽
除了调控信号通路外,近年来发现了很多分泌型蛋白和多肽可以影响棕色和米色脂肪细胞的发育和功能,为治疗肥胖提供了新的思路(图3)。
(1)骨成型蛋白(BMPs)和转录生长因子(TGF-β)
BMP7处理成纤维细胞或脂肪前体细胞可诱导棕色脂肪基因程序表达升高。相反,BMP7缺失的胚胎中,棕色脂肪细胞数量减少,UCP1表达降低[42]。BMP4也能将间充质细胞导向脂肪细胞谱系,在小鼠皮下脂肪中表达BMP4可激活米色脂肪细胞分化[43]。BMP8b作用于成熟的棕色脂肪细胞以及下丘脑,正向调节棕色脂肪产热,但不影响其分化[44]。相比之下,TGF-β家族成员,包括GDF-8(肌肉生长抑制素)、TGF-β1等能够负调棕色脂肪分化和产热作用。抑制TGF-β信号可以激活BAT产热作用和改善肥胖和胰岛素抵抗[45]。基因敲除TGF-β下游Smad3蛋白也可以提高米色脂肪细胞形成,增加小鼠全身能量消耗[46]。
(2)成纤维细胞生长因子(FGF)
与大多数自分泌或旁分泌的成纤维细胞生长因子不同,FGF-19(小鼠FGF-15)、FGF-21和FGF-23通过内分泌形式起作用[47]。FGF-19在小鼠体内过表达可以通过激活棕色脂肪的产热作用增加代谢率,减少体脂含量[48]。在新生小鼠中,肝脏分泌的FGF-21在出生时可以急剧升高PPARα并激活棕色脂肪产热作用[49]。FGF-21还诱导米色脂肪细胞的分化,并且提高PGC-1α蛋白质含量[50]。尽管循环中的FGF-21长期升高会导致小鼠骨质流失[51],但脂肪分泌的FGF-21作用于局部组织,不会影响血液循环水平。因此,在脂肪组织中诱导FGF-21可能是治疗肥胖和胰岛素抵抗的有效方法。
(3)鸢尾素(Irisin)
Irisin是一种新发现的肌动蛋白,由膜蛋白、纤连蛋白III型域5(FNDC5)裂解而成。耐力运动或PGC-1α能够刺激骨骼肌中FNDC5表达和增加Irisin的血液循环水平。Irisin处理小鼠原代脂肪细胞或使用FNDC5腺病毒感染小鼠的肝脏组织可诱导白色脂肪棕色化,并保护动物免受饮食引起的肥胖[52]。
(4)心脏钠尿肽系统(Cardiac natriuretic peptide)
心脏钠尿肽系统由三种不同的配体-受体组成,分别为心房钠尿肽(ANP)、脑钠尿肽(BNP)和C型钠尿肽(CNP),以及相应的受体NPRA、NPRB和NPRC。ANP和BNP从心脏释放,是体液和血流动力学稳态的重要内分泌调节因子。其作用通过受体NPRA介导,而另一种钠肽(NP)清除受体NPRC能与ANP和BNP结合,将它们从循环中清除。研究表明,寒冷会增加脂肪组织中NP和NPRA的循环表达水平。在小鼠中使用BNP或在体外治疗人脂肪细胞中的NP,通过p38 MAPK激活BAT基因程序。此外,NPRC缺陷小鼠的白色脂肪中产生大量的米色脂肪细胞。由于高循环水平的NP与心力衰竭和心脏恶病质相关,因此确定这些肽的治疗窗口变得非常重要,要使这些肽增加能量消耗而不会对心脏或其他组织产生不利影响[53]。
(5)前列腺素(prostaglandins, PG)
环氧化酶(COX)是前列腺素合成中的限速酶。寒冷暴露诱导COX2基因表达,促进WAT中PG、PGE2和PGI2的释放。在WAT或PGI2处理的脂肪细胞前体中,COX2的过表达可诱导BAT选择性基因程序上升。相反,通过基因沉默COX2或药物来抑制COX的活性,可以抑制米色脂肪细胞的形成,这表明依赖COX产生前列腺素是寒冷诱导米色脂肪细胞形成的重要步骤[54]。
4 棕色和米色脂肪作为减肥靶标的治疗潜力和未来挑战
啮齿动物实验的证据清楚地表明,棕色和米色脂肪在机体能量稳态、底物代谢和葡萄糖稳态中起着重要的作用。例如,在热中性条件下Ucp1基因敲除小鼠会表现出饮食诱导的产热受损,最终发展为肥胖[55]。棕色和米色脂肪的移植增加能量消耗,还能清除将近75%的总葡萄糖和50%的甘油三酯[56]。在成人中,使用18F-FDG-PET/CT的回顾性研究显示,棕色脂肪活性与体重下降和改善糖脂代谢相关[57],并且研究发现寒冷通过激活BAT增加了10%的能量消耗[58]。使用个性化的冷暴露方案来最大限度地提高BAT的产热能力,能够每天提高150~300 kcal(1 kcal=4.186 8 kJ)的能量消耗和增加32%饮食诱导的产热[59]。从长远来看,每天10 kcal的微小差异将会导致身体脂肪的显著差异。每天多消耗10 kcal相当于燃烧1.1 g的体脂,10年就多燃烧4 kg。确实在40多岁时,BAT阳性的受试者相比阴性受试者减少大约6 kg的身体脂肪,使身体状态引起明显变化[60]。除此之外,研究显示寒冷激活的BAT直接对血糖水平以及血液中HbA1c、总胆固醇和LDL胆固醇水平均有明显影响[61]。因此,棕色和米色脂肪作为抵抗肥胖的靶点是很有吸引力的。

图3 棕色和米色脂肪发育和功能调控的信号通路
现在人们逐渐认识棕色和米色脂肪这个“宝藏”组织,以激活棕色和米色脂肪为目标可能为对抗人类肥胖和相关代谢紊乱提供新的治疗策略。当然,这还需要合适的工具去评估棕色和米色脂肪在人体中的总含量。生命中的挑战并不是要让你陷于停顿,而是要帮助你发现自我。谁也没有想到对于棕色和米色脂肪的存在和调控糖脂代谢功能的探索,会为肥胖与代谢疾病作出如此推动性的贡献。
