经气管镜超声引导活检钳活检术在纵隔和肺门病变诊断中的初步应用*
2019-12-20潘金兵钱皓瑜张爱兰张晓菊
李 晓 潘金兵 马 芸 钱皓瑜 张爱兰 张晓菊
(河南省人民医院呼吸与危重症医学科,郑州 450003)
支气管内超声(endobronchial ultrasonography,EBUS)提高了纵隔和肺门病变经支气管针吸活检(transbronchial needle aspiration,TBNA)检出率的同时,也降低并发症的发生,目前已经广泛应用于临床。但超声内镜引导下经支气管针吸活检(EBUS-TBNA)所取得的标本多为细胞学证据,且与所患疾病淋巴结质地、大小、穿刺针直径及操作者的熟练程度有较大关系,有时混杂血液也影响最终诊断。Prakash[1]报道应用活检钳穿过支气管壁对隆突下增大的淋巴结进行活检;Herth等[2]在超声引导下应用小型活检钳(endobronchial ultrasound-guided miniforceps biopsy,EBUS-MFB)对纵隔病变进行活检,观察到在淋巴瘤和结节病的诊断上EBUS-MFB明显优于EBUS-TBNA。2018年1月开始,我们在EBUS-TBNA中同期进行EBUS-MFB,至2019年1月完成38例,除前期有2例经验不足没有获得标本外(1例活检钳无法通过气管壁,1例活检钳不能进入到淋巴结深部,造成取材失败),以后36例均获得可供诊断的标本,现将结果报道如下,评估EBUS-MFB的检出率和安全性。
1 临床资料与方法
1.1 一般资料
本组36例,男20例,女16例。年龄34~78岁,(59.3±11.3)岁。有临床症状34例,包括发热6例,咳嗽25例,胸闷10例,咯血2例;无明显症状体检发现2例。均行胸部增强CT检查提示纵隔淋巴结肿大。术前诊断均为纵隔淋巴结肿大原因待查,均无术前病理诊断。
纳入标准:影像学检查提示有肺门和(或)纵隔淋巴结肿大需明确诊断。
排除标准:抗凝治疗或抗血小板治疗,血小板<50×109/L,凝血异常;低氧血症[动脉血氧分压(PaO2)<60 mm Hg];严重肺功能损害;不稳定心脏病,如不能控制的心律失常、急性冠状动脉缺血。
1.2 方法
禁食水6 h以上,穿刺过程中心电监护。静脉给予舒芬太尼(0.2 μg/kg)、丙泊酚(1.5~2.0 mg/kg)、罗库溴铵(0.3 mg/kg),置入喉罩,控制通气,连接T型接头延长管。
1.2.1 EBUS-TBNA 常规支气管镜(BF-240,日本Olympus公司)经喉罩进入气道,观察气道内有无异常可视性病变。超声检查系统(日本Olympus公司)包括超声光纤气管镜(BF-UC260F-OL8)和电子扫描超声专用主机(EU-C2000),使用21G穿刺针(NA-201SX-4021)。TBNA操作均在经支气管镜肺活检或经支气管镜黏膜活检之前进行。经喉罩插入超声气管镜,将先端水囊充盈到合适程度,并调节支气管镜前端使其贴紧气道黏膜探查病变或淋巴结,穿刺前用彩色多普勒超声模式确认病灶或淋巴结及其与周围血管的关系,在实时超声引导下使用21G穿刺针(图1)利用突刺法或推进法穿过气管壁进入病灶(图2A),确定穿刺针进入靶区后进行穿刺,推荐目标病变进行3~6次穿刺或获得满意的标本停止穿刺。当需穿刺多组淋巴结时,穿刺顺序为N3(对侧纵隔淋巴结)、N2(同侧纵隔淋巴结)、N1(肺门淋巴结)。取3条以上组织条,在EBUS-TBNA过程中开展快速现场细胞学评价(cytological rapid on-site evaluation,C-ROSE),判断穿刺成功。
1.2.2 EBUS-MFB 在行TBNA的淋巴结中选取便于活检钳通过而角度较小的淋巴结,获得EBUS图像,在超声引导下用原21G穿刺针(直径1.9 mm)在原穿刺点方向对气道黏膜穿刺4~5次,以扩大进针的通道,退出穿刺针,在EBUS指导下,经气管镜工作通道送入活检钳(图1)(FB233D,直径1.5 mm,日本Olympus公司)通过已形成的气道管壁的通道进入目标病变后活检(图2B),每个淋巴结至少活检3次[3],或者标本有较大组织块,同时C-ROSE判断取材成功。
1.3 病理诊断
C-ROSE标本中主要见淋巴细胞,判断为穿刺到淋巴结;见大量红细胞,考虑失败。TBNA和MFB所获得的标本送细胞学和组织病理学检查。病理医师对标本进行判断,记录标本的直径(标本放在一起后测量直径),以及取材标本的人工伪差(血凝块、组织破碎、组织凝成块状及挤压等均为人工伪差)。常规进行HE染色,根据结果决定是否行免疫组化或其他特殊染色。如果为非干酪性肉芽肿,结合临床病史、标本抗酸杆菌和真菌染色及PCR检测、随访,排除其他,可诊断为结节病[4]。在出现阴性或不充分的样本时,以CT引导下穿刺、纵隔镜或手术等病理结果为依据,或临床随访半年而判断。检出率即检出病变的例数除以全部病例数得到的百分比。
1.4 统计学处理
采用SPSS23软件进行统计分析,2种方法取材标本大小比较采用独立样本t检验,人工伪差比较采用χ2检验,组间检出率比较采用McNemar检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 标本大小及人工伪差的比较
EBUS-TBNA标本直径[(5.05±1.98)mm]大于EBUS-MFB[(3.08±1.25)mm](t=5.066,P=0.000),但EBUS-TBNA组有人工伪差的比例[89%(32/36)]高于EBUS-MFB[56%(20/36)](χ2=9.969,P=0.002),伪差主要为混有血液和挤压(图3),EBUS-MFB标本的有效组织较EBUS-TBNA组多且完整。
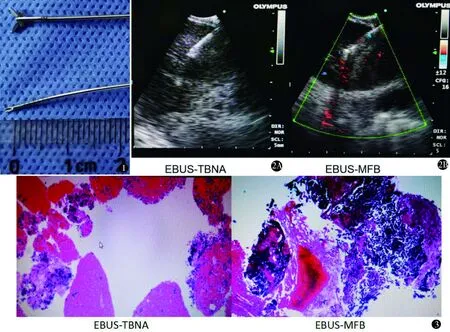
图1 穿刺针和活检钳 图2 EBUS-TBNA和EBUS-MFB超声图像:A.超声下可见穿刺针在淋巴结内;B.超声下可见小活检钳在淋巴结内 图3 EBUS-TBNA和EBUS-MFB所取标本对比,EBUS-MFB标本的有效组织较EBUS-TBNA组多且完整
2.2 检出率
8例EBUS-TBNA因组织有效成分不够,没有明确病理诊断,其中7例通过EBUS-MFB取得的标本明确病理诊断,1例通过胸腔镜手术活检确诊淋巴瘤。28例(78%)EBUS-TBNA标本及35例(97%)EBUS-MFB标本获得一致病理诊断,EBUS-MFB的检出率明显高于TBNA(McNemar检验,P=0.016)。
最终诊断:恶性疾病27例,包括腺癌12例,小细胞肺癌5例,鳞癌4例,淋巴瘤3例,类癌1例,转移性肾透明细胞癌1例,转移性甲状腺癌1例;良性疾病9例,包括结核3例,结节病4例,异位甲状腺1例,感染1例。不同诊断结果EBUS-TBNA和EBUS-MFB的检出率见表1。
2.3 并发症
EBUS-TBNA术中15例穿刺部位出血,其中12例自行停止,吸引清理后未再出血,3例需局部注入止血药和肾上腺素后停止。EBUS-MFB术中18例穿刺部位出血,其中15例自行停止,3例局部注入止血药和肾上腺素后停止。2组穿刺部位出血发生率差异无统计学意义(χ2=0.503,P=0.478)。均未见感染、气胸、纵隔气肿、呼吸衰竭等并发症。
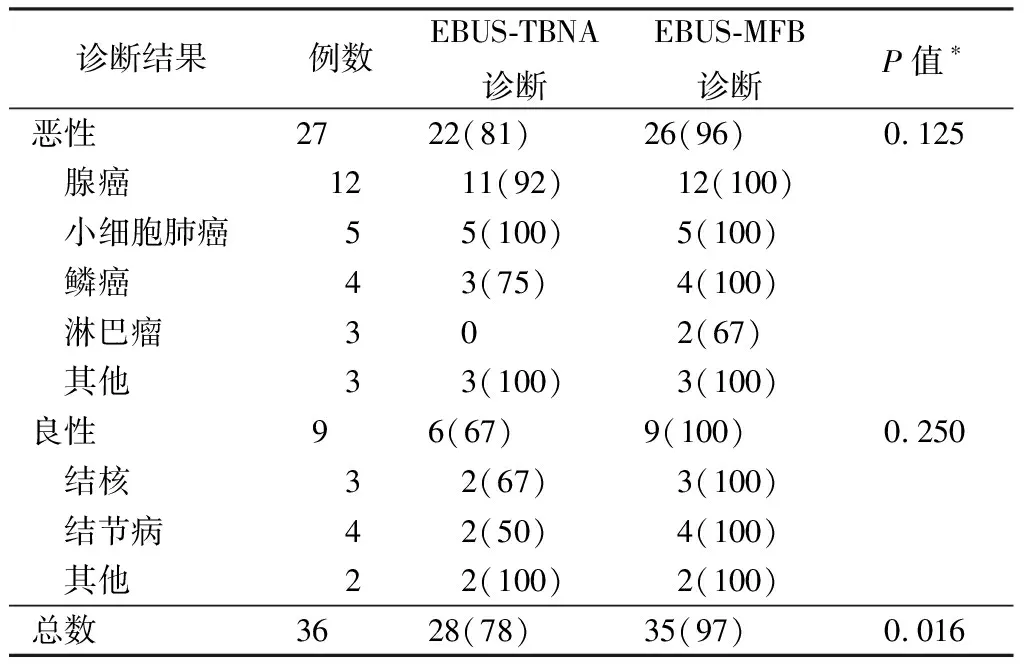
表1 不同诊断结果EBUS-TBNA和EBUS-MFB的检出率[n(%)]
*McNemar检验
3 讨论
EBUS-TBNA是在实时超声引导下经支气管进行针吸活检,是目前诊断纵隔病变的重要工具。超声除定位外还可以确认血管位置,避免误穿血管,提高穿刺的准确性和安全性。虽然有报道EBUS-TBNA对结节病的检出率超过80%[5],对淋巴瘤的诊断甚至达到90%[6],但多数报道EBUS-TBNA对淋巴瘤的检出率低于60%[2,7]。这可能与EBUS-TBNA的标本过小、挤压、破碎有关,诊断缺乏足够的组织学依据。为避免纵隔镜等创伤较大的诊断手段,Prakash[1]于气管镜下用电刀做气道壁切口,从切口伸入活检钳进行纵隔淋巴结活检。Oki等[8]在荧光镜引导下用小活检钳进行纵隔淋巴结活检。Herth等[2]认为EBUS-MFB提高淋巴瘤检出率的原因可能是EBUS-MFB能更好地保留淋巴结的结构,组织取出较多,有利于后续免疫组化和流式细胞学检测对标本的需求。联合应用EBUS-TBNA和EBUS-MFB更有利于淋巴瘤和结节病的诊断[3]。在本研究中,EBUS-MFB组检出率(97%)明显高于EBUS-TBNA组(78%)。但当对良、恶性疾病分别统计时,2种方法的检出率均没有明显差异。3例淋巴瘤中,EBUS-MFB诊断2例,EBUS-TBNA均未明确诊断。同样,EBUS-MFB对4例结节病和3例结核病均明确诊断,EBUS-TBNA各有2例和1例没有明确诊断。由于病例数较少,有待更多数据进一步证实。
本研究对比2组标本的直径以及取材标本的人工伪差,结果显示EBUS-TBNA组的标本直径较EBUS-MFB组大,但诸如混有血液和挤压等人工伪差更明显,EBUS-MFB标本中的有效组织较EBUS-TBNA组明显多且完整,这是EBUS-MFB检出率高的主要原因,而不是取材标本的大小。这个结果也提示EBUS-MFB的效率更高,如果增加活检次数,检出率可能进一步提高。
目前应用的超声气管镜的工作通道能通过21G穿刺针,但由于超声镜工作通道的独特设计,先端直径约为1.9 mm的常规活检钳不能通过超声镜的工作孔道操作。我们选用先端直径1.5 mm活检钳,刚开始操作时经验不足,1例活检钳无法通过气管壁,可能和TBNA穿刺针所造成的孔道较小,而直径1.5 mm活检钳质地较软,无法沿穿刺针孔道进入;1例活检钳不能进入到淋巴结的深部,而沿气道壁进入纵隔,可能和淋巴结的质地较韧,而活检钳前端为钝性而不能进入,造成取材失败,但后续36例均取材成功。由于21G穿刺针穿刺造成的通道较小,Prakash[1]报道再次通过普通气管镜应用19G穿刺针在原来的穿刺点再次穿刺以扩大通道,但穿刺针价格昂贵,操作过程中需要更换气管镜,过程繁琐;Gasparini等[9]报道应用针状活检钳穿透气管壁进入纵隔对淋巴结直接进行活检,同样可取得较高的检出率,但有4例由于针状活检钳无法穿透气管壁导致穿刺失败。近期我们采用Broncus公司的LungPro手术套件(穿刺针、球囊及活检套装)行纵隔淋巴结活检,其可行性尚在观察。
EBUS-TBNA的并发症有纵隔等部位感染、出血以及发热、气胸等,严重的有心血管事件、呼吸衰竭、低氧血症等[10]。EBUS-MFB是在原TBNA基础上建立通道,同样存在以上并发症可能。另外Krenke等[11]报道1例活检钳进入纵隔淋巴结后,手柄控制处导丝断裂,活检钳无法闭合,经拆解、闭合活检钳后取出。本研究均无明显并发症发生,即使出血也为少量,多可自行停止。
综上所述,EBUS-MFB可明显提高纵隔和肺门病变的检出率,未发现严重并发症,但EBUS-MFB只是初步应用到临床,其应用价值和并发症有待进一步评估。
