花生黄化病致病线虫的形态鉴定与分子生物学检测
2019-12-20廖琳琳刘国坤张绍升
廖琳琳, 刘国坤, 程 曦, 张绍升
(福建农林大学植物保护学院, 福建 福州350002)
装饰中环线虫(Mesocriconema ornata)是一种外寄生线虫,花生是装饰中环线虫的重要寄主作物(张绍升,1999)。 被侵染的花生植株,其根、荚果和果针上会形成褐色坏死斑。 少数伤痕时形成于表面,而坏死的大伤痕则可以深入到组织内。 大量的侧根原基和幼根被杀死,导致侧根数减少,使植株的地上部生长衰弱,叶色黄化。 美国的佐治亚州将此病称为“花生黄化病”( Lucet al,2005)。 目前已有研究发现,在福建省厦门市、福州市、莆田市的花生上分离出一种线虫,对该线虫形态进行测量和观察后将其鉴定为装饰中环线虫(章淑玲等,2012;李世通,2013)。
近年来,课题组在宁德市霞浦县的多个花生地块采集到黄化的花生病株,获得大量形态特征一致的环线虫。 本试验通过显微形态测量观察以及分子生物学测定,对这些花生黄花病致病线虫进行鉴定。
1 材料与方法
1.1 标本采集
2013—2014 年,在宁德市霞浦县的花生产区发现花生黄化的现象,采集受害花生的根、荚果和根际土壤,并带回实验室作进一步检查。
1.2 线虫分离与病组织染色
利用改良贝曼漏斗法(张绍升,1999)对采回的花生植株的根系、荚果和根际土壤进行分离,通过病组织染色观察线虫的侵染状态,染色方法参考Bybdet al(1983)。
1.3 线虫标本制作与保存
将分离获得的线虫置于体视显微镜下,挑取成虫于凹玻片的水滴中,经酒精灯火焰温热杀死。 将杀死后的线虫挑到滴有TAF 固定液的载玻片上制成临时玻片,用于形态特征观察。 取部分线虫样本经脱水后制成永久玻片用于保存(张绍升,1999)。
1.4 线虫的分子生物学鉴定
1.4.1 线虫DNA 的提取 将单头雌虫挑于灭菌的dd H2O 中清洗3 遍。 取20 μL 的WLB 裂解液于200 μL 的PCR 管中,并加1 μL 蛋白酶K 溶液(1.2 mg·L-1)混匀(Williamset al,1992)。 挑取清洗过后的线虫于混合液中,用挑针压断线虫。 将其置于-20 ℃冰箱中过夜。 然后取出放在PCR 仪中65 ℃温育1 h,95 ℃10 min,降温至4 ℃后,将其作为模板加入到反应体系中扩增。
1.4.2 PCR 扩增 ITS 区扩增:引物为ITS1(5′-TTGATTACGTCCCTGCCCTTT-3′)和ITS2(5′-TTTCACTCGCCGTTACTAAGG-3′)。 采用50 μL 反应体系:25 μL PCR Master Mixture、5 μL DNA 模板、2 μL ITS1 (10 mmol·L-1)、2 μL ITS2 (10 mmol·L-1)、16 μL ddH2O。 扩增程序:95 ℃预变性150 s;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共35 个循环;72 ℃最后延伸600 s,于12 ℃保存。
D2D3 区扩增:引物为D2A(5′-ACAAGTACCGTGAGGGAAAGTTG-3′)和D3B(5′-TCGGAAGGAACCAGCTACTA-3′)。 采用50 μL 反应体系:25 μL PCR Master Mixture、5 μL DNA 模板、2 μL D2A (10 mmol·L-1)、2 μL D3B (10 mmol·L-1)、16 μL ddH2O。 扩增程序:94 ℃预变性240 s;94 ℃变性40 s,53 ℃退火40 s,72 ℃延伸60 s,共36 个循环;72 ℃最后延伸600 s,于4 ℃保存。
1.4.3 上样与琼脂糖凝胶电泳 反应结束后,将1%琼脂糖凝胶放置在电泳缓冲液为0.5×TBE的电泳槽中。 取5 μL 扩增产物、1 μL 6×loading buffer 和0.2 μL 的核酸染料混合,于凝胶孔中上样。 在电压100 V、电流40 mA 下电泳30 min。 电泳结束后,将凝胶放置在全自动凝胶成像仪中观察、拍照。
1.4.4 PCR 产物纯化、克隆和测序分析 PCR 产物送交生工生物工程(上海) 股份有限公司进行纯化、克隆和测序。 将测序结果拼接后在NCBI 上进行相似性比对。
2 结果
2.1 症状描述
在田间被大量环线虫严重侵染的花生植株,地上部叶片黄化,表现出生长不良状。 地下部的根系不发达,有大片线虫侵染后形成的坏死斑。 在体视显微镜下解剖根系,可以观察到取食根系的环线虫(图1A、B)。 为了更清楚的观察线虫的侵染状态,对病组织进行染色,可以看到入侵的环线虫(图1C)。

图1 装饰中环线虫危害花生的田间症状Figure 1 Symptoms of peanut caused by M. ornata
2.2 病原线虫形态学鉴定
2.2.1 形态测量值 宁德霞浦种群♀(n=25):L(体长)=498.5±43.8(401.3 ~576.9)μm;Lv(头端至阴门的距离)=462.3±41.0(370.2 ~534.8)μm;V.A.(阴门至肛门的距离)=9.8±2.2(5.4~14.3)μm;St(口针长)=54.7±2.5(49.9 ~58.7)μm;StC(口针锥体长)=40.3±1.6(37.0 ~43.2)μm;StB(口针基杆长)=10.1±1.4(7.0 ~12.2)μm;StKH(口针基球高)=4.3±0.4(3.6 ~5.0)μm;StKW(口针基球宽)=8.6±0.5(7.5 ~9.4)μm;DGO(背食道腺开口至口针基部球的距离)=5.3±0.3(4.8~5.7)μm;EP(排泄孔至头端距离)=127.3±5.4(120.7 ~133.6)μm;MEL(中食道球长度)=27.4±3.4(22.4~31.9)μm;MEW(中食道球宽度)=17.2±1.4(13.8 ~19.5)μm;OV(卵巢长)=110.1±15.8(92.6 ~132.8)μm;W(最大体宽)=42.7±4.9(34.2 ~51.4)μm;VBW(阴门处体宽)=29.4±3.6(23.9~36.0)μm;ABW(肛门处体宽)=25.8±3.0(20.5 ~30.6)μm;Tail(尾长)=25.5±2.3(21.2~30.3)μm;R(体环总数)=87.5±2.5(82.0 ~93.0);Rst(口针基球至头端的体环数)=13.7±0.8(12.0~15.0);Roes(食道基球末端至头端的体环数)=23.3±1.2(21.0 ~26.0);Rex(排泄孔至头端的体环数)=25.3±1.3(23.0 ~27.0);RV(阴门至虫体末端的体环数)=6.8±0.6(6.0~8.0);Ran(肛门至虫体末端体环数)=5.0±0.5(4.0~6.0);RVan(阴门至肛门的体环数)=1.8±0.4(1.0~2.0);a(体长/最大体宽)=11.8±1.3(9.1 ~14.3);b(体长/头端至食道与肠连接处的距离)=4.3±0.2(4.0~4.7);c(体长/尾长)=19.8±1.8(17.4 ~24.0);c′(尾长/肛门处体宽)=1.0±0.1(0.8 ~1.2);V/%(头端至阴门距离/体长×100)=92.7±0.8(91.3 ~94.2);St/%(口针长/体长×100)=11.0±1.0(9.4~13.9);Lv/VBW(头端至阴门的距离/阴门处体宽)=15.9±1.8(12.3~19.6);EP/%(排泄孔至头端距离/体长×100)=25.6±1.0(24.4~26.6)。
2.2.2 形态特征描述 雌虫:虫体粗大、圆筒形,死后体稍向腹面弯曲或僵直;体环后翻、光滑,体环数为82 ~93 条(图2A)。 口针长、强壮,针锥长约为针杆长的4 倍,基部球前缘突起、呈锚状,自基部球至头端的体环数为12 ~15 条;背食道腺开口到口针基部球的距离为4.8 ~5.7 μm;环型食道,中食道球强大、卵圆形,后食道球较小、梨形,食道腺与肠平截;排泄孔位于食道-肠瓣门后方,约为虫体自上而下的25%位置,至头端的体环数为23 ~27 条(图2B)。 前伸单生殖腺,卵巢长约为93~133 μm(图2C),受精囊椭圆形,充满精子。 阴门张开,位于虫体自上而下的93%位置,到尾端的体环数为6~8 条;肛门开口小,靠近阴门,与阴门隔1 ~2 个体环的距离;尾钝圆(图2D)。
雄虫:未见。
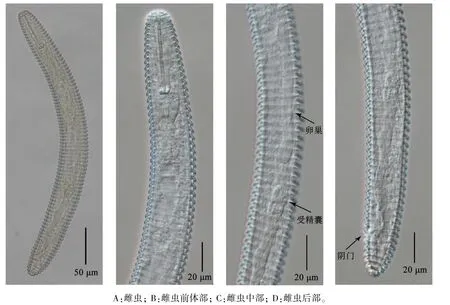
图2 装饰中环线虫的显微形态特征Figure 2 Morphological characteristics of M. ornata
2.3 病原线虫分子生物学鉴定
2.3.1 ITS 区扩增结果与序列比对 将采自花生上的环线虫的rDNA-ITS 区进行扩增,得到约为1 000 bp 的片段(图3);经测序,获得长度为1 022 bp 的序列。 同时,将该序列在BLAST 上比对分析,发现与其他环科线虫区别开来,序列同源性最高的是Criconemoides brevistylus,为94%;其次是Hemicriconemoides kanayaensis,序列相似性为83%。 由于同源性较低,无法确定该环线虫的种类。
2.3.2 D2D3 区扩增结果与序列比对 将环线虫的rDNA-D2D3 区进行扩增,得到约为750 bp的片段(图3);经测序,获得长度为769 bp 的序列。 同时,将该序列在BLAST 上比对分析,发现与Mesocriconema xenoplax的rDNA-D2D3 序列相似性最高,为99%。 由此可以得知,该环线虫与异盘中环线虫(M. xenoplax)同源性最高,可以将该环线虫确定为是中环属线虫。
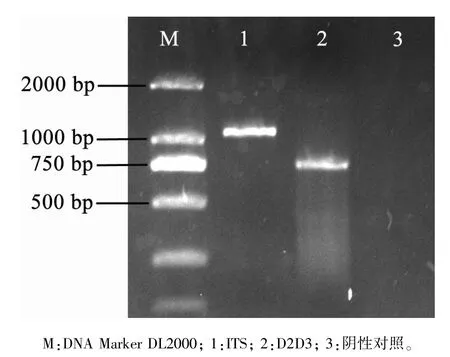
图3 装饰中环线虫PCR 产物电泳图Figure 3 PCR product amplified from ITS and D2D3 region of M. ornata
2.4 分类地位
综合形态学测量观察数据及分子生物学测定结果,同时与Nyczepiret al(1988)的描述比对,将本研究的花生环线虫鉴定为装饰中环线虫[Mesocriconema ornata(Raski) Luc & Raski]。
3 小结与讨论
在福建省宁德市的花生产区采集到的寄生线虫,会导致花生植株长势衰弱,叶色黄化。 对病根进行组织染色,可见线虫侵染取食根系。 对该病原线虫进行形态特征观察和测量,与装饰中环线虫的原始描述大体一致(Nyczepiret al,1988)。 在测序比对中,与该线虫的rDNA-ITS区序列同源性最高的只有94%;而与rDNA-D2D3 区序列同源性最高的达到99%。 由此可见,环线虫的rDNA-D2D3 区序列更适合作为其种类鉴定的依据之一。 本研究于福建省宁德市分离出该病原线虫,系我国首次较为完整的观察和记述装饰中环线虫侵染花生。 目前,福建省已有多个花生产区发现装饰中环线虫的侵害(章淑玲等,2012;李世通,2013),需引起有关部门的重视,及时采取相应的措施防控该病害的蔓延。
