钙蛋白酶1在瑞芬太尼诱发大鼠疼痛过敏中的作用
2019-12-20黄燕周楠
黄燕,周楠
(丽水市中心医院 麻醉科,浙江 丽水 323000)
瑞芬太尼为芬太尼类μ型阿片受体激动剂,由于其具有超短作用效应,临床上主要用于全麻诱导、全麻中维持镇痛或辅助麻醉[1-2]。但临床以及基础研究均报道瑞芬太尼可诱发人或大鼠痛觉过 敏[3-4]。因此,研究瑞芬太尼诱发痛觉过敏的信号机制,可为临床预防或减轻痛觉过敏提供理论依据。研究显示,痛觉过敏往往伴随腺苷酸环化酶激活、cAMP生成增加以及钙离子内流[5]。钙激活中性蛋白酶1(calcium-activated neutral protease,Calpain1或CANP1)是一种钙离子依赖性的半胱氨酸蛋白酶,其激活状态需要摩尔级别浓度的钙离子,因此也被称为μ-Calpain[6-7]。目前,CANP1与瑞芬太尼诱导的痛觉过敏间的关系鲜见报道。因此,本研究以瑞芬太尼诱导模型大鼠痛觉过敏,观察CANP1在其中的作用,为临床解决痛觉过敏提供基础理论支持。
1 材料和方法
1.1 材料
1.1.1 动物:清洁级(SPF)成年雄性SD大鼠100只,体质量220~260 g,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0006。每笼4只饲养于排气通风笼具中,12 h光照,12 h黑暗,自由饮水摄食,温度18~26 ℃,相对湿度40%~70%。
1.1.2 试剂:瑞芬太尼(湖北宜昌人福药业有限责任公司);U0126和Calpeptin(美国Sigma Aldrich公司);CAPN1抗体、ERK、p-ERK、GSK-3β、pGSK-3β抗 体、羊抗小鼠IgG-HRP抗体及羊抗兔IgG-HRP抗体(美国CST公司);GAPDH抗体(美国Bioworld公司);RIPA裂解液、BCA试剂盒(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 鞘内和尾静脉置管并筛选合格的大鼠:参照文献[8]方法进行尾静脉和鞘内置管。尾静脉置 管:腹腔注射10%水合氯醛350 mg/kg麻醉,在尾部中上l/3处以24号静脉置管,倒吸注射器有回血为置管成功,固定留置针,应用少量含肝素的0.9%氯化钠溶液冲洗留置针。鞘内置管:剪毛,消毒,腹腔注射10%水合氯醛350 mg/kg麻醉,切口并暴露L3-4间隙,逐层分离至黄韧带,轻挑开硬脊膜,将PE-10导管向尾侧插入2 cm,以少量含肝素的0.9%氯化钠溶液冲洗留置针,消毒,缝皮,再消毒,60 W白炽灯20 cm照射1~2 h,清醒,单笼饲养。挑选无运动障碍的大鼠于置管后2 d时鞘内注射2%利多卡因 10 μL,注药后30 s内出现双后肢麻痹的大鼠用于本研究。
1.2.2 建立切口痛模型大鼠:取置管合格的大鼠,参照文献[9]方法建立切口痛模型。右后足以75%乙醇擦拭干净,以手术刀从右后足足底后端约0.5 cm处向趾部做长约1 cm的纵行切口,保持肌肉起止和附着完整的前提下用眼科镊挑起足底肌肉并纵行分离至骨膜,缝合足底皮肤,术后伤口用碘伏消毒,并涂抹少量红霉素软膏预防感染。
1.2.3 分组:以尾静脉和鞘内置管合格的SD大鼠40只进行分组给药,设立对照组、瑞芬太尼组、瑞芬太尼+U0126组和瑞芬太尼+Calpeptin组,每组10只鼠。对照组鞘内注射5%二甲基亚砜10 μL,30 min后尾静脉输注0.9%氯化钠溶液0.1 mL·kg-1·min-1,输注时间60 min;瑞芬太尼组鞘内注射5%二甲基亚砜10 μL, 30 min后尾静脉输注瑞芬太尼1 μg·kg-1·min-1,持续时间60 min;瑞芬太尼+U0126组鞘内以注射含 5 μg U0126的5%二甲基亚砜10 μL预处理30 min,尾静脉输注60 min瑞芬太尼1 μg·kg-1·min-1;瑞芬太尼+Calpeptin组鞘内以注射含5 μg Calpeptin的5%二甲基亚砜10 μL预处理30 min,尾静脉输注60 min瑞芬太尼1 μg·kg-1·min-1。
1.2.4 机械缩足反应阈(mechanical withdrawal threshold,MWT)和热缩足潜伏期(thermal withdrawal latency,TWL)检测:分别于尾静脉输注前24 h(T0)、尾静脉输注后2 h(T1)、6 h(T2)、24 h(T3)和48 h(T4)时,在温度为18~25 ℃的安静环境中测定MWT和TWL。将大鼠置于15 cm×20 cm× 15 cm的金属笼内并适应环境10 min,以von Frey 纤维丝垂直施加压力,刺激右后足第二和第三趾骨间,模型大鼠出现快速缩足反应、舔足或嘶叫时停止加压,记录此时压力,每只大鼠测定3 次,间隔 10 min,3次均值即为本次MWT,其中为防止大鼠足底损伤,将最大压力设为60 g。以热板仪测定大鼠右后足TWL,大鼠右后足接触热板后出现缩足、踮足、嘶叫及舐足中的任一反应时记录时间,每只大鼠测定3次,间隔10 min,3次均值即为本次TWL,其中为防止大鼠烫伤,测试上限设为25 s。
1.2.5 Western blot检测:检测T4时模型大鼠MWT和TWL结束后处死动物,取脊髓L4-6节段加入冰的组织蛋白裂解液(使用前20 min加蛋白酶抑制剂,使其终浓度为1 mmol·L-1),于均质仪上匀浆,5.00 m/s 20 s,然后在4 ℃、20 627×g离心15 min。取样品上清液留用,采用BCA试剂盒进行蛋白定量并制样。进行Western blot检测时,每个泳道按30 μg蛋白质样品进行上样,SDS-PAGE电泳分离蛋白,然后将分离蛋白电转移至硝酸纤维膜上;5%脱脂牛奶室温封闭1 h后,以TBST缓冲液洗膜3次,每次10 min;然 后按要求加入CAPN1抗体(1:2 000)、ERK抗体(1: 2 000)、p-ERK抗体(1:1 000)、GSK-3β抗体(1:1 000)、pGSK-3β(1:1 000)室温杂交1~2 h或4 ℃温育过夜。一抗处理后,TBST洗膜3次,再加入相应的辣根过氧化物酶标记二抗(1:4 000),室温杂交1 h,PVDF膜以化学发光试剂盒进行显色,凝胶成像仪进行成像,以Quantity One对蛋白印迹条带进行处理和分析,CANP1、GSK定量以内参GAPDH校正,p-ERK以ERK校正,pGSK-3β以GSK-3β校正。
1.3 统计学处理方法 采用SPSS17.0统计软件进行分析。计量资料用表示,多组比较用单因素方差分析,组间两两比较用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组T0~T4时间点MWT比较 与对照组比,T1~ T4瑞芬太尼组大鼠MWT均降低,差异具有统计学意义(P<0.01);与瑞芬太尼组比,T1~T4瑞芬太尼+ U0126组和瑞芬太尼+Calpeptin组MWT均升高,差异具有统计学意义(P<0.05或P<0.01),见图1。
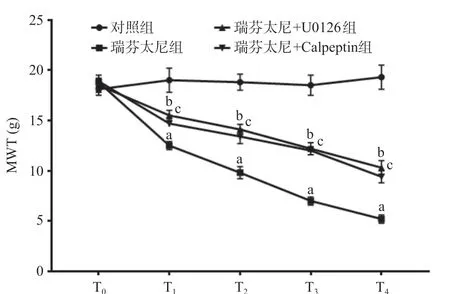
图1 各组T0~T4时间点MWT比较
2.2 各组T0~T4时间点TWL比较 与对照组比,T1~ T4时间点瑞芬太尼组大鼠TWL均降低,差异具有统计学意义(P<0.01);与瑞芬太尼组比,T1~T4时间点瑞芬太尼+U0126组和瑞芬太尼+Calpeptin组各时间点TWL均升高,差异具有统计学意义(P<0.01),见图2。
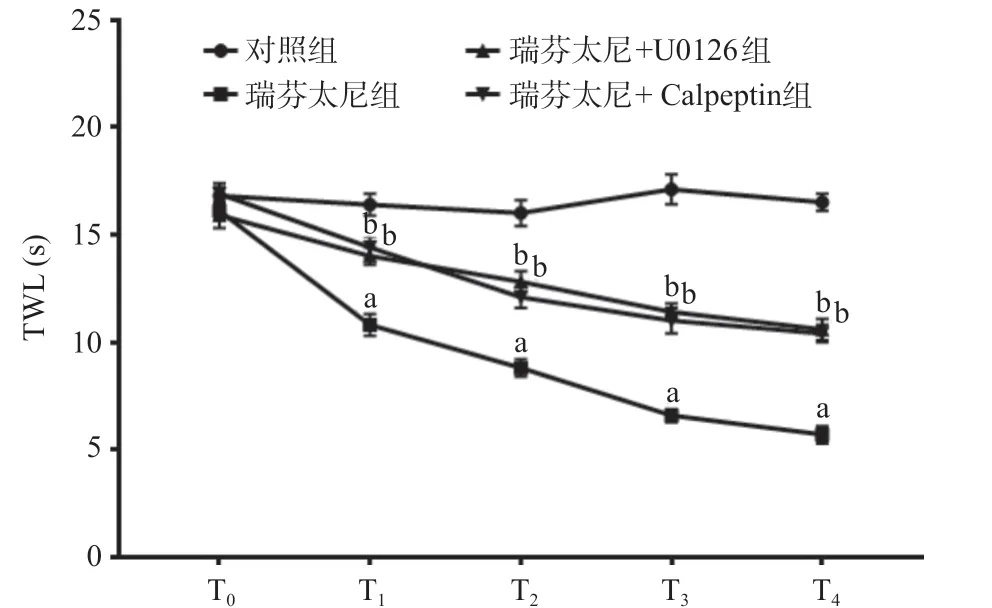
图2 各组T0~T4时间点TWL比较
2.3 各组CANP1和p-ERK蛋白表达比较 给药后48 h 与对照组比,瑞芬太尼组大鼠p-ERK蛋白表达明显上调,差异有统计学意义(P<0.01);而与瑞芬太尼组比,瑞芬太尼+U0126组p-ERK蛋白表达明显下调,差异有统计学意义(P<0.01)。与对照组比,瑞芬太尼组Cleaved-CANP1明显上调,差异有统计学意义(P<0.01);而与瑞芬太尼组比,瑞芬太尼+U0126和 瑞芬太尼+Calpeptin组Cleaved-CANP1明显减少,差 异有统计学意义(P<0.01)。见图3。
2.4 各组动物GSK-3β和pGSK-3β蛋白表达变化 给药后48 h与对照组相比,瑞芬太尼组大鼠GSK-3β表达明显上调,差异有统计学意义(P<0.01);而与瑞芬太尼组比,瑞芬太尼+U0126组和瑞芬太尼+ Calpeptin组GSK-3β表达明显下调,差异有统计学意义(P<0.01)。与对照组比,瑞芬太尼大鼠pGSK-3β表达明显上调,差异有统计学意义(P<0.01);而与瑞芬太尼组比,瑞芬太尼+U0126组和瑞芬太尼+ Calpeptin组pGSK-3β表达明显下调,差异有统计学意义(P<0.01),见图4。

图3 给药后48 h各组CANP1和p-ERK蛋白表达变化
3 讨论
痛觉过敏是指使用阿片类受体激动药物所引起的痛觉阈值降低,从而对疼痛敏感性增强的现 象[10]。瑞芬太尼是临床手术麻醉常用的阿片类受体激动药物,可诱导痛觉过敏[3-4]。因此,防治痛觉过敏是减轻患者术后疼痛的关键。本研究以大鼠建立足部切口痛模型和尾静脉注射瑞芬太尼,发现大鼠手术侧足部MWT降低,TWL缩短,提示瑞芬太尼诱导了切口痛模型大鼠痛觉过敏。鞘内注射U0126或Calpeptin预处理后显著抑制了瑞芬太尼对模型鼠MWT和TWL的影响。U0126是MEK1/2的高效抑制剂,可抑制后者下游信号ERK1/2的活性[11]。而Calpeptin 为CANP广谱抑制剂,能有效抑制CANP的活化[12]。提示,ERK1/2和CANP可能均参与了瑞芬太尼诱导的痛觉过敏。

图4 给药后48 h各组GSK-3β和pGSK-3β蛋白表达变化
为确证上述提示,本研究进一步观察了脊髓中ERK磷酸化水平以及CANP1蛋白表达变化。结果显 示,瑞芬太尼组大鼠p-ERK表达显著增加,CANP1(大亚基)蛋白自身水解表达增加,而U0126和Calpeptin 均能抑制上述效应。研究报道瑞芬太尼诱导大鼠痛觉过敏与脊髓GSK-3β活性增强有关[13]。因此本研究同时观察了GSK-3β在其中的表达变化,结果发现瑞芬太尼组大鼠GSK-3β及pGSK-3β表达均显著增强,U0126和Calpeptin预处理可阻断上述效应。这些提示瑞芬太尼可能通过ERK的磷酸化和CANP1的蛋白水解上调GSK-3β并促进GSK-3β磷酸化水平从而诱导模型大鼠痛觉过敏。研究显示ERK为CANP1的上游信号靶点,参与CANP1的活化[14]。综上提示,瑞芬太尼诱导大鼠疼痛过敏与激活ERK/CANP1/GSK-3β信号通路有关。干预ERK/CANP1/GSK-3β信号激活可能是防治瑞芬太尼诱导痛觉过敏的方法之一,但本研究为基础研究,还有待于进一步临床试验验证。
