硅藻粘附性EPS提取方法的比较研究
2019-12-19于兆伟谢雅清张珮璇孙陈炼靳翠丽周晓见
于兆伟,谢雅清,张珮璇,鲍 金,孙陈炼,靳翠丽,2,周晓见,2
(1.扬州大学环境科学与工程学院,江苏 扬州 225127; 2.扬州大学海洋科学与技术研究所,江苏 扬州 225127)
海洋生物污损(biofouling)指的是在海水浸泡中的无特殊保护的船底、码头、浮标和各类水下人工设施的表面上常常发生大量海洋生物聚集的现象[1]。生物污损在海洋运输、军事安全、海洋水产养殖、近岸海洋资源利用、海洋科学研究与海洋工程等方面危害严重,每年在全球范围内由海洋生物污损造成的经济损失高达200亿美元[2]。生物污损不仅包括大型藻类和海洋无脊椎动物如藤壶(Amphibalanusamphitrite)、贻贝(Mytilusedulis)等造成的污损,还包括由细菌和硅藻形成的生物膜[3]。生物膜除了造成设备孔道堵塞、表面粗糙、金属腐蚀等问题,还为后续的污损生物附着提供支撑,影响大型污损生物的附着和后续生长,最终导致复杂的污损生物群落的形成[4-5]。在水下可见光照射范围内,硅藻是生物膜的主体。与细菌相比,硅藻对水下表面的附着覆盖面更广泛,附着强度更大、更顽固[6-8]。
硅藻附着离不开硅藻向细胞外大量分泌的胞外多聚物(Extracellular Polymeric Substances,EPS),EPS最主要的成分是糖和蛋白质。EPS直接影响生物膜的形成过程、垂直结构以及稳定性等多个方面[4]。按照与硅藻细胞结合的紧密程度,可将EPS分为两大类:可溶性EPS(Soluble EPS,SL-EPS)和粘附性EPS(Bound EPS,B-EPS)两部分[9-11]。不同类的EPS成分组成也不尽相同,生理功能也有差异,因此往往对这两类EPS分别进行分离提取。溶解在水中的SL-EPS一般均可以通过高速离心分离藻细胞后获得,该分离提取方法在目前的研究中较为一致。而B-EPS 是和藻细胞紧密粘附的,不能通过简单离心的方法获得,目前使用的分离方式多种多样,并没有形成统一的分离方法。目前使用的分离提取B-EPS 的方法有物理方法和化学方法两大类[12]。前者主要有超声提取法、热提取法、阳离子交换树脂法、超声-阳离子交换树脂法等;后者主要有硫酸提取法、氢氧化钠提取法、福尔马林-NaOH提取法、EDTA法和戊二醛法等。本研究选取了其中几种分离提取效率较高的方法,提取典型污损硅藻双眉藻(Amphorasp.)的EPS,比较EPS主要成分的提取量和EPS总量,为硅藻EPS的相关研究提供合适的分离提取方法。
1 材料与方法
1.1 实验藻种与培养
实验所研究的硅藻双眉藻(Amphorasp.)由扬州大学海洋科学与技术研究所提供。
使用含硅的f/2培养液培养双眉藻,按100 cm3培养液接种10 cm3藻液的比例接种,细胞初始密度为7.1×104cells/cm3。 FHI-2010HT型光照培养箱中培养,温度为23±2℃,光照强度5 000 lx,光暗比12 h∶12 h条件下,培养21 d得到密度为8.11×105cells/cm3的藻液。培养结束,将藻液彻底混匀后形成悬浊液。
1.2 EPS提取方法
1.2.1 离心处理提取SL-EPS 在无菌操作台中,在离心管中加入10 cm3混匀后的藻液。将藻液在4 000 r/min离心10 min,收集上清液,即得到SL-EPS。每组处理设置3个平行。所有提取得到的样品置于-20℃冰箱内待测。
对离心得到的藻细胞沉淀分别用4种方法进行处理,以提取B-EPS。并且在各B-EPS处理过程中,均使B-EPS提取液的体积等于原始藻液体积。
1.2.2 30℃水浴处理提取B-EPS 向藻细胞沉淀加入10 cm3纯水,充分混匀,30℃下水浴1 h。冷却至室温再在4 000 r/min离心15 min,收集上清液,即得到B-EPS[12]。
1.2.3 70℃水浴处理提取B-EPS 向藻细胞沉淀加入10 cm3磷酸盐缓冲液(0.1 mmol/cm3,pH=7.5)。室温下静置20 min,70℃水浴1 h。冷却至室温,再在4 000 r/min离心15 min,收集上清液,即得到B-EPS[13]。
1.2.4 福尔马林-NaOH处理提取B-EPS 向藻细胞沉淀加入0.05%的NaCl溶液10 cm3,充分摇匀后静置5 min,再加入37%的福尔马林0.06 cm3,室温下用恒温磁力搅拌器搅拌(转速900 r/min)1 h,再加入1 mmol/cm3NaOH溶液4 cm3,继续搅拌(转速900 r/min)3 h。在4 000 r/min离心15 min,收集上清液,即得到B-EPS[14]。
1.2.5 阳离子交换树脂处理提取B-EPS 向藻细胞沉淀加入10 cm3含有2 nmol/cm3Na3PO4、4 mmol/cm3NaH2PO4、9 nmol/cm3NaCl、1 nmol/cm3KCl的缓冲溶液(pH为7.0),静置20 min。按照树脂:藻沉淀为70∶1(质量比)加入阳离子交换树脂。在恒温磁力搅拌器上搅拌16 h(转速900 r/min),抽滤(滤膜孔径为0.45 μm)去除阳离子交换树脂和藻细胞,收集滤液即得到B-EPS[14]。
1.3 EPS中各成分含量测定方法
采用考马斯亮蓝染色法测量样品中的蛋白质含量[15],硫酸-苯酚法测量总糖含量[16],硫酸钡比浊法测量硫酸基含量[17],硫酸-咔唑法测量糖醛酸含量[18]。DNA含量使用NANODROP 2000超微量紫外分光光度计检测获得。将测得的蛋白质、总糖、硫酸基、糖醛酸和DNA的总和作为提取得到的EPS总量。
各成分和EPS浓度均按照原始藻液体积进行浓度换算。
1.4 数据处理
本实验每组处理均设置3个平行,所获得的数据采用IBM SPSS 22.0软件分析。对于方差分析显著性的因素,利用Dunnett’s T3进行多重比较,各分析指标差异显著性以p=0.05或0.01为标准。
2 结果与讨论
2.1 水溶性SL-EPS的组成成分
如表1所示,提取获得的水溶性SL-EPS溶液中,不仅含有0.208 mg/cm3蛋白质、0.115 mg/cm3总糖,而且含有的硫酸基也非常丰富,达到0.266 mg/cm3。此外还含有糖醛酸和少量DNA,含量分别为0.046 mg/cm3和0.009 mg/cm3。从占比上看, SL-EPS中硫酸基含量丰富,达到了41.3%;其次是蛋白质,占比为32.3%;总糖占比为17.9%;糖醛酸占比为7.1%;还含有极少量的DNA。
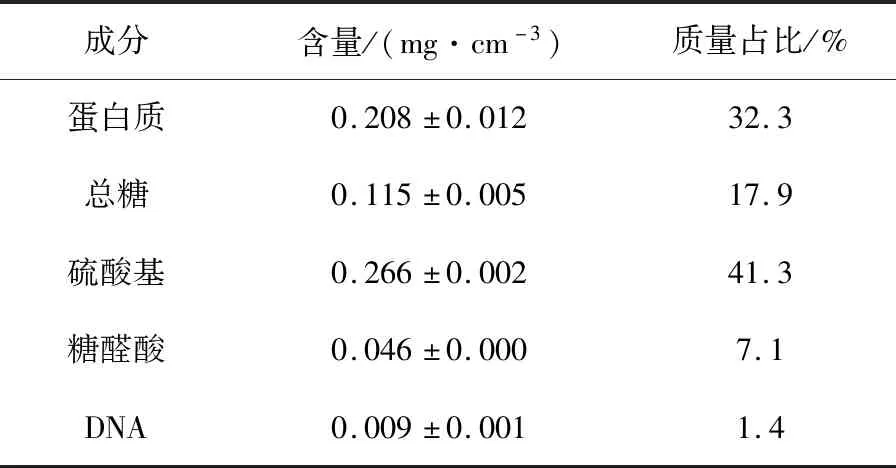
表1 双眉藻SL-EPS中各成分的含量Tab.1 Contents of each components in SL-EPS from Amphora sp. cells
2.2 不同处理方法对提取B-EPS中蛋白质含量的影响
对双眉藻的B-EPS进行4种不同的处理,提取得到B-EPS中的蛋白质含量如图1所示(图中大写字母代表显著性p≤0.01,小写字母代表显著性p≤0.05[19])。其中70℃水浴处理效率最高,提取到的蛋白质含量达到了0.044 mg/cm3;阳离子交换树脂处理其次,提取到的蛋白质含量为0.035 mg/cm3;福尔马林-NaOH处理提取到的蛋白质较少,含量为0.023 mg/cm3; 30℃水浴处理提取效率最低,远低于其它3组,蛋白质含量仅为0.008 mg/cm3,不足70℃水浴处理的1/5。不同处理提取到的蛋白质的含量存在极显著差异。
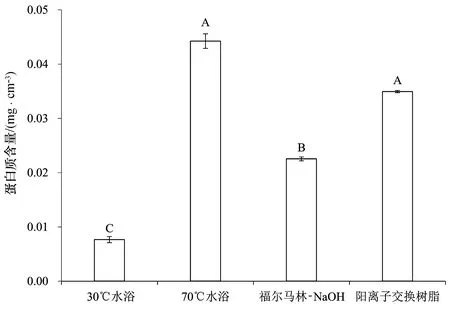
图1 不同处理方法提取的双眉藻B-EPS中蛋白质含量Fig.1 Protein contents in B-EPS extracted from Amphora sp. cells by different treatments 图中大写字母代表显著性p≤0.01,小写字母代表显著性p≤0.05;下同。
2.3 不同处理方法对提取B-EPS中总糖含量的影响
从图2可以看到,福尔马林-NaOH处理提取到的总糖含量最高,为0.170 mg/cm3,显著高于其它方法;70℃水浴处理和阳离子交换树脂处理区别不大,提取总糖的含量都低于福尔马林-NaOH处理。提取总糖效率最低的为30℃水浴处理,含量为0.019 mg/cm3,是福尔马林-NaOH处理提取量的1/10左右,也显著低于70℃水浴处理和阳离子交换树脂处理。

图2 不同处理方法提取的双眉藻B-EPS中总糖含量Fig.2 Total sugar contents in B-EPS extracted from Amphora sp. cells by different treatments
2.4 不同处理方法对提取B-EPS中硫酸基含量的影响
不同处理方法对硫酸基的提取量也有一些影响(图3),阳离子交换树脂处理的提取效率比其它方法略低,获得的硫酸基浓度为0.228 mg/cm3。30℃水浴处理提取到的硫酸基的含量最高,为0.386 mg/cm3,是阳离子交换树脂处理的1.7倍。70℃水浴、福尔马林-NaOH处理的硫酸基含量与30℃水浴处理差别不大。

图3 不同处理方法提取的双眉藻B-EPS中硫酸基含量Fig.3 Sulfate contents in B-EPS extracted from Amphora sp. cells by different treatments
2.5 不同处理方法对提取B-EPS中糖醛酸的影响
从图4中可以发现,4种方法中最适合提取糖醛酸的是福尔马林-NaOH处理,得到的糖醛酸的含量为0.138 mg/cm3,显著高于其它3组。30℃水浴处理提取的糖醛酸最少,为0.009 mg/cm3,只是福尔马林-NaOH处理的1/15。70℃水浴与阳离子交换树脂处理提取效率也不高,提取的糖醛酸浓度相似,分别为0.018 mg/cm3和0.021 mg/cm3。
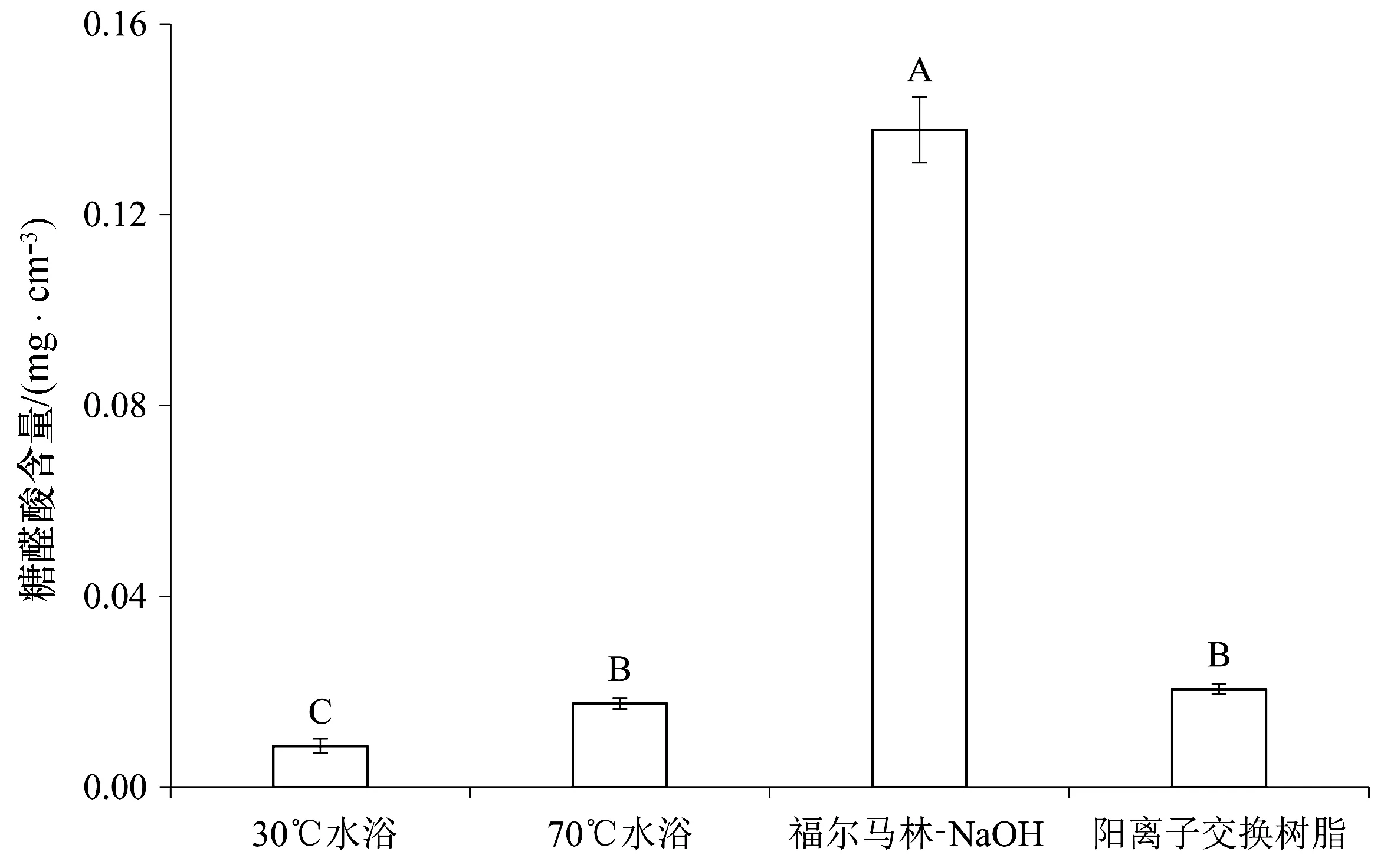
图4 不同处理方法提取的双眉藻B-EPS中糖醛酸含量Fig.4 Uronic acid contents in B-EPS extracted from Amphora sp. cells by different treatments
2.6 不同处理方法对提取B-EPS中DNA含量的影响
从图5可以看出,使用阳离子交换树脂提取得到的DNA含量远远超出其它3组,达到了0.132 mg/cm3,而30℃水浴处理提取到的DNA含量最低,只有0.001 mg/cm3,是阳离子交换树脂处理的1/132。70℃水浴处理与福尔马林-NaOH处理得到的DNA含量也不高,分别为0.004 mg/cm3和0.003 mg/cm3。

图5 不同处理方法提取的双眉藻B-EPS中DNA含量Fig.5 DNA contents in B-EPS extracted from Amphora sp. cells by different treatments
2.7 不同处理方法对提取B-EPS总量的影响
从4种方法提取到的B-EPS总量来看(图6),福尔马林-NaOH处理得到B-EPS总量最多,达到0.647 mg/cm3,优于阳离子交换树脂法,30℃和70℃水浴的处理方法得到的B-EPS总量区别不大。
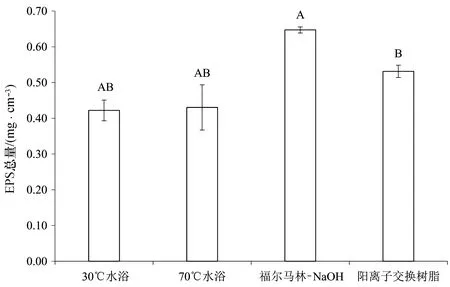
图6 不同处理方法提取的双眉藻B-EPS的总量Fig.6 Total amount of B-EPS extracted from Amphora sp. cells by different treatments
2.8 讨论
硅藻双眉藻(Amphorasp.)的EPS可分为水溶性SL-EPS和粘附性B-EPS两部分。SL-EPS中硫酸基含量最丰富,其次是蛋白质、总糖以及糖醛酸,还含有少量的DNA。粘附性B-EPS中同样含有上述各成分,总体上看各成分含量按从高到低的顺序依次为:硫酸基、总糖、蛋白质、糖醛酸以及少量DNA。不同的提取方法对于B-EPS中各成分的提取效率总体上差异显著。各成分提取效率普遍受提取方法的影响,其中DNA含量变化幅度最大,如阳离子交换树脂处理使DNA含量剧增达数百倍,提示此方法可能造成了严重的细胞破裂,使细胞核的DNA渗漏到胞外造成DNA含量严重偏高。不论SL-EPS和各方法提取的B-EPS中均出现一定量的DNA,说明EPS提取物中存在少量DNA属于正常现象,但过高DNA含量则说明胞内物质的渗漏溶出[12-14]。蛋白质、总糖和糖醛酸含量由于提取方法的不同,会有5~10倍的差别,硫酸基含量也出现了翻倍的情况。
采用物理方法分离B-EPS的测试中,热处理和阳离子交换树脂这两种方法用的比较多。其中,热处理方法通过提升体系的温度,提高了B-EPS各成分在水中的溶解度,并通过后续的高速离心处理,进一步增加B-EPS在水中的溶解度,从而达到分离B-EPS的目的[20]。因此,B-EPS的提取效率与温度密切相关。当温度较低时,B-EPS的分离效率十分有限,因此30℃处理提取的B-EPS各成分普遍低于其他方法提取的对应成分,以蛋白质为例,30℃水浴提取到蛋白质浓度为0.008 mg/cm3,不足最高组0.044 mg/cm3的1/5;30℃水浴提取到的总糖浓度为0.019 mg/cm3,只占最高组0.170 mg/cm3的1/10左右;而在温度过高时,有可能导致蛋白质、核酸以及酶的变性,会对B-EPS成分的进一步分析造成不利影响,是需要注意的问题[21]。另外,由于长时间的热处理还可能带来胞内物质的溶出,目前热处理的方法大多采用较短时间(如1 h)的加热溶解[12-13]。实际上,B-EPS的提取效率应可能是处理温度和处理时间共同作用的效果,但关于处理时间方面的研究尚未有深入的报道。
EPS能与许多金属离子(例如Ca2+、Mg2+等)螯合形成单价、双价、多价阳离子与EPS阴离子相结合的复合物。多价阳离子通过静电交联作用,维持EPS中总糖和蛋白质之间链接的稳定性,而阳离子交换树脂在溶液中可解离出氢离子(H+),与溶液中的金属离子或其他阳离子基团发生相互交换作用,具有去除二价阳离子的功能,使得加入阳离子交换树脂的体系中EPS的基质变得不稳定,导致EPS更容易从细胞膜上剥离[22]。另外,通过调节磁力搅拌器的转速使水流产生紊流运动,流体质点的不规则运动产生剪切力。这些因素都有助于EPS从藻细胞表面的剥离[22-23]。本研究中阳离子交换树脂的使用量为70 g/1 g(树脂重量/藻沉淀重量),恒温磁力搅拌器转速为900 r/min,提取时间为16h。此方法提取到的EPS总量居于第2位,其中蛋白质0.035 mg/cm3,按浓度由高到低排第2位;提取到总糖浓度为0.115 mg/cm3,按浓度由高到低排第2位,但是对于硫酸基和糖醛酸的提取效果不佳,提取到硫酸基0.229 mg/cm3,浓度是4种方法中最低的;提取到糖醛酸浓度为0.021 mg/cm3,远低于浓度最高组的0.138 mg/cm3,而且细胞破碎的情况比较严重,DNA含量剧增。同时,DNA含量的剧增也提示在此B-EPS提取条件下,其它胞内物质也存在渗漏至B-EPS提取物中的可能,干扰后续EPS相关研究结果。实际上,阳离子交换树脂的提取效果受多种因素的影响,提取效率以及细胞的破裂程度受树脂的提取时间以及使用量的影响,还受水流剪切力(搅拌器转速、溶液深度、转子及容器大小等)的影响。树脂用量低,提取效率不高,使用量过高则可能会对细胞造成严重影响;提取时间过长有可能造成严重的细胞破碎;水流剪切力越大,EPS从细胞剥离越彻底但是细胞破碎也越严重[24-25]。因此阳离子交换树脂法提取B-EPS时的条件应包括树脂使用量、提取时间、提取搅拌情况等,仍需要更多的实验进行探索、确定。
化学方法中采用的是福尔马林-NaOH处理,福尔马林通过和蛋白质中的胺基、羟基等基团及细胞膜中的核酸相互作用来固定细胞,从而达到抑制细胞消解的作用,以减少对分离B-EPS产生的干扰。EPS含有的羟基、羧基等多种有机官能团在溶液中呈负电荷性,添加适量的NaOH,提高了B-EPS内酸性基团的解离,增强了本身带负电的EPS之间的排斥,并增加了B-EPS在水中的溶解度,从而提高B-EPS的分离效率[26]。本研究中,福尔马林-NaOH处理取得了良好的提取效果,提取到的EPS总量最高,其中提取到的总糖和糖醛酸浓度最高;硫酸基排在第2位;但提取蛋白质的效率不是最高;从DNA的含量上看,福尔马林-NaOH处理方法并没有造成严重的细胞破裂。
3 结论
EPS提取方法的不同对于EPS各成分的提取效率会造成严重影响[14]。对文献中提取效果较好的4种B-EPS提取方法进行比较。综合4种方法提取硅藻B-EPS的效果来看,阳离子交换树脂容易导致严重的细胞破坏;低温水浴处理的EPS提取方法效率太低;较高的温度水浴处理可能会导致蛋白质、核酸和酶等物质的变性,不利于EPS成分的后续分析;福尔马林-NaOH的处理方法提取效果良好,且不会造成严重的细胞破裂。比较这4种文献报道的EPS提取方法,为研究硅藻EPS时提供参考。就典型污损硅藻Amphorasp.而言,福尔马林-NaOH处理的方法是一种相对均衡和高效的硅藻细胞B-EPS的提取方法。
