Lrp家族转录调控因子的研究进展
2019-12-19柯美兰张部昌
柯美兰, 吴 杭, 张部昌
(1. 安徽大学 生命科学学院; 2. 安徽大学 物质科学与信息技术研究院, 合肥 230601)
亮氨酸应答调控蛋白(Leucine responsive regulatory protein, Lrp)广泛分布于细菌和古细菌中,如常见的大肠杆菌、恶臭假单胞菌和一些致病性病原菌(创伤弧菌)等;放线菌中的谷氨酸棒状杆菌、结核分枝杆菌和抗生素产生菌等;古生菌中的嗜热菌、硫化叶菌、甲烷球菌和嗜盐菌等。截至目前,已报道的Lrp情况见表1。在现有真核生物基因组中,没有发现Lrp同源蛋白[1]。
大肠杆菌Lrp(EcoLrp)能够调控体内大约400多个基因的转录和表达,既能正调控涉及氨基酸生物合成、菌毛生物合成和氨同化的操纵子,也可以负调控参与氨基酸分解代谢和肽转运[2]。大肠杆菌的天冬酰胺合成酶C(Asparagine synthetase C, AsnC)蛋白通过激活临近天冬酰胺合成酶A基因(asnA)的转录和自我调节调控体内天冬酰胺的生物合成。天冬酰胺的存在可以消除这种激活作用,但并不影响AsnC的自我调节[3]。因两者是同源的调控蛋白,且已有文献将Lrp和AsnC蛋白放在一起描述,故又称为Lrp/AsnC家族调控因子[4]。Lrp既可作为全局转录调控因子[2],也可发挥局部调控作用[3]。Lrp还能作为富足/饥饿调控蛋白[5-6],根据环境中营养的丰度调节氨基酸的代谢。当环境中营养丰富时,Lrp能降低氨基酸的合成;当处于营养贫乏的环境时,能够刺激氨基酸的合成[2]。
随着研究者对各族转录调控因子研究的进一步加深,Lrp家族得到了更多关注。本文综述了 Lrp家族转录调控因子的研究进展,以期能够为后续研究Lrp提供参考。

表1 已报道Lrp的分布情况
1 基本结构特征
Lrp蛋白单体分子量在15~18 ku之间,主要由N末端DNA结合结构域和C末端配体结合结构域组成(如图1)[30]。DNA结合结构域能够特异性识别并结合靶DNA,包含保守的螺旋-转角-螺旋(HTH)结构。通过基因组序列比对发现古生菌中通过结合DNA来影响基因表达的调控蛋白大多都具有HTH结构,而且类似细菌中HTH的结构基序[31]。配体结合结构域,也称为氨基酸代谢调控(Regulation of amino acid metabolism,RAM)结构域,可响应配体氨基酸。RAM结构域是典型的αβ-三明治结构,可以促进配体结合和蛋白寡聚化[5-6, 22, 32]。Lrp蛋白最小的功能结构单元是二聚体。两个单体蛋白C末端结构域的β链相互作用,形成具有一个稳定疏水中心的二聚体蛋白,进而形成四聚体、六聚体、八聚体或十六聚体(如图1)[33]。尽管Lrp同源蛋白之间的氨基酸序列相似性很低,但在已知Lrp晶体结构中,存在保守性的空间结构[13, 34]。
2 配体以及应答方式
2.1 Lrp的配体
最早发现EcoLrp的配体是Leu[7, 35]和应答程度较小的Ala[36-37]。随后发现Lrp还能应答Arg、Gln、His、Lys、Met、Phe、Pro、Thr、Trp、Tyr、Val、Asp、Ile、Glu等氨基酸[19](见表2)。结核分枝杆菌RV3291c可响应Leu、Met、Ile、His和Thr[38]。脑膜炎奈瑟球菌NMB0573可应答Leu和Met[11]。嗜盐杆菌LrpA1仅应答Asp[27]。古细菌中只有RAM结构域的DM1蛋白被证实除了对氨基酸响应外还能与2-酮戊二酸结合[5]。本实验室研究发现Lys和Arg可以降低糖多孢红霉菌Lrp(SACE_Lrp)对靶DNA的结合亲和力,而His则增强。这表明SACE_Lrp 可以通过响应氨基酸调节蛋白对DNA的结合活性[18],这是首次被解析可以双向响应配体的Lrp。最近发现小分子维生素B1、B3、B6、VC 等和四氢喹啉衍生物也可以作为Lrp的配体[14, 39]。
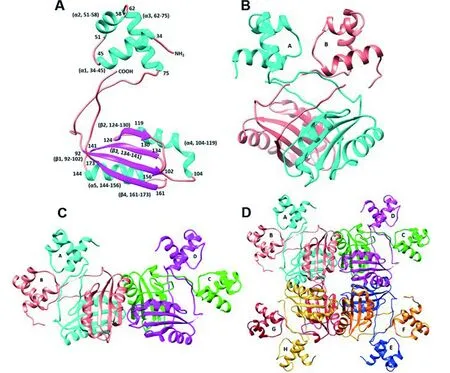
A:单体 Monomer; B:二聚体 Dimer; C:四聚体 Tetramer; D:八聚体Octamer
图1 Lrp蛋白的结构[14]
Figure 1 Structure of Lrp protein

表2 Lrp应答不同种类的配体小分子
2.2 Lrp应答配体的方式
配体结合会导致Lrp蛋白构象变化[40]。Lrp在存在效应分子时,会通过结构微调来调节其DNA结合活性,从而将信号转化成应答[38]。目前有3种变化方式:
1)DNA结合结构域附近微妙变化[41]。氨基酸结合改变了DNA结合域的相对空间分布,从而破坏了蛋白质-DNA复合物[14]。

O1-O4为MtbAldR靶位点;两个相邻靶位点之间的数字表示位点序列中心T核苷酸(序列未列出)之间的距离
图2“开放”和“封闭”的八聚体MtbAldR结合ald基因上游的多个靶位点[14]
Figure 2 “Open”and “closed” octamer MtbAldR binding to multiple target sites upstream ofaldgene
2)蛋白构象变化[14, 20]。“封闭”的四级结构对DNA结合域的调整或改变较小,而“开放”的结构可以使它们能够结合到更多(20-40)碱基分隔的靶DNA位点上。如FL11与Lys结合时,形成一个“封闭”的八聚体,而与Arg结合,能使八聚体变成开环构象[20];Dey等发现MtbAldR的洗脱液中存在Ala、Asp和Phe时,蛋白质的洗脱峰会出现轻微左移,推测是因为效应分子使蛋白出现“开放”或者“闭合”的结构[14]。在透射电子显微镜下观察到MtbAldR在Ala存在的情况下采用“开放”的四级结构,推测可能是因为ald基因上游存在多个靶位点需要蛋白结合[14](如图2)。
3)蛋白寡聚体形式变化[5-6, 22, 32]。如EcoLrp与Leu结合使其从十六聚体转变成八聚体[35];Dey等还发现MtbAldR的蛋白洗脱液中含有不同浓度的Ala时,MtbAldR以六聚体、七聚体、八聚体和十聚体等形式被洗脱下来[14]。
3 调控机制
Lrp蛋白既可以正调控靶基因的转录,也可以负调控靶基因的转录,甚至可以发挥双重地激活或者抑制作用[2, 30, 42]。如硫磺矿硫化叶菌Ss-LrpB依据蛋白浓度双重调节自身基因的转录,低浓度时促进基因的表达,高蛋白浓度则会抑制自身基因的转录[25, 43]。
根据已有的研究报道,Lrp调控机制总结为两种。1)通过DNA结合结构域直接结合并调控靶基因;2)与其他调控因子或蛋白协同发挥调控作用。
大多数细菌Lrp通过直接与靶基因启动子区结合调控靶基因的转录表达[11]。古细菌Lrp家族转录调控子的DNA结合结构域虽与细菌相似,但其转录机制却类似真核生物[31],基因的转录起始需要转录起始复合物(TATA结合蛋白和其他转录因子)协同RNA聚合酶[44],所以古生菌中Lrp蛋白发挥调控作用不是直接由蛋白结合靶基因启动子区而实现的。嗜热古生菌的LrpA可以与TATA盒的下游序列结合,通过空间位阻阻断RNA聚合酶结合转录起始位点,导致其无法正常地起始转录[25, 45]。硫磺矿硫化叶菌中的Lrs14也是通过空间位阻效应阻断TATA结合蛋白(TATA-binding protein, TBP)、转录因子B(Transcription factor B, TFB)与TATA盒(TATA box)、B因子识别元件(Factor B recognition element, BRE)结合,从而发挥负向调节作用[25-26]。进一步研究还发现EcoLrp可以与其他全局性调控因子,如cAMP受体蛋白、整合宿主因子、组蛋白样蛋白H-NS等,通过蛋白互作共同发挥调控作用[1]。有趣的是,嗜盐杆菌中两个Lrp可能选择类似细菌中不同的sigma因子辅助调控不同的启动子[27],如Lrp 激活tfbF,LrpA1 抑制tfbB。
4 调控功能
早期研究发现Lrp参与调控氨基酸的代谢,随着研究进一步深入,发现Lrp还可调控菌毛生成、抗生素的生物合成、重金属和多肽的转运、ATP代谢等其他生理过程,具有多样化的调控功能。新的研究发现Lrp还可调控致病菌的毒性强弱。以下主要介绍细菌与古生菌中Lrp的多种生物学功能。
4.1 Lrp在细菌中的调控功能
起初,Anderson等发现EcoLrp蛋白能够影响分支氨基酸转运[46]。随着研究深入,发现EcoLrp不仅能影响氨基酸代谢,还能影响菌毛生成[1]。恶臭假单胞菌Lrp家族同源蛋白BkdR(与EcoLrp有36.5%的氨基酸同源性)通过正向调控bkd操纵子的转录表达增强BkdR对胰蛋白酶的敏感性[47]。将EcoLrp导入bkdR缺失突变株时,BkdR功能恢复,这暗示着BkdR与EcoLrp调控功能的互补性[8]。本实验室发现SACE_Lrp与天蓝色链霉菌中Lrp蛋白SCO3361也可以蛋白互作[16, 18]。近期发现创伤弧菌的Lrp作为全局调控因子正向调控细菌细胞毒力、趋化性和铁离子获取能力。Lrp可以结合在7个毒力相关基因的启动子区并发挥正调控作用,但本身进行负向自我调节。当lrp突变后,突变株中与铁转运、蜂毒肽合成相关基因的转录水平被下调,与细胞毒素分泌、趋化性相关的基因水平都显著降低[9]。嗜线虫致病杆菌中全局性调控子Lrp蛋白的丰度会导致细菌的毒力发生变化[10]。
近年来,放线菌Lrp也得到较多的关注。谷氨酸棒状杆菌Lrp通过激活转运蛋白BrnFE的表达提高L-异亮氨酸的产量[12, 48]。结核分枝杆菌LrpA(RV3291c) 可以帮助细菌抵抗营养贫乏等不利的环境。当营养不足时,lrpA的转录水平升高,且LrpA会直接结合其上游编码赖氨酸氨基转移酶基因lat的启动子区,促进lat转录[13]。MtbAldR(RV2779c)也具有同样的调控作用,直接结合其上游编码丙氨酸脱氢酶的靶基因(ald)。在缺乏营养的条件下,ald的转录水平会高度上调[14]。天蓝色链霉菌中Lrp蛋白BkdR可以调控相邻bkd操纵子的表达。当bkd突变后,菌株会存在产孢缺陷并且失去有关色素的表达能力,致使孢子数量减少、活力降低并且放线紫红素的产量明显下降[49]。Yu等还发现天蓝色链霉菌中Lrp同源蛋白SCO2140可以正向调控放线紫红素和钙依赖抗生素的生物合成。SCO2140缺失突变后,孢子形成时间会延迟,而SCO2140蛋白缺乏DNA结合结构域,其作用靶点并不清楚[15]。
本实验室在Lrp对抗生素生物合成的基因调控研究领域取得重要进展,发现SACE_Lrp通过调控分支氨基酸(Leu,Ile和Val)的转运和代谢,负向影响红霉素生物合成。这是首次在产抗生素放线菌中解析Lrp对抗生素生物合成调控机制的研究[18]。此后我们还发现天蓝色链霉菌SCO3361通过直接调控actII-ORF4(编码放线紫红素生物合成基因簇内调控蛋白)和amfC(编码气生菌丝形成蛋白)的转录水平,正向影响放线紫红素的生物合成和菌株的形态分化[16]。最近,Lu等又发现螺旋霉素链霉菌中的Orf2(SSP_Lrp)是一个全局性调控因子,通过控制(双)螺旋霉素生物合成基因簇内正调控基因bsm23、bsm42和acyB2的转录水平,负调控(双)螺旋霉素的生物合成[17]。
4.2 Lrp在古生菌中的调控功能
Lrp/AsnC家族是古生菌中4个广泛存在并且数量最多的转录调控蛋白家族之一[31],其余3个调控家族分别为:HTH_3(假定激活蛋白家族)、TrmB(麦芽糖特异性调节相关蛋白)和ArsR(解毒过程相关蛋白)。目前古生菌中Lrp的研究主要集中在4个模式菌株:嗜热菌、硫化叶菌、甲烷球菌和嗜盐菌[19]。
古生菌Lrp不仅能调节氨基酸代谢,还可影响中心代谢、ATP代谢、重金属多肽等物质运输。堀崎嗜热球菌Lrp家族蛋白FL11可应答Lys[20],还可以作为“富足或饥饿”调节因子调控细胞的生长状态[6]。当营养富足时,氨基酸分解代谢并且ATP合成处于激活去阻遏状态,细胞生长;当营养贫乏时,氨基酸生物合成基因被激活,细胞停止生长[6]。嗜盐杆菌Lrp通过激活korAB(编码氧戊二酸铁氧还蛋白氧化还原酶)影响氧戊二酸和谷氨酸的平衡控制TCA循环的方向和速率,进而参与调控中心代谢[27];可正调控编码谷氨酰胺合成酶的glnA、转录调节因子sirR和负调控甘油脱氢酶基因gldA1及转导基因car;还可以刺激磷酸盐转运操纵子pstC2和phnC的表达[27]。另一Lrp蛋白(LrpA1)依赖L-天冬氨酸特异性地负向调节编码天冬氨酸转氨酶的aspb3基因,但正向调节自身基因的转录水平。詹氏甲烷球菌Ptr2通过二级上游激活位点(UAS)向TATA盒募集TBP增强红素氧还蛋白Rb2和铁氧还蛋白FdxA的表达[25, 28]。来自硫磺矿硫化叶菌的Ss-LrpB可正向激活丙酮酸铁氧化还原酶操纵子porDAB和两个渗透酶基因表达,这初步鉴定了Ss-LrpB蛋白的体内生理作用[25, 32]。嗜酸热硫化叶菌BarR激活参与β-Ala降解的β-丙氨酸转氨酶基因表达,也激活编码谷氨酰胺合成酶基因的转录[29]。
古生菌中一些Lrp蛋白不仅可以调节本家族转录调控因子的表达,还可以调控其他家族调控子的表达,暗示着其中可能存在分级调控网络[19, 27]。如堀崎嗜热球菌的全局性调控因子FL11可以影响至少其他4个Lrp蛋白的表达[19-20]。
5 展望
近年来,Lrp受到越来越多地关注,但相对其他转录调控蛋白家族的研究,如TetR、LuxR和MarR等[50],其研究还是较少。大肠杆菌Lrp的结构和功能已研究得较为透彻,这对理解来自不同种属Lrp的调控功能具有指导意义。然而,仍有许多问题亟待解决。例如:尚未有文章详细介绍Lrp N末端的保守氨基酸如何识别不同的结合位点,这对研究Lrp如何发挥调控作用具有重要意义;古生菌中Lrp靶基因和效应分子仍缺乏认识,其分级调控网络仍不清楚;古菌中DM1蛋白和天蓝色链霉菌中SCO2140蛋白缺乏DNA结合结构域,其是怎样发挥调控作用并不清楚;目前仅有一篇报道从结构上解释了氨基酸(仅Ala)如何影响Lrp(MtbAldR)的DNA结合活性。这为后续研究其他Lrp如何应答氨基酸提供依据。文章还提出,不同配体的结合是否会引起蛋白质四级结构细微的变化而形成不同程度“开放”,不同四级结构的蛋白与靶位点结合是否引发不同的应答,都需要进一步研究。此外,本实验室解析了Lrp参与调控抗生素生物合成的分子机制[16, 18],这为研究其他产抗生素放线菌中的Lrp指明了方向[17]。
