城市常绿园林植物香樟叶片色素变异特征研究
2019-12-19吴甘霖
吕 丹, 吴甘霖, 邱 东, 陶 冶
(安庆师范大学 生命科学学院 皖西南生物多样性研究与生态保护安徽省重点实验室, 安庆 246133)
城市绿化植物是构建生态城市的主体和构成城市生态系统的关键,对改善生态环境、促进居民身心健康和保障社会经济的可持续发展有着不可替代的作用[1-2]。随着工业化的发展和城市规模的扩大,排放于大气和土壤中的污染物日益增多[3-5],这对城市植被有一定影响和危害。城市化过程中逐渐形成了不同城市小生境,并具有不同的环境特征(如不同程度的大气、土壤污染等)[6-7]。因此,研究城市不同生境及其潜在的环境变异对园林绿化植物生长和生理的多重影响对揭示城市人工植被的环境敏感性和适应性具有极为重要的意义。
叶片是高等植物光合作用的主要器官,其光合色素尤其是叶绿素含量是衡量光合作用强弱的重要因素[8]。植物光合色素对外界环境影响十分敏感,季节(物候期)、土壤养分有效性、土壤含水量、病虫害及空气污染等都是重要影响因素[9]。诸多研究表明,生境对植物光合色素含量有显著的影响。相比郁闭环境,在林缘旷地强光胁迫生境中,粗毛淫羊藿(Epimediumacuminatum)和山麻杆(Alchorneadavidii)均表现出较低的叶绿素含量[10-11]。在相对干旱的环境下,裸子植物圆柏(Sabinachinensis)叶片类胡萝卜素含量较高而叶绿素较低[12]。昆仑山前山牧场高海拔生境生长的牧草叶片色素含量明显高于绿洲低海拔生境,而后者叶绿素a/b值较高[13]。海边生境的盐地碱蓬(Suaedasalsa)叶绿素a、b含量显著低于内地生境条件下的植物[14]。可见,植物在不同生境条件下表现出的光合色素含量差异体现了植物在长期与环境交互作用过程中形成的一种适应策略。那么,由于城市环境的多样性和复杂性,不同小生境下园林绿化植物的光合色素含量如何变化?目前鲜有报道。
季节和生长季对光合色素含量影响显著,但其变化特征因物种不同而呈现较大差异。彩叶植物从生长初期到生长末期,呈现高→低→高的变化过程,即生长中期叶绿素a、b等色素含量最低[15],而类胡萝卜素含量则呈相反趋势[16]。裸子植物臭柏(Sabinavulgaris)叶片总叶绿素含量及叶绿素a/b随生长季延长呈不断增加趋势[17]。随物候期的变化,锐齿栎(Quercusacutidentata)叶绿素a、b、类胡萝卜素及总叶绿素含量均呈低→高→低的变化趋势,而叶绿素a/b在生长末期最大[18]。由此可见,不同类型植物叶片色素季节变化并未呈现一致规律。那么,城市园林绿化植物,尤其是常绿植物叶片色素含量随季节变化具有何种规律?
为解答上述科学问题,以安徽省安庆市区栽植常绿园林植物香樟(Cinnamomumcamphora)为研究对象,选择7个典型生境,通过夏季和冬季2次实地调查取样,系统研究香樟主要光合色素含量及其比例在生境、季节和树冠方位上的变异特征和可能的影响因素。研究结果将为指导城市绿化树种的科学管理,保障城市生态系统的可持续发展提供基础理论依据。
1 研究地区与研究方法
1.1 研究区概况
安庆市(115°46′~117°44′E,29°47′~31°17′N)地处长江中下游、皖鄂赣三省交界处,是安徽省西南部重要城市。安庆市北依大别山,南临长江,属于北亚热带湿润季风气候,具有季风明显、雨量充沛等气候特点;年平均气温14.5℃~16.6℃,年平均降水量在1253~1535 mm之间,年平均相对湿度77%。常年主导风向为东北风,占全年风向的52%,其次为西南风[19]。作为长江流域常见的园林绿化树种,香樟在安庆市区广为栽植,是最为常见的绿化树种。
1.2 试验设计
1.2.1 叶片样品采集与处理
依据安庆市城市功能区规划,结合实地踏查,选择7个在人类活动、人文特征及经济活动差异较明显的生境(A商业区、B居民区、C文教区、D休闲区、E工业区、F餐饮区和G郊区),分别于2016年7和12月开展2次调查取样。每个生境确定3个取样点,每个样点选取4棵树。为减小和避免误差,所有已选树木大小(胸径18~22 cm)及栽植年限(10 a~15 a)均一致。用高枝剪在树冠南北两侧分别剪取3~4个小枝,摘取当年生小枝第3~5叶序的叶片10枚,装入信封内迅速放入装有冰袋的泡沫保温箱内。样品带回实验室后置于4 ℃保存,并在1 h内完成叶绿素样品处理。
每个叶片样品用剪刀剪成细条状,避开主脉。然后将细条再次剪断为更小的片段,以保证样品光合色素能充分萃取。称取0.2 g叶片样品(重复3次),放入刻度试管内,加入95%乙醇定容到20 mL,室温下黑暗静置24 h,期间摇匀一次。测定前再将试管充分摇匀,取上清液,用紫外可见分光光度计分别在665、649及470 nm测定吸光值[13,18]。
95%乙醇提取光合色素含量计算公式:
Ca= 13.95A655- 6.88A649
(1)
Cb= 24.96A649- 7.32A665
(2)
Cx= (1000A470- 2.05Ca- 114.8Cb)/245
(3)
其中,A=nCNW-1(mg/g),A: 叶绿体色素含量;n: 提取液体积;N: 稀释倍数;C: 色素浓度(Ca,Cb,Cx);W: 样品鲜重。
由此计算得出叶绿素a含量、叶绿素b含量、类胡萝卜素含量x、总叶绿素含量T (叶绿素a+b)以及叶绿素a/b。
1.2.2 土壤样品采集与处理
在每棵树的东南西北4个方位距树0.5 m处各采集1次0~10 cm深土样,混合为1份备用。土壤带回实验室后,自然风干、过筛,采用鲍士旦的方法测定土壤有机碳(SOC, mg/g)、全氮(TN, mg/g)、全磷(TP, mg/g)、速效氮(AN, mg/kg)、速效磷(AP, mg/kg)、pH值及电导率(EC, μS/cm)[20],并计算土壤碳氮比(C∶N)、碳磷比(C∶P)、氮磷比(N∶P)及速效氮磷比(AN∶AP)。
1.3 数据处理
采用三因素方差分析解析生境、季节、树冠方位及其交互作用对香樟叶片色素含量及其比例的影响;各因子对香樟叶片色素含量的影响采用单因素方差分析完成。利用Levene′s test检验方差齐性,使用Duncan法进行多重比较[21]。对香樟叶片色素与土壤因子进行Pearson相关性分析,再分别基于土壤及光合色素指标对7个生境进行分层聚类,以进一步比较其相似程度。常规数据统计分析和作图采用Excel 2013完成,方差分析和聚类分析采用SPSS 19.0软件实现。
2 结果与分析
2.1 香樟叶片光合色素含量及比例对多环境因子的响应
生境和季节对香樟叶绿素各成分、叶绿素a/b及类胡萝卜素/叶绿素a有显著影响,且生境与季节的交互作用对光合色素指标也有显著影响(表1)。除树冠方位与生境的交互作用对叶绿素a含量有一定影响外,其他各因子及其交互作用对叶绿素各成分及叶绿素a/b均无显著影响。此外,3个因子对总叶绿素、叶绿素a及类胡萝卜素也有一定交互作用。总体上,季节的作用最大,其次是生境,树冠方位的影响极其微弱。因此,本研究不再单独分析树冠方位间的差异性。
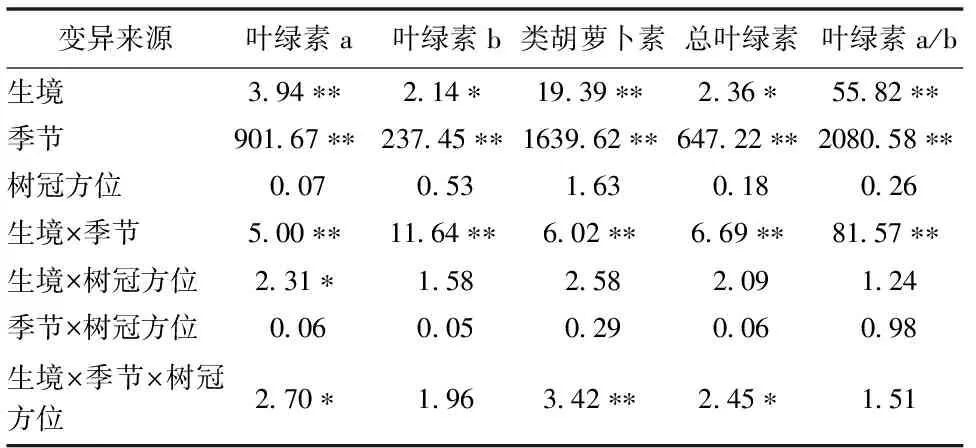
表1 香樟叶片色素指标的三因素方差分析(F值)
注:“*”P< 0.05;“** ”P< 0.01
2.2 生境对香樟叶片色素含量及比例的影响
研究结果显示,无论夏季或冬季,不同树冠方位香樟叶片总叶绿素量、色素各成分含量及其比例在不同生境间均有一定差异(图1和图2)。夏季时,香樟阴面叶叶绿素a、叶绿素b和类胡萝卜素的含量均是餐饮区(F)最低,其他生境间无明显差异,而叶绿素a/b的值在所有生境间均无差异;阳面叶叶绿素a、叶绿素b及类胡萝卜素的含量均以郊区(G)最高,商业区(A)最低,其他生境之间无显著差异,而叶绿素a/b的值以文教区最高(C),居民区最低(B)。
冬季不同生境香樟叶片色素含量及其比例的差异更大。对阴面叶而言,叶绿素a的含量以休闲区最高(D),其他各生境间无差异;而在阳面叶同样以休闲区最高(D),商业区(A)和工业区(E)最低。阴面叶和阳面叶叶绿素b的含量类似,均在商业区(A)、休闲区(D)、餐饮区(F)较高,而在其他4个区较低。阴面叶总叶绿素含量则以休闲区最高(D),商业区(A)和餐饮区(F)次之;对阳面叶而言,总叶绿素的含量同样以休闲区最高(D),而餐饮区(F)次之。无论是阴面叶还是阳面叶,叶绿素a/b的最高值均出现在文教区(C),居民区次之(B),最低值出现在商业区(A)和餐饮区(F),差异均极显著。
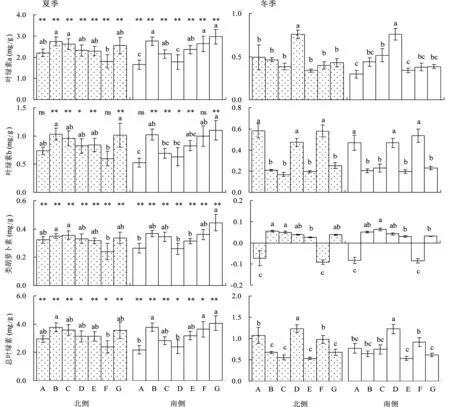
A: 商业区;B: 居民区;C: 文教区;D: 休闲区;E: 工业区;F: 餐饮区;G: 郊区。不同小写字母表示树冠两侧叶片色素含量在7个生境间差异显著(P<0.05)。“*”表示叶片色素在不同季节间差异显著(P<0.05);“**”表示差异极显著(P<0.01);ns 表示差异不显著(P>0.05)。下同
图1不同生境及不同季节香樟色素含量的比较
Figure 1 Comparison of pigment contents ofC.camphoraaccording to different habitats and seasons
2.3 季节对香樟叶片色素含量及比例的影响
季节对香樟的总叶绿素量、叶绿素各成分含量及其比例有强烈影响,且随生境的不同而不同(图1和图2)。对阴叶面,除商业区(A)和餐饮区(F)外,其他生境叶绿素b含量在夏季显著高于冬季;而在阳叶面,除商业区(A)和休闲区(D),其他生境叶绿素b含量同样在夏季显著高于冬季。无论树冠北侧或南侧,不同生境香樟叶片叶绿素a、类胡萝卜素、总叶绿素含量以及叶绿素a/b均表现为夏季显著高于冬季(图1)。相比于之下,冬季香樟叶片类胡萝卜素含量下降比例远高于叶绿素a和b。
2.4 香樟叶片色素含量及比例与土壤因子的关系
由于树冠方位对香樟叶片色素含量及比例没有显著影响,因而分夏季和冬季对不同生境香樟叶绿素指标与土壤因子的关系进行分析研究,以探析香樟叶绿素含量差异的可能原因。结果发现,除速效氮与叶绿素a/b呈显著负相关外,夏季香樟光合色素含量及其比例与11个土壤因子均无显著相关性(表2)。冬季香樟叶片色素含量及其比例与土壤因子的相关性较强。高的土壤TN、TP及AN含量有助于叶绿素b及总叶绿素含量的保持,但会显著降低类胡萝卜素含量及叶绿素a/b。土壤AP含量、土壤C∶N及速效N∶P对香樟光合色素特征的影响与TN、TP及AN相反。此外,在与土壤因子关系上,叶绿素含量与类胡萝卜素含量呈相反趋势,而叶绿素a/b与类胡萝卜素含量具有相似的关系和变化趋势。总之,土壤TN、TP、AN、AP及速效N∶P是冬季香樟叶片色素含量与比例的主要影响因素。

表2 香樟叶片色素指标与土壤因子间的相关系数

图2不同生境及不同季节香樟叶绿素a/b的比较
Figure 2 Comparison of chlorophyll a/b ofC.camphoraaccording to different habitats and seasons
不同季节之间土壤理化因子对香樟生境的聚类结果相似性较低(图3-A、 C),表明季节之间的土壤理化因子有较大差异。同样的现象也发生在由光合色素表征的生境聚类上(图3-B、D),也体现了季节间变异较大的光合色素特征。夏季叶片色素特征所反映的香樟生境聚类(图3-B)与土壤理化因子所表征的生境聚类(图3-A)有较大差异,这表明香樟生长与城市土壤因子关联性不明显或不受土壤养分限制,这一结果与相关性分析一致(表2)。冬季基于土壤因子和色素特征的两种聚类结果相似性较大,表现为居民区、文教区和工业区同在第一分支,商业区和餐饮区同在第二分支,仅休闲区和郊区有所变动(图3-C、D)。由此可见,相对于夏季而言冬季香樟叶片色素特征与土壤因子间具有较显著的关联,这也得到相关性分析的证实(表2)。
3 讨论
植物叶片色素由多个组分组成,其中叶绿素是高等植物光合作用中最重要的色素,其含量的多少直接影响植物光合作用的强弱[22-24]。在不同生理条件下,叶绿素a和叶绿素b的合成及分解速度影响了叶绿素a/b的比值,主要通过“叶绿素循环”实现,即叶绿素a和b的相互转化过程。在遮光条件下,叶绿素a向叶绿素b的转化加快,叶绿素a/b的比值降低,从而提高了植物对弱光的利用,是其生理适应所致[9]。可见,在弱光或遮光条件下,叶绿素b含量会相对增高,而叶绿素a/b会相应降低。然而,本文对常绿园林植物香樟的研究却并不支持上述观点,所有7个生境香樟树冠阴面叶片的叶绿素b含量及叶绿素a/b与阳面叶并未有任何显著差异,也即见光多少并没有影响香樟叶片色素含量。这可能是因为常绿乔木香樟不同树冠方位叶片尽管接收到的光强不同,但这种长期适应反而降低了树冠阴阳面所导致的光合色素含量的差异。
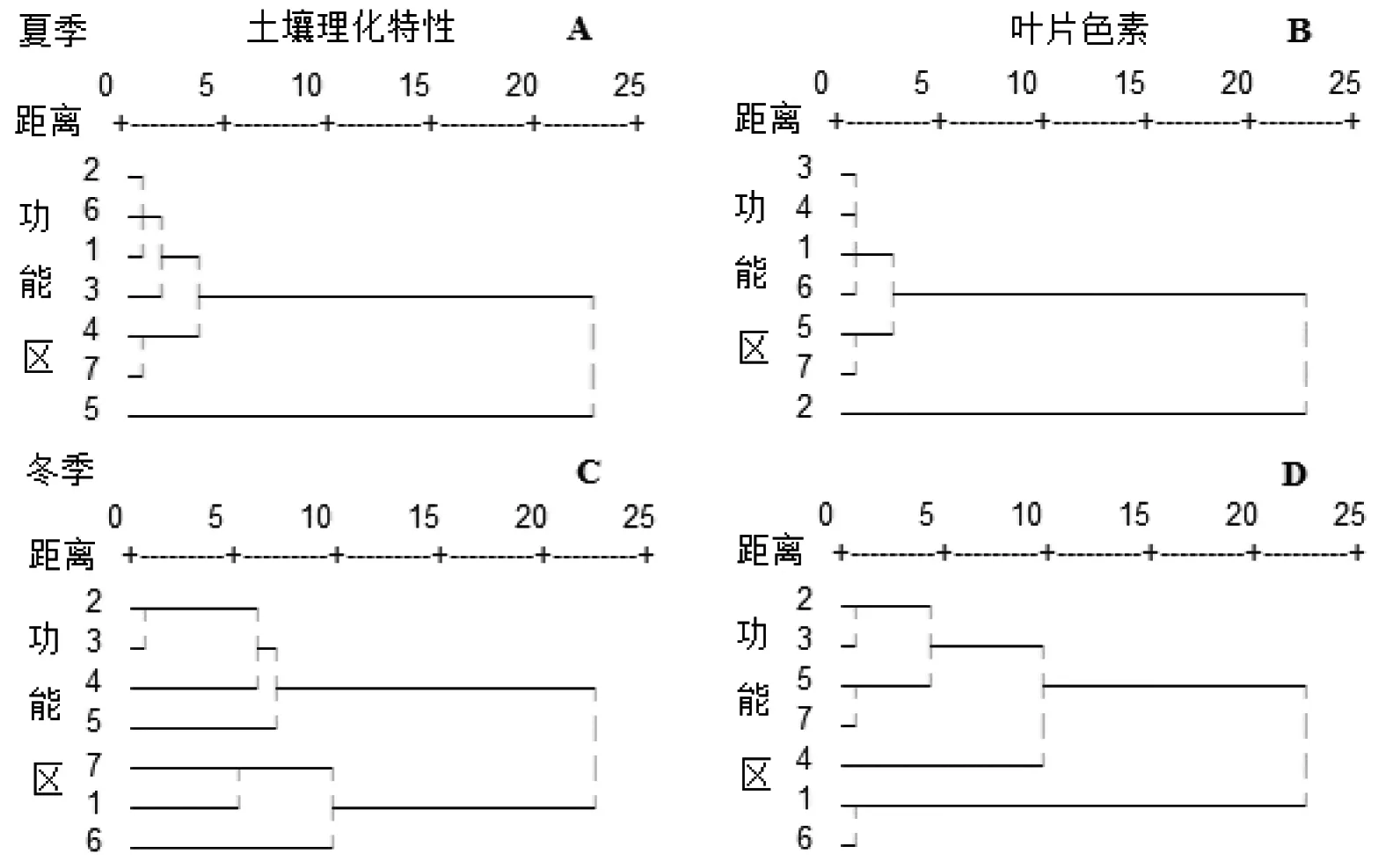
1~7分别表示商业区、居民区、文教区、休闲区、工业区、餐饮区和郊区
图3基于土壤理化特性和叶片色素指标的生境聚类分析
Figure 3 Cluster analysis on habitats based on soil physical-chemical properties and leaf pigments
夏季阳光充足,各生境香樟叶片光合色素含量均显著高于冬季,是常绿植物对环境长期适应并形成特定物候期的反映[18]。夏季也是常绿植物光合产物的快速积累期,高叶绿素含量有利于植物对光的吸收、利用和有机物积累,为植物生长及越冬存储能量。冬季时,所有光合色素含量均显著下降,但叶绿素a的下降速率高于叶绿素b,这与其生理适应密切相关[18]。冬季温度降低,光强减弱,主要吸收长波光的叶绿素a大多分解转化[9],而主要吸收短波光的叶绿素b却依然保持一定的量,这是叶绿素b对弱光环境的适应。这种不等比例的下降最终导致冬季时不同生境香樟叶绿素a/b均显著低于夏季[18]。
高等植物的类胡萝卜素是光合作用天线系统和反应中心叶绿素结合蛋白的重要组成部分。类胡萝卜素是光合系统的基本成分,既参与光捕获又抑制过剩激发能[25-26]。类胡萝卜素是非酶氧自由基的重要清除剂,较高的类胡萝卜素含量有利于减少或防止过量的活性氧产生和保持叶绿体内自由基产生及淬灭的平衡[27]。对于变色常绿阔叶植物小叶黄杨而言,其冬季变色主要因为类胡萝卜素含量增加,光抑制程度加重,活性氧相关指标如过氧化氢含量、超氧化物歧化酶和过氧化氢酶活性也显著升高,总体光化学效率降低[28]。然而,对于始终保持绿色的香樟而言,本研究发现其类胡萝卜素含量在冬季显著降低,并未呈现增加趋势,因而香樟叶片类胡萝卜素含量对季节的响应与变色小叶黄杨完全不同,这可能是不变色常绿植物的色素保护机制。
叶绿素含量的变化除与植物对光照的适应性有关,也受到土壤中矿质元素的影响[22,24,29],而土壤养分有效性的差异则是对生境异质性(即城市不同生境)的反映。相关性分析结果表明,土壤TN、TP、AN、AP及速效N∶P是冬季香樟叶片色素含量与比例的主要影响因素。磷不仅是核酸、磷脂的组分,也是许多辅酶的组分,直接参与氧化磷酸化和光合磷酸化,因而在能量代谢中起特殊作用,土壤P含量会影响光合色素的量及植物光合作用的某些过程[30]。许多研究表明,当土壤存在N缺乏、干旱等胁迫时,叶片叶绿素含量会随之下降[31-33]。本研究表明,N和P有助于冬季香樟叶绿素b含量的维持,但会降低类胡萝卜素含量及叶绿素a/b。这也说明,在土壤条件较好的生境生长的香樟其主要光合色素含量会更高,其中对吸收短波蓝紫光的叶绿素b更有利。
研究结果还显示,生境对香樟色素特征的影响小于季节变化,而且不同季节条件下生境对香樟色素的影响也有不同,即夏季生境的影响作用明显小于冬季,因为夏季香樟光合色素含量与土壤因子间的关系不密切。可见,夏季不同生境香樟长势总体较好,生境的影响较小,而冬季香樟生长缓慢,此时叶片光合色素含量大大降低,也更易受外界环境的影响。本研究表明,全量N、P及速效N、P是冬季香樟色素特征的主要影响因素,这一结果也指示可在冬季通过人工干预对土壤输入外源养分来调控香樟的生长。因此,季节也是城市生境土壤异质性对香樟色素特征产生影响的重要调控因素。
总之,作为城市绿化常用的常绿树种,香樟叶片色素随城市生境及生长季节变化均表现出显著的变异特征,且这些变化与已有相关研究并不完全相同。这是否为香樟独特的变化适应模式抑或其他常绿园林植物共有的特征尚难以判断。此外,由于本文未对各生境环境质量进行长期有效监测,故也无法准确判断其与香樟生长及叶片色素特征的关系,因而这些问题仍需进一步研究。
