异叶天南星凝集素基因的克隆及蛋白的结构性质分析
2019-12-19赵德蕊张声祥施圆圆杨青山王晨凯单春苗吴家文
李 晟, 赵德蕊, 张声祥, 施圆圆, 杨青山,4, 王晨凯, 单春苗, 吴家文
(1. 安徽中医药大学 药学院, 合肥 230012; 2. 安徽中医药大学 研究生院, 合肥 230012;3. 安徽中医药大学科研实验中心 新安医学教育部重点实验室, 合肥 230038;4. 安徽道地中药材品质提升协同创新中心, 合肥 230012; 5. 安徽省中医药科学院, 合肥 230012)
异叶天南星(ArisaemaheterophyllumBlume)是一类重要的中草药,它的块茎在亚洲地区具有悠久的药用历史。其性温,气微辛,味辣,归脾、肝、肺经,主要用于燥湿化痰、祛风定凉、消肿散结以及治疗破伤风、跌打损伤和毒蛇咬伤等[1],同时还具有消炎、止痛和抗肿瘤的功效,在临床上与其他中草药配伍可有效治疗肺癌、食管癌等疾病[2]。张志林等[3]已用MTT法证实天南星水提取物和乙醇提取物对体外宫颈癌Hela细胞、白血病K562细胞、胃癌BGC823细胞均有抑制增殖作用,且在动物试验中证实这些提取物对机体免疫系统没有明显影响。
凝集素(lectin)是一类在自然界中普遍存在的复杂非免疫球性蛋白或糖蛋白,现已从病毒、细菌、真菌、无脊椎动物、脊椎动物和植物中都分离出了凝集素[4-7]。凝集素在不同程度上参与了生物在正常和病理情况下的免疫过程。来源于植物或动物的凝集素作为一种潜在的治疗药物,由于其防御功能和诱导细胞凋亡的能力被广泛用于治疗癌症[8-9]。目前,植物凝集素已在多种不同的植物物种中被检测到,并显示具有特异性识别并可逆结合糖类复合物的糖基部分的特性[10]。凝集素专一性结合不同的糖分子,据此可将凝集素分为甘露糖结合凝集素、半乳糖结合凝集素、葡萄糖结合凝集素、岩藻糖结合凝集素和唾液酸结合凝集素等几类[11]。本研究所克隆的AhLTN凝集素属于D-甘露糖结合凝集素,此类凝集素只特异性结合含D型甘露糖的凝集素受体。伴刀豆凝集素A属于D-甘露糖凝集素类别,其表达蛋白伴刀豆球蛋白(ConA)具有自噬型细胞毒性和免疫调节双重功能,可加速小鼠巨噬细胞培养物中细胞色素C的释放和线粒体的聚集从而导致细胞凋亡,也能诱导黑色素瘤A375细胞凋亡[12-13],在小鼠肝癌原位模型中,饲喂ConA后肿瘤组织发生了明显的萎缩[14]。
自1982年Hoffman等[15]克隆出了第一个凝集素基因以来很多凝集素基因被成功克隆,例如凝集素基因已经先后从苦参[16]、石斛[17-18]等中药材中被成功克隆。本研究通过对异叶天南星转录组数据分析得到Ahltn功能基因,通过RT-PCR等技术成功克隆出Ahltn的读码框序列片段,并进一步利用生物信息学软件对其表达的蛋白质结构及性质进行了分析,以期为Ahltn基因和蛋白功能的进一步研究和开发利用奠定实验基础。
1 材料与方法
1.1 植物材料
2018年3月于安徽中医药大学药园采摘异叶天南星植株并被安徽中医药大学杨青山老师鉴定。用超纯水将异叶天南星多次漂洗至洁净后用滤纸擦拭吸干表面水分,随即将根、茎和叶分开采集后放入离心管冷冻于液氮中,最后放入-80℃冰箱冻存保留以用于RNA的提取。
1.2 仪器与试剂
主要仪器与试剂列于表1和表2。

表1 主要仪器

表2 主要试剂
1.3 总RNA的提取以及cDNA的合成
从-80℃冰箱中取出异叶天南星样品加入液氮中充分研磨成粉末,利用E.Z.N.A Plant RNA Kit试剂盒纯化获得异叶天南星叶的总RNA,具体步骤如下(离心速度均为12 000 r/min): 1)500 μL RB漂洗缓冲液与10 μL β-巯基乙醇混合。2)将冻存的新鲜叶片放入研钵中,加液氮,充分研磨成细粉,分装入1.5 mL EP管中;加入准备好的混合液,上下颠倒混合均匀,离心10 min。3)转移上清约500 μL至DNA过滤柱中,离心2 min;加入1/2体积无水乙醇至流穿液中,上下颠倒5~10次。4)将液体转移至纯化柱中,离心10 min,弃滤液,将柱子放回收集管中;加入400 μL漂洗缓冲液,离心1 min,弃滤液和收集管。5)将纯化柱放入2 mL新的收集管,加入漂洗缓冲液,离心1 min,弃滤液;重复本步骤一次。6)空管离心1 min,弃滤液和收集管;将纯化柱转移至新的1.5 mL EP管中,加30~50 μL焦碳酸二乙酯 (DEPC) 洗脱RNA,静置10 min,离心2 min获得总RNA。
进一步使用紫外分光光度计和琼脂糖凝胶电泳验证了RNA的浓度以及完整性,挑选优质的RNA为模板进行逆转录获得cDNA。
1.4 引物设计
通过分析异叶天南星转录组测序的数据,获得其中的一个凝集素功能基因(基因编号为CL2833),通过软件分析获得其ORF序列(命名为Ahltn),使用Primer 5.0软件在其ORF两端设计一对特异性扩增引物如下:Ahltn-S:5′-CATATGATGGCGGCAGCGAAGCCCGG-3′(26 bp);Ahltn-A:5′-CTCGAGTCAGGCCCTGTTGCTCCCCGT-3′(27 bp)。
1.5 Ahltn基因的克隆
利用mRNA逆转录合成的cDNA为模板,采用两步法对Ahltn基因进行扩增。RT-PCR反应体系为:2.5 μL 10×PCR缓冲液、16.0 μL 灭菌超纯水、1.0 μL 10 mmol/L dNTP、1.0 μL 5 μmol/L上游及下游引物、2.0 μL cDNA、1.0 μL rTaqDNA聚合酶,共24.5 μL。反应条件为:94 ℃预变性3 min;94 ℃变性30 s,40 ℃退火30 s,72 ℃延伸1 min,共10个循环;随后94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,共25个循环;最后72 ℃再延伸10 min。对RT-PCR产物用琼脂糖凝胶电泳进行鉴定以及胶回收试剂盒(AxyPrep)进行胶回收,从而得到纯化的目的基因Ahltn。

表3 生物信息学软件
1.6 构建克隆重组质粒pMD19-T-Ahltn
将Ahltn基因与pMD19-T载体连接,连接体系为1.0 μL T4 DNA 连接酶、1.5 μL pMD19-T载体、11.0 μLAhltn基因、1.5 μL 10倍浓度连接酶缓冲液共15.0 μL。随后将其混匀置入16 ℃水浴锅中连接12 h。采用42 ℃热激法将连接产物转化到E.coliDH5α感受态细胞中,置于37 ℃恒温培养箱中培养20 h左右至培养基中长出菌斑,然后挑取平板上阳性克隆个体置入液体培养液中扩大培养,再收集菌体提取重组质粒pMD19-T-Ahltn。最后选取PCR鉴定和双酶切鉴定都正确的重组质粒进行测序鉴定(上海生工生物工程公司)。
1.7 生物信息学分析
利用在线软件对Ahltn的碱基序列及其编码蛋白的理化性质、同源性、进化关系、二级结构和三级结构进行了分析,具体见表3。
2 结果与分析
2.1 Ahltn基因克隆和鉴定
2.1.1 总RNA的提取
通过紫外分光光度计测得异叶天南星总RNA的OD260/OD280比值为2.0,经琼脂糖凝胶电泳后发现在28 S、18 S和5 S处分别有3条清晰可见的亮带(图1-A),说明总RNA的浓度、纯度和完整性均符合实验要求,可用于cDNA的合成。
2.1.2Ahltn基因的克隆
挑选高浓度的mRNA样品为模板经逆转录得到cDNA。再以cDNA为模板,利用引物Ahltn-S和Ahltn-A进行扩增,经琼脂糖凝胶电泳后在500~750 bp处发现一条清晰的基因条带(图1-B)。
2.1.3Ahltn克隆载体的构建及鉴定
提纯目的基因后将其连接到pMD19-T载体中,再将重组质粒转化至E.coliDH5α感受态细胞中,挑取阳性单克隆进行扩大培养,经菌液PCR鉴定后(图1-C)出现明确的目的条带;重组质粒经生工测序所得序列与异叶天南星转录组数据库中CL2833基因序列一致,说明已成功克隆出Ahltn基因开放读码框,此序列已经提交到GenBank数据库,登录号为MH729820。

A:总RNA提取;B:Ahltn基因克隆;C:菌液PCR鉴定;箭头表示目的基因条带
图1Ahltn基因的克隆与鉴定
Figure 1 Cloning and identification ofAhltn
2.2 生物信息学分析结果
2.2.1Ahltn序列分析
用SMS在线软件将Ahltn的cDNA序列翻译成氨基酸序列(图2),Ahltn基因的读码框长度为561 bp,编码186个氨基酸的蛋白质,TGA为终止密码子。

图2 Ahltn的读码框序列和编码的氨基酸序列
2.2.2Ahltn基因编码蛋白的理化特性分析
Protparam 软件分析显示AhLTN蛋白质分子不稳定系数为22.39,低于阈值40,属于稳定型蛋白;其等电点为9.14,为偏碱性蛋白;总平均亲水性指数为0.17,为疏水性蛋白。其他理化性质列于表4。
2.2.3 AhLTN蛋白的基元分析
通过Motif Scan软件分析,AhLTN含有多种基元,主要包含1个酰胺化位点、1个N-糖基化位点、4个酪蛋白激酶II磷酸化位点、5个蛋白激酶C磷酸化位点、5个N-蛋白质豆蔻酰化位点和1个C末端微体靶向序列(表5),该蛋白属于Bulb-lectin超家族。
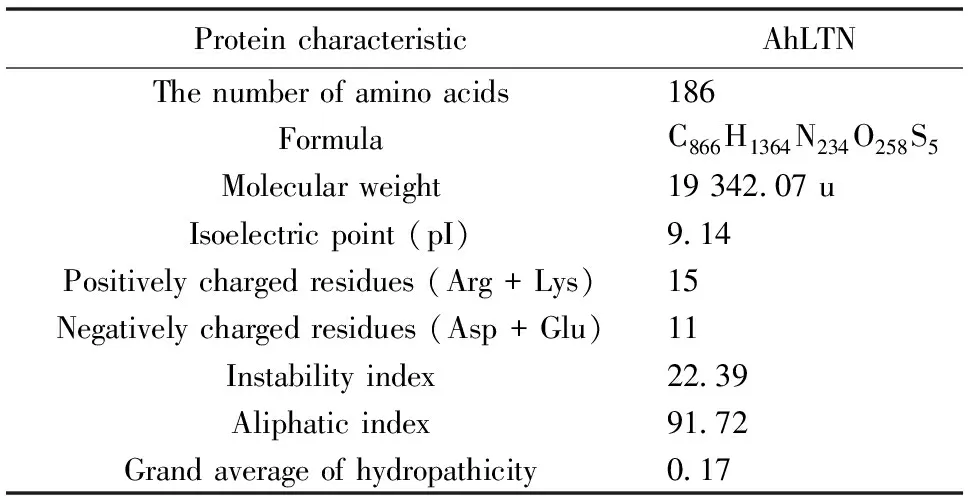
表4 AhLTN的理化性质

表5 AhLTN蛋白的基元或结构域分析
2.2.4 AhLTN与不同物种凝集素蛋白的同源性比对及系统进化树分析
通过NCBI BLAST软件对不同物种之间的凝集素蛋白序列进行比对分析,结果表明AhLTN与其他植物的凝集素蛋白有较高的序列同源性。如表6所示,AhLTN与铁皮石斛(Dendrobiumcatenatum)、生姜(Zingiberofficinale)、郁金香杂交品种(Tulipahybridcultivar)和葱兰(Zephyranthescandida)等植物的凝集素蛋白序列同源性分别达到了70%、67%、64%和61%。在GenBank中获取上述植物的凝集素蛋白序列后,由MEGA5.0软件分析得到了AhLTN系统发育进化树,结果如图3所示。说明在现有的NCBI数据库中AhLTN与铁皮石斛(Dendrobiumcatenatum)凝集素遗传距离最短,亲缘关系最近。这与其门纲关系相符合,即AhLTN与铁皮石斛同属于被子植物门单子叶植物纲。
2.2.5 AhLTN蛋白二级结构分析
利用MEGA 5.0、Clustalx 1.83和ESPript 2.2软件把AhLTN与表5中的11种不同植物中凝集素蛋白进行了氨基酸序列比对(图4),并根据Swiss Model结构模型分析AhLTN蛋白S37-T136部分的二级结构(图4,第一列)。结构显示AhLTN蛋白S37-T136区域具有11个β折叠结构(S40-L42、Q45-Q49、Y52-Q57、C60-N66、V69-A73、V84-Q88、D92-F96、L103-S105、V117-Q121、N125-Y129、I133-A135)和9个TT结构(S37-G38、T43-G44、G50-N51、E58-D59、G67-R68、Y77-H88、R89-D90、G98-S99、P122-D123)。3个甘露糖结合保守序列QXDXNXVXY(在图4中用绿色三角形标记),分别位于Q57-Y65、Q86-F96、Q121-Y129,而Q86-F96序列中的D92和F96分别替换了保守序列中N和Y。

表6 AhLTN蛋白同源关系比对

图3 AhLTN的系统进化树
Figure 3 Phylogenetic tree of AhLTN
注:该进化树是利用MEGA5.0软件生成,0.1代表遗传距离
2.2.6 AhLTN蛋白三级和四级结构预测
利用在线软件Swiss Model[19-20],以蛋白数据库PDB(http://www.rcsb.org/)中的3a0c(PDB ID)的晶体结构为模板得到了AhLTN的三级结构模型,再使用PyMOL软件绘制了AhLTN的三维立体结构(图5),AhLTN四级结构是由两个单体组成的同二聚体,两个单体的C-末端的β-片层进行了交换,增强了亚基间的结合力(图5-A)。两个亚基采用β-棱镜II折叠方式形成[21],各由3个亚结构域组成(图5-C),其中每一个亚结构域是由3~4个反平行的β-片层组成,构成了三棱镜的3个面,3个保守的色氨酸残基Trp76,Trp108和Trp136分别位于3个面上,且将它们非极性的侧链指向内部,形成了棱镜的疏水核心(图5-B)。此外,三棱镜每个面上都有糖基结合位点(CBS),含保守的甘露糖结合基序QXDXNXVXY(其中X代表任何一种氨基酸残基),如图5-C所示(两个亚基的甘露糖结合位点分别用红色或绿色示意),这些结合位点在凝集素的碳水化合物识别过程中起着决定作用。

白底黑字表示不同的氨基酸;白底红字表示相似的氨基酸;红底白字表示相同的氨基酸;三角形表示甘露糖结合位点。AhLTN的二级结构示意图位于比对图最上方,箭头示意β-折叠
图4不同物种间凝集素序列的比对及AhLTN的二级结构示意图
Figure 4 Comparation of lectins in different species and secondary structure of AhLTN
3 讨论与结论
在此项研究中,我们首次成功克隆出异叶天南星的Ahltn基因的ORF片段,并利用了一系列生物信息学软件对Ahltn基因编码的蛋白性质和结构进行了分析。根据异叶天南星转录组数据,该基因在根、茎和叶中表达值(FPKM)分别为0.3、0.16和0.06,其中在根中表达较多,但总体表达量都很低。Ahltn读码框编码186个氨基酸。AhLTN的三级结构富含β折叠,呈“三棱镜”型,3个保守的色氨酸位于中心,构成了疏水核心,并且三棱镜每个面上所含的甘露糖结合位点决定了AhLTN与D-甘露糖独特的结合性质,而不同肿瘤细胞表面集中分布有不同的糖基,所以进一步的研究应集中在AhLTN基因编码蛋白的表达与纯化以及纯化的蛋白对不同肿瘤细胞的影响。

A:AhLTN二聚体模型,蓝色和红色各示意一个单体;B:球形示意3个保守的色氨酸残基Trp76、Trp108和Trp136;C:红色或绿色示意2个亚基的甘露糖结合位点。AhLTN的三级结构模板为3a0c,两者的序列一致性为50.49%;序列相似性为42%;覆盖率为55%(S35-G139)
图5 AhLTN的同二聚体结构模型
Figure 5 The structure model of AhLTN homodimer
近些年来,凝集素作为抗肿瘤药物的应用前景受到人们的广泛关注,它们独特的糖结合性质以及它们凝集细胞和沉淀多价碳水化合物的能力一直被人们挖掘,它们有望与癌细胞表面糖复合物结合而导致特定癌细胞的凋亡[18],蓖麻毒蛋白是由A、B二条肽链构成的典型的植物凝集素,其中B链与细胞表面的半乳糖结合后将A链释放,A链进入细胞内与核糖体亚基中的RNA结合,致使细胞停止合成蛋白质而死亡[22]。随着肿瘤中日益增多的蓖麻毒蛋白结合位点被发现,用天然未加修饰的凝集素来治疗肿瘤已经成为一种新的趋向。不同的凝集素分子与不同的糖基特异性结合,鲍锦库[11]用7种不同的凝集素来分别标记卵巢浆液囊腺瘤和浆液囊腺癌,结果发现有些凝集素特异性地与良性肿瘤细胞结合,而另外的一些只与恶性卵巢浆液囊腺癌细胞发生结合,这种现象说明由于恶性程度不同的卵巢上皮的糖复合物不同,导致凝集素在不同恶性程度肿瘤上的标记也不同,所以用凝集素来鉴定肿瘤恶性程度是一个重要可行的方法。随着基因工程技术的发展,许多植物中的凝集素已经可以在体外高效的表达和纯化,并发展为肿瘤标记物或抗肿瘤药物。本研究将为天南星科凝集素开发为抗肿瘤临床药物或药物载体奠定基础。
