马铃薯酯酰基水解酶的特性研究
2019-12-19吴乔羽徐姗楠杨丹璐龚盛祥吴金鸿王正武
吴乔羽 - 徐姗楠 - 翁 晴 杨丹璐 - 龚盛祥 -张 维 吴金鸿 - 王正武 -
(1. 上海交通大学农业与生物学院,上海 200240;2. 中国水产科学研究院南海水产研究所,广东 广州 510300;3. 农业部南海渔业资源开发利用重点实验室,广东 广州 510300)
马铃薯(SolanumtuberosumL.)为茄科属一年生草本植物,块茎含有丰富的碳水化合物、蛋白质、膳食纤维、维生素等营养成分,除可供人类食用外,工业用途也十分广泛。作为全球第四大粮食作物,马铃薯广泛分布在世界各大地区,其加工业发展十分迅速[1]。马铃薯工业的发展造成数量庞大的马铃薯废液(potato fruit juice,PFJ)被排放。PFJ中干物质含量为20~50 g/kg,其中粗蛋白含量占1/3[2]。目前,利用超滤膜处理马铃薯废液,能够从中回收马铃薯蛋白及低聚糖;采用“冷冻催化氧化絮凝吸附”工艺可以使马铃薯废液中有机物沉淀,所产生的沉淀有作为饲料或饲料添加剂的潜力[3]。然而这些处理马铃薯废液的方法均存在耗时耗力、不适合进行大规模工业应用的缺点。
马铃薯块茎中的蛋白质一般分成三类:Patain(分子量39~45 kDa)、蛋白酶抑制剂(分子量5~25 kDa)、其他蛋白(分子量50 kDa以上)。Patain是一组特异性存在于马铃薯块茎中的球类糖蛋白,占块茎总蛋白的40%左右,自然条件下以二聚体的形式存在,其等电点的范围为pH 4.45~5.17[4]。作为马铃薯块茎贮藏类蛋白,Patain除具有抗氧化活性[5]外,还具有良好的乳化性、发泡性和凝胶性[6]。这些特性使其能作为一种良好的食品添加剂应用于食品加工[7]。此外,与其他块茎贮藏蛋白质有所不同的是,Patain具有非特异性酯酰基水解酶活性(LAH),对于磷脂、糖酯、单酰基和二酰基甘油、长链脂肪酸酯等都具有一定的特异性[8]。与脂肪酶在油水界面发挥作用不同,酯类酰基水解酶对于脂类的作用是在溶液中进行。Patatin具备的这种酶活性与植物的生长过程有着密切关联,其可以水解细胞内的多种底物,释放出大量的脂肪酸,为三羧酸循环和β-氧化作用提供能源[9]。
目前虽然已有较多关于马铃薯酯酰基水解酶提取纯化的方法:膨胀床吸附法[10]、基因表达法[11]、磁性壳聚糖微球法[12]、凝胶色谱法[13]等,但是这些方法需要多个纯化步骤,或者在预处理阶段引入了化学试剂,导致蛋白质容易变性且纯化效率低不利于后续研究及工业化应用。同时,目前对于马铃薯酯酰基水解酶的研究主要集中于分子水平[14],解释Patatin作为酯酰基水解酶(LAH)的特性、活性机理以及影响因素的研究相对较少,关于其在食品工业领域中的应用还十分有限。试验拟从马铃薯汁水(PFJ)中提取纯度较高的Patatin,并且以单分散态脂肪作为底物,深入且系统探讨Patatin作为酯酰基水解酶(LAH)的酶学特性,为今后将Patatin作为新型天然酶制剂应用在食品加工领域提供一定的理论指导。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
马铃薯全粉(冻干粉末):克新1号,上海绿晟实业有限公司;
Q-Sephrose Fast Flow:生化级,美国GE Healthcare公司;
电泳上样缓冲液:分析纯,上海碧云天生物技术有限公司;
考马斯亮蓝G-250:分析纯,北京索莱宝科技有限公司;
对硝基苯乙酸酯(p-Nitrophenylacetate,PNP-acrtate):分析纯,美国Sigma公司;
其他试剂均为国产分析纯。
1.1.2 主要仪器设备
pH计:FE20型,梅特勒—托利多仪器(上海)有限公司;
恒温混匀器:THERMOMIXER C型,艾本德中国有限公司;
电泳仪:EPS300型,上海天能科技有限公司;
GeneGenius紫外凝胶图像仪:TANON 3500型,美国Synegene公司;
离心机:J6-MI型,美国贝克曼库尔特有限公司;
紫外—可见分光光度计:UV-2802S型,上海UNIC公司;
纯水系统:Milli-Q Biocel型,美国Millipore公司。
1.2 试验方法
1.2.1 模拟马铃薯汁水(PFJ)的制备 取适量马铃薯全粉,按照1 g/10 mL的比例溶解于去离子水中,并添加0.5 g/100 mL 的NaHSO3,置于恒温混匀器上搅拌1 h,然后离心取上清液,保存备用。
1.2.2 马铃薯粗蛋白的提取 根据崔竹梅等[15]的试验方法做适当修改:将制备得到的上清液pH调至4.0,静置10 min后,搅拌1 h,在6 000 r/min转速下离心15 min,取沉淀,复溶于20 mmol/L磷酸盐缓冲液(pH 7)中,0.45 μm 滤膜过滤后得粗蛋白液。
1.2.3 离子交换柱层析 根据孙莹等[16]的试验方法做适当修改:Q-Sepharose Fast Flow(2.6 cm×20 cm)柱子用5倍柱体积清水清洗,5倍柱体积pH 7的20 mmol/L磷酸盐缓冲液平衡后,取5 mL粗蛋白液上柱,用20 mmol/L 磷酸盐缓冲液淋洗5倍柱体积,收集离子交换穿透峰,然后用含有1 mol/L NaCl的20 mmol/L磷酸盐缓冲液(pH 7)洗脱,在280 nm波长下检测吸光度值,收集离子交换洗脱液。透析后冷冻干燥,保存于-20 ℃冰箱中,备用。
1.2.4 SDS-PAGE电泳分析 取10 mg冷冻干燥后的样品配制成5 mg/mL蛋白液,从中取40 μL于EP管中,并加入10 μL上样缓冲液,混合后将EP管置于沸水中孵育5 min,然后用12%聚丙烯酰胺凝胶分离蛋白样品,电泳缓冲液为1×Tris-甘氨酸电极缓冲液,浓缩胶电压80 V,分离胶电压120 V。电泳结束后,取出分离胶,用考马斯亮蓝染液染色30 min,随后用脱色液脱色至透明。在全自动化学发光图像分析系统上拍照分析[17-18]。
1.2.5 马铃薯酯酰基水解粗酶液的制备 取冷冻干燥后得到的样品粉末用去离子水配制成6 mg/mL的蛋白液,转移至离心管中,3 000 r/min离心5 min,收集上清液作为试验用粗酶液。
1.2.6 酯酰基水解酶活性测定 参照Racusen[19]的方法,稍作修改。称取63 mg PNP-acrtate,溶解于10 mL乙醇中,从中取1 mL加99 mL去离子水定容至100 mL。反应体系包括:2.5 mL 0.1 mol/L Tris-HCl (pH 8.2)、2.5 mL PNP-acrtate稀释液和1 mL酶液。在37 ℃水浴中保温25 min后,加入6 mL 95%乙醇终止反应,冷却至室温后用紫外分光光度计在波长410 nm下测定吸光值(A410 nm)。每组试验独立重复3次,以每分钟A410 nm变化0.01为一个酶活力单位(U),按式(1)计算酶比活。
(1)
式中:
U——酶比活,U/(min·mg·蛋白);
△A——反应时间内吸光值的变化值;
W——样品蛋白质的含量,mg;
T——反应时间,min。
1.2.7 酶反应温度对酯酰基水解酶的影响 固定pH为8.2,酶反应时间25 min,考察酶反应温度(25,30,35,37,40,45,50,55,60 ℃)对马铃薯酯酰基水解酶活性的影响。
1.2.8 酶反应时间对酯酰基水解酶的影响 固定pH为8.2,酶反应温度37 ℃,考察酶反应时间(5,10,15,20,25,30,35,40,45 min)对马铃薯酯酰基水解酶活性的影响。
1.2.9 pH对酯酰基水解酶活性的影响 固定酶反应温度37 ℃,酶反应时间25 min,考察pH(4.0,5.0,6.0,7.0,8.0)对马铃薯酯酰基水解酶活性的影响。
1.2.10 酯酰基水解酶热稳定性的测定 固定pH为8.2,将酶液分别在40,50,60,70,80,90 ℃水浴中保温10,30,60,90,120,180 min,然后测定酶活性。
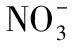
(2)
式中:
c——相对酶活,%;
m——试验测定酶活,U;
n——最大酶活,U。
1.3 数据处理
使用SPSS数据统计软件对试验数据进行单因素方差分析,采用Graphpad Prism 6.0软件绘图。每个试验重复3次,取平均值作为试验结果。计算显著性P(取α=0.05),以P<0.05为差异有显著性。
2 结果与分析
2.1 马铃薯粗蛋白的色谱分离及Patatin鉴定
马铃薯粗蛋白按照1.2.2方法提取制备后,再经过Q-Sepharose Fast Flow阴离子交换色谱柱分离,得到3个色谱分离峰(见图1)。与孙莹等[16]得出的马铃薯粗蛋白离子交换色谱图进行对比分析,初步判断3号峰是目的蛋白所在峰。收集3号峰洗脱液,浓缩并对其进行电泳分析,结果见图2。由图2可知,峰3在41~42 kDa 相对分子量位置有一条主要的蛋白质条带,与文献[20]中所得到的马铃薯Patatin的蛋白分子量基本一致,说明经过Q-Sepharose Fast Flow阴离子交换色谱柱分离并用1 mol/L NaCl的20 mmol/L磷酸盐缓冲液(pH 7)洗脱液洗脱下来的组分中含有Patatin这一目的蛋白,并从条带的相对灰度来看,该蛋白的相对含量达到90%以上。因此,后续以该组分为主要研究对象进行马铃薯酯酰基水解酶的特性分析。

图1 马铃薯粗蛋白离子交换色谱
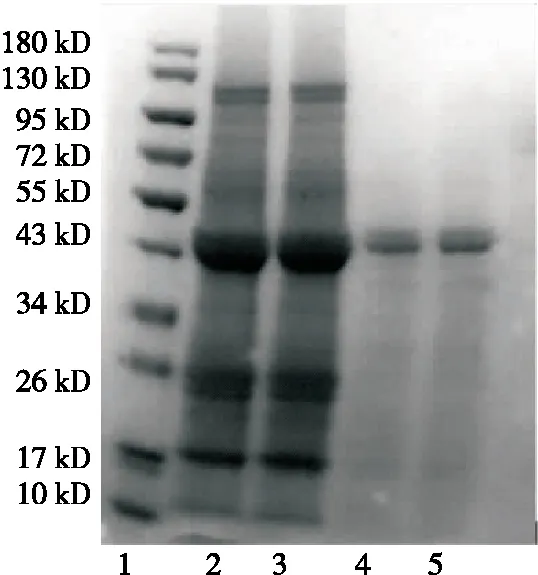
1. 标记Marker 2~3. 马铃薯粗蛋白 3~4. 阴离子柱层析蛋白
图2 Q-Sepharose fast flow离子交换层析组分的SDS-PAGE图谱
Figure 2 SDS-PAGE of the fraction by Q-Sepharose fast flow ion-exchange chromatography
2.2 酶反应温度对马铃薯酯酰基水解酶活性的影响
图3结果表明,马铃薯酯酰基水解酶在25~37 ℃时,其活性随着温度的升高逐渐提高(P<0.05),在37 ℃时活性达到最大,之后酯酰基水解酶的活性随着温度升高呈现下降的趋势(P<0.05)。因此,马铃薯酯酰基水解酶的最适反应温度为37 ℃。在Racusen等[21]的研究中,马铃薯酯酰基水解酶的最适酶反应温度为25~35 ℃,与试验结果有稍许差异,可能是由于使用了不同的马铃薯品种和提取方式得到了亚基组成不同的Patatin。马铃薯酯酰基水解酶本质是一类活性蛋白质,温度过高导致蛋白变性,从而部分或全部失去水解活性。在常态下,天然Patatin的二级结构中含有46%的β-折叠和33%的α-螺旋,并且Patatin在原始状态下是一种三级结构稳定的球状蛋白,色氨酸包埋在其疏水内核中。当Patatin所处体系中温度低于45 ℃时,其二级结构保持不变。当体系温度在45~55 ℃时,Patatin中α-螺旋含量下降,三级结构开始发生变化,内部的色氨酸逐渐向外暴露[22]。当体系温度超过55 ℃时,α-螺旋含量迅速下降,无规则卷曲结构占据主导地位[23]。Creusot等[24]研究表明,Patatin的变性温度为59 ℃,比其他蛋白例如β-乳球蛋白、大豆蛋白的低20 ℃,可能是因为Patatin分子内缺乏稳定的二硫键。
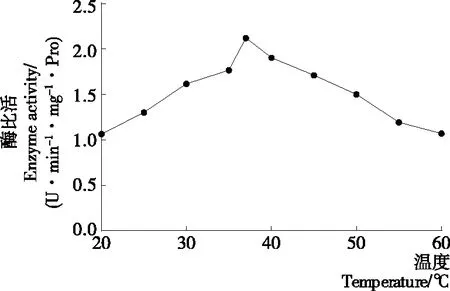
图3 温度对马铃薯酯酰基水解酶活性的影响
2.3 酶反应时间对马铃薯酯酰基水解酶的影响
从图4可以看出,随着酶反应时间的增加,马铃薯酯酰基水解酶的活性呈现增加的趋势(P<0.05),当时间超过25 min以后,底物与酶的作用趋于饱和状态,酶的活力保持平缓,甚至略有下降(P>0.05)。因此马铃薯酯酰基水解酶水解底物的最适酶反应时间应为25 min。
2.4 pH对马铃薯酯酰基水解酶活性的影响
从图5可以看出,前期马铃薯酯酰基水解酶的水解活力随着pH的增大而增大(P<0.05),当pH达到8.2时,酶水解活力达到最大值,之后随着pH的增大而减小(P<0.05),因此最适pH为8.2。Pots等[25]研究表明,酸性条件下,Patatin的蛋白结构不可逆变性从而导致酶活性部分损失。当pH<4.5,即低于等电点时,由于天冬氨酸和谷氨酸残基质子化,Patatin的净电荷变为阳性,这种静电相互作用的改变造成了Patatin的部分去折叠,此时Patatin二级结构的α-螺旋和β-折叠含量比较低。当pH为5时,Patatin的三级结构发生不可逆转的改变。pH为6~8时,其构象是最稳定的。当pH>8时,Patatin二级结构中的α-螺旋含量低于20%,无规则卷曲结构含量逐渐上升[26]。酶分子的活性中心与可解离基团的结合状态一般随着体系溶液pH的变化而变化,影响酶和底物的结合,最适pH条件下,酶分子部位的活性基团可以与底物结合,发挥出最大的酶效力。当pH过高或者过低时,酶的构象会在一定程度上发生改变,导致酶活性的部分或全部丧失。Gambuti等[27]将Patatin作为一种澄清剂添加到葡萄酒中,研究其去除涩味的能力。由于等电点值低于红酒的pH值,Patatin在葡萄酒中的溶解度较低,其在发挥澄清剂的作用后,易于分离且不造成影响。通过研究pH值对马铃薯酯酰基水解酶活性的影响,可以为将Patatin作为食品添加剂应用于食品工业中提供理论指导。
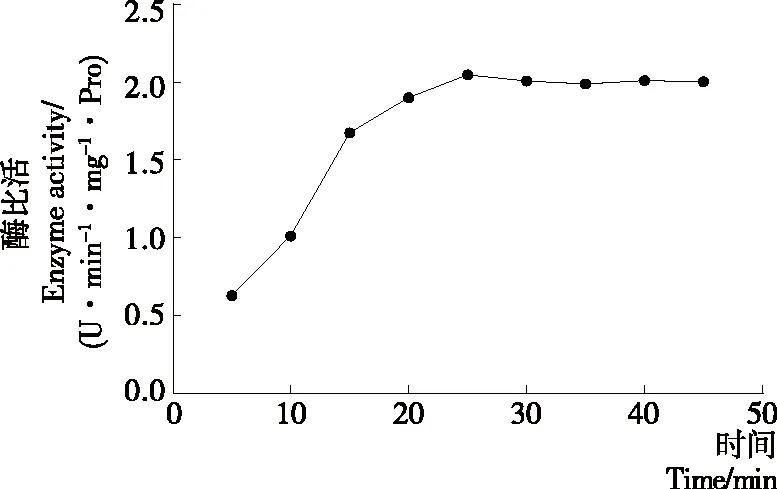
图4 时间对马铃薯酯酰基水解活性的影响
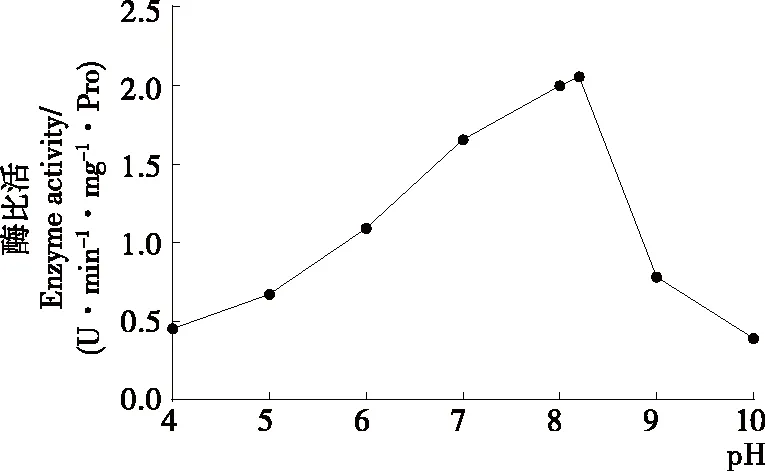
图5 pH对马铃薯酯酰基水解酶活性的影响
2.5 马铃薯酯酰基水解酶的热稳定性
从图6中可以看出,在40 ℃下酯酰基水解酶的活性未出现明显的下降(P>0.05);在50,60,70,80,90 ℃保温10 min后,酶活性均显著下降(P<0.05)。其中,在50 ℃下处理10 min时酶活力为未处理的56%,处理180 min 后酶活力为未处理的13%;在60 ℃下处理10 min 时酶活力仅为未处理的29%,处理180 min后酶活力仅为未处理的13%;在70 ℃下处理120 min、80 ℃下处理90 min、90 ℃下处理60 min后,酶的活性接近于丧失。说明热处理温度对于酯酰基水解酶的活性有较大的影响,并且当热处理温度低于50 ℃时有较好的稳定性。马铃薯酯酰基水解酶的活性不仅与热处理温度有关,与热处理时间也有着密切的关联。Patatin的变性温度在59 ℃左右,当处理温度低于40 ℃时,马铃薯酯酰基水解酶的结构与温度的变化之间没有明显的相关性,低温长时间处理不会大幅度降低马铃薯酯酰基水解酶的活性;当处理温度超过50 ℃以后,短时间的处理也会大大降低马铃薯酯酰基水解酶的活性。Patatin可以水解奶酪中水溶性强、疏水性小的甘油三酯,释放可以提高风味的游离脂肪酸。研究[28]发现,使用巴氏杀菌法来处理成熟后奶酪,Patatin会失去活性,并且能产生较低水平的副反应。
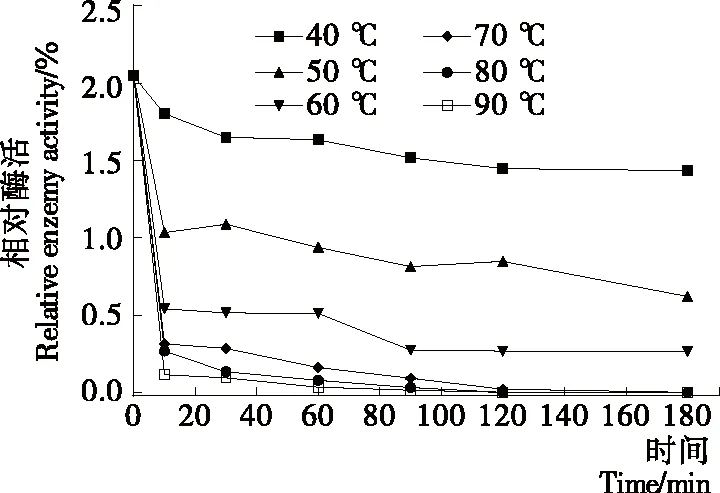
图6 马铃薯酯酰基水解酶的热稳定性
2.6 金属离子对马铃薯酯酰基水解酶活性的影响
从图7可以看出,不同类型的金属离子对酰基水解酶的活性影响是不同的。在反应体系中添加Fe2+、Fe3+、Mg2+可以提高酶的活性,其中Fe2+可以明显提高酯酰基水解酶的活性。在反应体系中添加Na+对酯酰基水解酶的活性没有促进或抑制作用。添加K+、Ca2+能降低酯酰基水解酶的活性,其中5 mmol/L K+的抑制作用是10 mmol/L K+的两倍;低浓度和高浓度的Ca2+均明显降低了酯酰基水解酶的活性。不同浓度的Al3+和Zn2+对酯酰基水解酶呈现出不同的影响作用,5 mmol/L Al3+对于酶活性有促进作用,而10 mmol/L Al3+对酶活则没有明显影响。5 mmol/L Zn2+对于酶活有促进作用,而10 mmol/L Zn2+则抑制了酶的水解活力。金属离子通过与酶活性部位的结合来影响酶的活力,不同种类和浓度的金属离子对酶的结构和功能起到不同的作用[29],因此对酶解过程的影响不同。一般来说,低浓度的金属离子与酶通过非特异性的静电相互作用,而高浓度的金属离子对酶结构的稳定性通常会产生不利的影响[30]。Fe2+、Fe3+、Mg2+、5 mmol/L Al3+、5 mmol/L Zn2+对马铃薯酯酰基水解酶的活性有促进作用,可能是因为这些金属离子能与Patatin的特定部位结合,改变了酶催化反应平衡性质和马铃薯酯酰基水解酶的表面电荷。K+、Ca2+抑制了马铃薯酯酰基水解酶的活性,可能是由于这两种金属离子使Patatin活性中心的空间结构发生改变,降低了其分解底物的能力[31]。10 mmol/L Zn2+降低了马铃薯酯酰基水解酶的活性,可能是由于过量的Zn2+与Patatain活性中心发生了相互作用,并且与活性中心的金属离子发生了置换反应,生成了新的配位化合物,从而影响了马铃薯酯类酰基水解酶对底物的分解[32]。
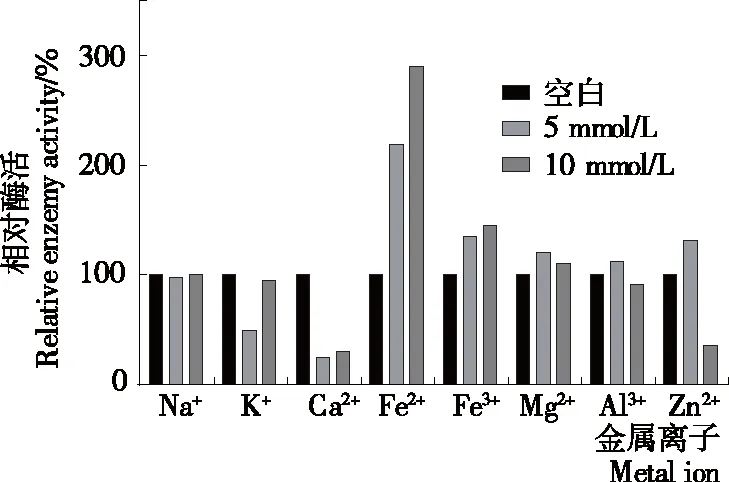
图7 金属离子对马铃薯酯酰基水解酶活性的影响
3 结论
试验从模拟生产废水中提取分离马铃薯粗蛋白,对影响马铃薯酯酰基水解酶活性的因素进行研究。结果表明,马铃薯酯酰基水解酶在37 ℃时具有较高的活性,且在pH为8.2的条件中维持水解反应10 min时,水解活性较高;马铃薯酯酰基水解酶在40~50 ℃时具有一定的热稳定性,温度高于60 ℃以后,酶的活性开始陆续出现较大的损失;外源添加的不同金属离子对马铃薯酯酰基水解酶表现出不同的影响,例如K+和Ca2+对马铃薯酯酰基具有水解抑制作用,低浓度的Al3+和Zn2+促进了马铃薯酯酰基水解酶的水解作用,相反地,高浓度的Al3+和Zn2+对马铃薯酯酰基水解酶具有活性抑制作用。试验选取了单分散态脂肪对硝基苯乙酸酯为底物,探讨了不同酶反应条件对马铃薯酯酰基水解酶活性的影响。今后,可以从其他不同脂肪底物种类(单酰基或二酰基磷酸脂肪、单酰甘油、二酰甘油、半乳糖脂肪)入手,探讨不同酶反应条件对马铃薯酯酰基水解酶活性的影响,同时分析酶催化反应的动力学及热力学特征,为马铃薯酯酰基水解酶的深度研究和工业化应用提供更有力的理论依据。
