荞麦多酚在卤猪肉制品防腐保鲜中的应用
2019-12-19郝教敏杨文平靳明凯杨珍平徐向昕高志强
郝教敏,杨文平,靳明凯,杨珍平,徐向昕,高志强
(1.山西农业大学 食品科学与工程学院,山西 晋中 030801;2.华北理工大学 生命科学学院,河北 唐山 063210;3.山西农业大学 农学院,山西 晋中 030801)
酱卤肉制品是我国传统的一大类肉制品,因其工艺特点,致使肉品中含有较多的自由水,且原料肉猪肉的脂肪含量较高,所以,极易导致微生物大量生长繁殖,引起肉制品氧化酸败变质[1]。如何延长肉品货架期,减少原料浪费,是食品科技工作者一直不断研究的课题。关于肉制品的防腐保鲜有多种方法,如物理防腐、化学防腐、生物防腐等,各种方法各有优缺点[2-4]。与添加人工合成抗氧化剂防腐保鲜会对人体健康造成一定危害相比较,将从天然植物中提取抗氧化生物活性物质应用于肉制品的保鲜方法,因其安全、抑菌、低毒、高效而备受青睐[5,6]。植物多酚具有抗氧化、清除自由基的作用,可以预防并治疗心血管疾病,产生癌细胞阻断素,抗病毒等[7-10],其在腌腊肉制品与冷鲜肉中作为抗氧化剂的应用已有报道[11]。荞麦(FagopyrumesculentumM.)为一年生草本植物,有普通荞麦(甜荞麦)和鞑靼荞麦(苦荞麦)2种,年产量(66.0万吨)中国位居第二,在我国粮食作物中相对小麦和玉米等属于小宗作物。荞麦营养丰富,富含高生物价的蛋白质、矿物质和维生素等,特别是含有大量活性功能性成分——酚类物质,如酚酸、黄酮类及花青素等,还含有植物甾醇等[12]。纵观前人研究,荞麦多酚用于肉制品的抗氧化作用研究尚未见报道,因此,本研究以卤猪肉为实验材料,探讨荞麦多酚对卤猪肉防腐保鲜的影响,以期为开发利用荞麦多酚作为肉制品的新型抗氧化保鲜剂提供参考依据。
1 材料与方法
1.1 实验材料与仪器
1.1.1 实验原料
荞麦:山西农业大学农学实验室提供;猪肉:购于山西省太谷县家家利生鲜食店;香辛料:山西农业大学畜产实验室提供。
1.1.2 实验试剂
无水乙醇:天津市天力化学试剂有限公司;三氯乙酸、2-硫代巴比妥酸:国药集团化学试剂有限公司;丁基羟基茴香醚(butylated hydroxyanisole,BHA):成都化学试剂有限公司;乙二胺四乙酸:天津市东丽区天大化学试剂厂;三氯甲烷:天津基准化学试剂有限公司;氧化镁:天津市化学试剂三厂;硼酸:天津市登峰化学试剂厂;上述试剂均为分析纯。营养琼脂BR生物试剂:北京奥博星生物技术有限责任公司;二苯代苦味肼基自由基(1,1-diphenyl-2-picryhydrazyl,DPPH·):东京化成工业株式会社。
1.1.3 仪器设备
HCP-10型华晨高速多功能粉碎机 浙江省永康市金穗机械制造厂;RV数显D型旋转蒸发仪 广州和竺生物科技有限公司;PL3000型真空冷冻干燥机 北京水方仪涛贸易有限公司;DZKW-D-2型电热恒温水浴锅 天津市大港区红杉实验设备厂;723型可见分光光度计 上海菁华科技仪器有限公司;FA25型高剪切分散乳化机 上海弗鲁克流体机械制造有限公司;SP-XC-SDJ01型酸度计 晋中佳通机电科技有限公司;LD4-2A型低速离心机 北京雷勃尔离心机有限公司;HY-2型调速多用振荡器 常州国华电器有限公司;DGH-9243BS-3型电热恒温鼓风干燥箱 上海新苗医疗器械制造有限公司;BL-50型立式压力蒸汽灭菌锅 上海东亚压力容器制造有限公司;HPP-9272型电热恒温培养箱 北京东联哈尔仪器制造有限公司;DL-CJ-2F型超净工作台 松下电器产业株式会社;CPA型分析天平 北京赛多利斯仪器系统有限公司。
1.2 方法
1.2.1 荞麦多酚物质制备
取一定质量的荞麦籽粒,挑拣出其中的土块儿、碎石、杂草等杂质,放入多功能粉碎机中粉碎,得到荞麦粉。
按照课题组前期实验得到的荞麦多酚提取最优工艺制备荞麦多酚物质。选用50%无水乙醇作为浸提液,按荞麦粉与浸提液的比例为1∶12 (g/mL),在浸提温度65 ℃的恒温水浴锅里浸提64 min,离心,收集上清液。把上清液用旋转蒸发仪进行真空减压浓缩,将浓缩液体置于冻干机中冻干,取出冷冻干燥后的粉末,置于100 mL离心管中,封口,冷藏备用。
1.2.2 溶液配制
用无菌蒸馏水分别配制10 mg/mL BHA溶液及10,20,30 mg/mL不同浓度的荞麦多酚溶液。
1.2.3 原料肉处理

表1 腌制液与卤水配方Table 1 The formula of marinating solution and brine
将原料肉去除筋膜切块,按表1配方 腌制2 d后用清水洗净,煮沸10 min,期间不断捞取表面浮沫。取适量原汤加入配料(见表1),大火煮开至有香味溢出时,将肉放入汤内,改用小火,卤煮30 min。待肉冷却至不烫手,将卤猪肉切分成大小均匀的小块,随机分成5组,每组500 g,分别添加配制好的BHA溶液、荞麦多酚溶液、无菌蒸馏水(KB)浸泡,得到含BHA 0.2 g/kg、荞麦多酚0.2,0.4,0.6 g/kg和不添加任何抗氧化物质的肉样,真空包装。所有实验肉块均于4 ℃冰箱中保存。
1.2.4 指标测定
对冷藏的5组肉样,分别测定肉样初始及5,10,15,20,25,30 d的pH值、2-硫代巴比妥酸反应产物TBARS、总挥发性盐基氮TVB-N、细菌总数等指标。
pH值的测定:参照GB 5009.237-2016《食品安全国家标准 食品pH值的测定》方法[13]。评价标准:新鲜肉5.8~6.2,次鲜肉6.3~6.6,变质肉>6.7。
TBARS值的测定:参照GB 5009.181-2016《食品安全国家标准 食品中丙二醛的测定》方法[14]。评价标准:良质肉0.20~0.66 mg/kg,次质肉>1 mg/kg。
TVB-N值的测定:参照GB 5009.228-2016《食品安全国家标准 食品中挥发性盐基氮的测定》的半微量定氮法[15]。评价标准:一级鲜度≤15 mg/100 g,二级鲜度≤20 mg/100 g,变质肉>20 mg/100 g。
菌落总数的测定:参照国标GB 4789.2-2016《食品安全国家标准 食品微生物学检验 菌落总数测定》方法[16]。评价标准:新鲜肉<4 log CFU/g,次鲜肉4~6 log CFU/g,变质肉>6 log CFU/g。
1.2.5 DPPH·清除
准确称取肉样5 g剪碎,加入70%乙醇10 mL浸提15 min,以5000 r/min离心5 min,取上清液,用无水乙醇稀释10倍后备用。
取2.0 mL浸提液于不同的离心管中,每管加入1.0 mL无水乙醇、0.1 mmol/L DPPH·试剂 (以无水乙醇为溶剂)1.0 mL;另外,一个对照组加入3.0 mL无水乙醇和1.0 mL DPPH·试剂,另一个对照组加入2.0 mL无水乙醇和2.0 mL浸提液,各管强烈振荡后避光静置30 min,于517 nm处分别测定各反应的吸光度值,每个样品平行测定3次。按下式计算各待测样品对DPPH·的清除率。
清除率(%)=[1-(Ai-Aj)/Ac]×100。
式中:Ai为浸提液与DPPH·试剂混合液的吸光度值;Aj为浸提液与无水乙醇混合液的吸光度值;Ac为DPPH·试剂与无水乙醇混合液的吸光度值。
1.2.6 统计分析
将整理好的数据用Excel分析软件进行相关计算及绘图;用SPSS 22统计软件进行方差分析和多重比较。结果用平均值±标准差表示。
2 结果与分析
2.1 不同处理卤猪肉在贮藏过程中pH值的变化
影响肉质pH值的因素很多,如脂肪氧化、蛋白质分解、微生物生长繁殖与代谢等,它们之间互相作用,共同导致了pH值的变化。本研究中,在贮藏期间,对不同处理卤猪肉样的pH值进行测定,结果见图1。

图1 不同处理对贮藏期内卤猪肉pH值的影响Fig.1 Effects of different treatments on the pH value of marinated pork during storage period
由图1可知,各处理组的卤猪肉样pH值均在6.6以下,总体上呈现先下降后上升的趋势。0~20 d贮藏过程中卤猪肉pH值呈波动下降趋势,在贮藏20 d后,各组卤猪肉pH值呈波动上升趋势。主要的原因可能是在真空包装的贮藏条件下,厌氧菌、乳酸菌等产酸菌成长为优势菌,其分泌代谢产物——乙酸、乳酸致使肉样pH值下降[17],另外,微生物分泌的脂肪酶分解脂肪,产生游离的脂肪酸,也是肉样pH值下降的因素之一。随着贮藏时间的延长,肌肉蛋白质在微生物酶的作用下分解,产生胺类碱性物质,从而使肉样的pH值有一定程度的回升。与空白对照组相比,各荞麦多酚处理组具有抑菌作用。结果表明,荞麦多酚对卤猪肉有一定的防腐保鲜作用,但其保鲜效果不及人工抗氧化剂BHA的保鲜效果。
2.2 不同处理卤猪肉在贮藏过程中TBARS值的变化
在贮藏期间,对不同处理卤猪肉样的TBARS值进行测定,结果见图2。
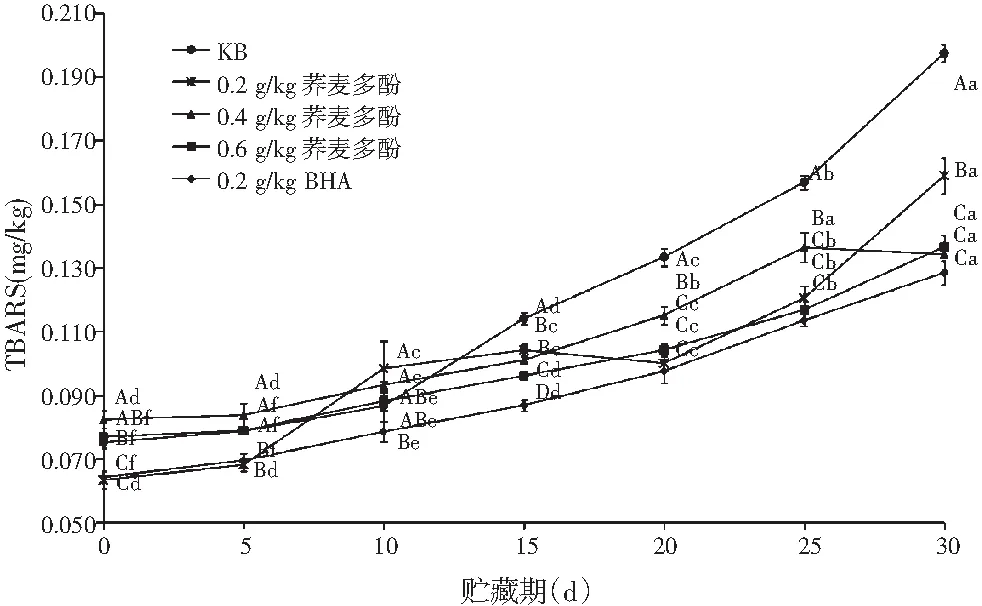
图2 不同处理对贮藏期内卤猪肉TBARS值的影响Fig.2 Effects of different treatments on the TBARS value of marinated pork during storage period
由图2可知,各处理组卤猪肉的TBARS值随贮藏期的延长呈上升趋势,在0~15 d,增加较为平缓,贮藏15 d后,增加趋势增大,油脂氧化速度加快。0.2 g/kg BHA组与其他各组比较,卤猪肉的TBARS值在整个贮藏期内均较低。贮藏时间超过15 d时,空白对照组(KB)与其他各组比较,卤猪肉的TBARS值显著增加(P<0.05)。在同一贮藏期,0.2 g/kg BHA组与0.6 g/kg荞麦多酚组卤猪肉的防腐保鲜效果显著优于其他3组(P<0.05)。荞麦多酚组较空白对照组显著抑制了卤猪肉TBARS的生成(P<0.05),且较高浓度的荞麦多酚组抑制效果更好,说明较高浓度的荞麦多酚有利于提高卤猪肉的脂质抗氧化能力。贮藏到第30天,各处理组卤猪肉的TBARS值均低于0.5 mg/kg,均无脂肪氧化酸败的不愉快气味[18]。可能是由于真空包装形成的缺氧环境,对脂肪氧化起到了很好的抑制作用。结果表明,荞麦多酚有一定的抗氧化作用,且较大浓度时,抗氧化效果更好。但在该实验浓度范围内其防腐保鲜效果不及BHA的保鲜效果。
2.3 不同处理卤猪肉在贮藏过程中TVB-N值的变化
在贮藏期间,对不同处理卤猪肉样的TVB-N值进行测定,结果见图3。

图3 不同处理对贮藏期内卤猪肉TVB-N值的影响Fig.3 Effects of different treatments on the TVB-N value of marinated pork during storage period
由图3可知,各处理组卤猪肉的TVB-N值随贮藏期的延长呈波动上升趋势,前期上升较平缓,在贮藏15 d之后,增长速率变大。在0~10 d,不同处理在同一贮藏期卤猪肉的TVB-N值差异不显著(P>0.05),可能是由于实验初期抗氧化物质浓度较高,抗氧化作用较强,肉样基本保持很低的腐败水平。0.2 g/kg BHA组与其他各组比较,卤猪肉的TVB-N值在整个贮藏期内均较低。空白对照组(KB)与其他各组比较,随贮藏期的延长,卤猪肉的TVB-N值均显著提高(P<0.05)。主要原因是在微生物与酶的共同作用下,蛋白质逐渐被分解为肽、氨基酸、胺、氮等小分子物质,使肉品品质劣变。结果表明,荞麦多酚对卤猪肉具有一定的防腐保鲜作用,随着浓度增大,保鲜效果增强。但在该实验浓度范围内其防腐保鲜效果不及BHA的保鲜效果。
2.4 不同处理卤猪肉在贮藏过程中菌落总数的变化
在贮藏期间,对不同处理卤猪肉样的菌落总数进行测定,结果见表2。
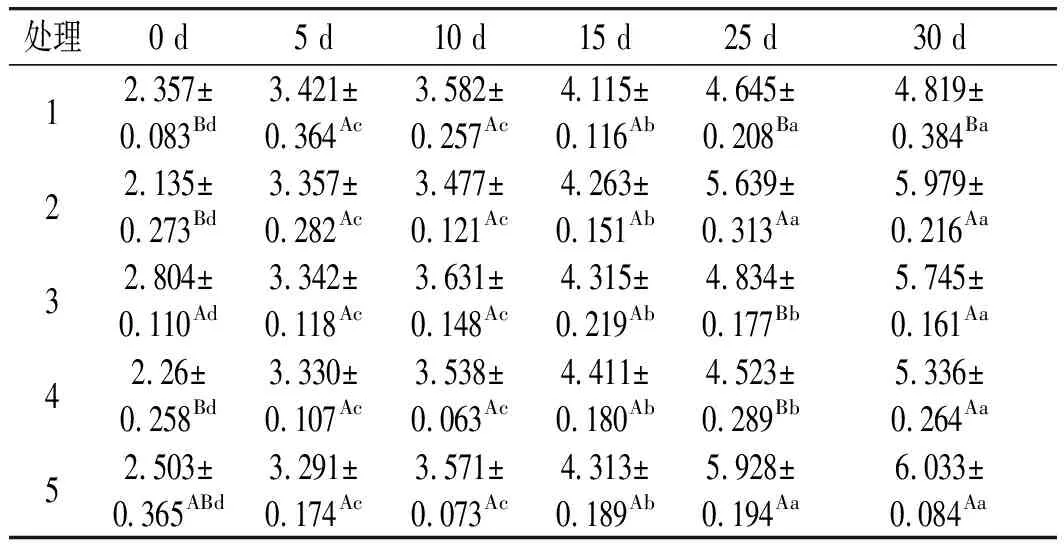
表2 不同处理对贮藏期内卤猪肉菌落总数的影响Table 2 Effects of different treatments on the total bacterialcolony count of marinated pork during storage period lg CFU/g
由表2可知,各处理组卤猪肉的菌落总数均随着贮藏时间的延长而显著增加(P<0.05)。贮藏到第25天,0.2 g/kg荞麦多酚组和空白对照组(KB)卤猪肉的菌落总数显著高于其他3组(P<0.05),且不符合国家熟肉制品微生物指标的最高安全限量值5 lg CFU/g[19];贮藏到第30天,除0.2 g/kg BHA组外,其余各组卤猪肉的菌落总数均超过国家标准最低要求。结果表明,较高浓度荞麦多酚对卤猪肉具有一定的防腐保鲜作用,但在该实验浓度范围内其防腐保鲜效果不及BHA的保鲜效果。
2.5 不同处理DPPH·清除率的变化
贮藏期间,不同处理下卤猪肉乙醇粗提物对DPPH·清除率的测定结果见图4。
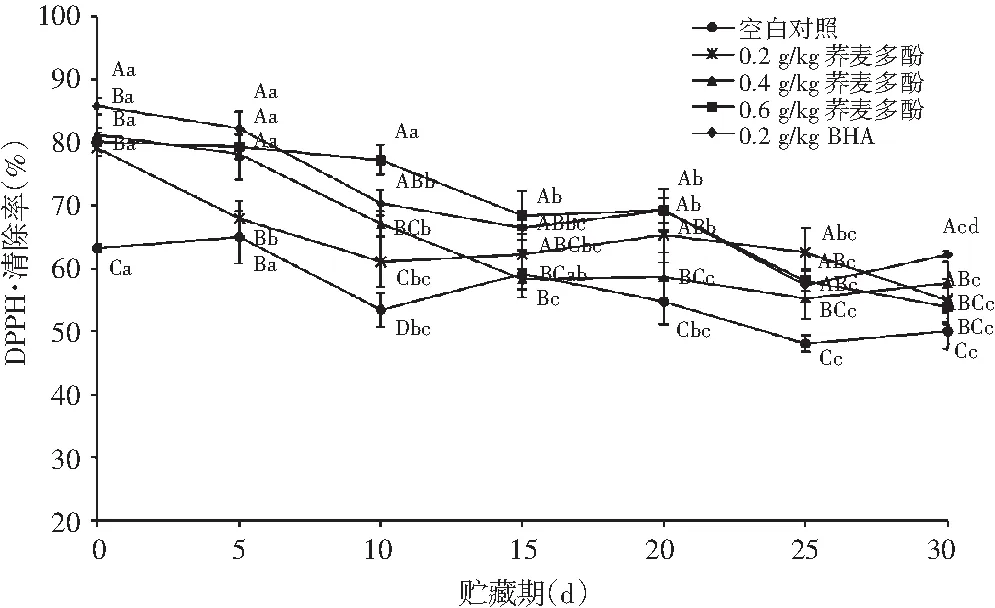
图4 不同处理下卤猪肉乙醇粗提物对贮存期内DPPH·清除率的影响Fig.4 Effects of ethanol crude extracts in marinated pork under different treatments on the scavenging rate of DPPH·during storage period
由图4可知,随着贮藏时间的延长,各组卤猪肉乙醇粗提物对DPPH·自由基的清除率总体上呈下降趋势(P<0.05),可能的原因是贮藏时间延长,卤猪肉中脂肪逐渐被氧化,生成一定量的自由基,实验中已添加的抗氧化物质逐步被消耗,因此肉样的乙醇粗提物对DPPH·的清除率逐步降低。贮藏到第25~30 d内,0.2 g/kg BHA组、0.4 g/kg荞麦多酚组、空白处理组(KB)DPPH·清除率上升的原因可能是前期多肽物质的积累与自由基发生歧化反应生成了抗氧化物质[20],对自由基的清除作用有一定的提高。空白对照组(KB)与其他各组相比,DPPH·清除率显著较低(P<0.05)。空白对照组(KB)表现出来的抗氧化性,可能是由于在卤制过程中添加于肉样中的香辛料以及贮藏过程中产生的多肽物质与自由基发生歧化反应生成了抗氧化物质所致的抗氧化作用。结果表明,荞麦多酚具有清除自由基的作用,其抗氧化作用随着浓度增大而逐渐增强,较高浓度荞麦多酚的抗氧化作用与0.2 g/kg BHA的抗氧化作用相当。
3 结论
本研究中,荞麦多酚处理卤猪肉,在4 ℃下真空包装冷藏,对卤猪肉有一定的防腐保鲜作用,能延长卤猪肉的货架期。随着荞麦多酚浓度增加,抗氧化保鲜作用更好。但在本研究范围内,荞麦多酚不及BHA的抗氧化效果好。本研究结果可以为开发安全、高效的食品保鲜剂提供参考依据。
