化浊通脉方对ox-LDL诱导的RAW264.7来源泡沫细胞胆固醇逆转运相关基因表达作用研究*
2019-12-18周庆兵徐凤芹
戎 光,周庆兵,李 婧,梅 俊,金 宇,徐凤芹
1.中国中医科学院西苑医院老年医学研究所(北京100091);2.广东省深圳市第二人民医院(深圳 518000)
心脑血管疾病在我国居于死亡原因的前两位,其中冠心病及中风的发病率和死亡率在某些地区呈上升态。两种疾病有着相同的病理基础,那就是动脉粥样硬化,但当冠心病及中风发作时,病变已经到了不可逆的严重阶段,所以早期诊断、早期干预具有重要意义。大量的证据表明动脉粥样硬化的发生有许多危险因素,包括高胆固醇血症、高血压、糖尿病、年龄因素和饮酒等,其中被认为最直接、最重要的因素是高胆固醇血症。多项临床研究表明,心脑血管疾病的发生率与高胆固醇血症的严重程度呈正相关。
动脉粥样硬化(Atherosclerosis,AS) 是许多缺血性心脑血管疾病共同的病理学基础[1],是一种慢性炎症性疾病,动脉管壁上形成散在的斑块是其主要特征,斑块的基本成分是脂质,单核细胞来源的巨噬细胞吞噬脂质后成为泡沫细胞,其在AS形成及发展中占有重要地位[2]。胆固醇逆向转运(Reverse cholesterol transport,RCT)是指胆固醇从外周细胞内流出,经血液循环转运到肝脏细胞中进行代谢并合成胆汁排出的过程。 RCT 能有效清除细胞中多余的胆固醇,与AS的发生及发展密切相关[3]。其中ATP 结合盒转运体Al(ATP-binding cassette transporter A1,ABCA1)、ABCG1、B 类I 型清道夫受体(Scavenger receptor class B type I,SR-BI)、过氧化物酶体增殖物激活受体-γ(Peroxisome proliferator-activated receptors-γ,PPAR-γ) 等基因在RCT过程中发挥重要作用,上述基因表达水平的高低对于AS的发展及治疗均具有重要作用,也是进行抗 AS 类药物研发的重要靶点[4]。动脉粥样硬化是现代医学名词,常和高脂血症同时存在,中医本无动脉粥样硬化的病名,但根据头晕、心慌、胸闷、痞满、健忘、肢体麻木等临床表现,可归于“痰浊”、“胸痹”、“眩晕”、“痴呆”等范畴。诸多医家因自身认识疾病的角度和经验不同,从痰论治、从瘀论治、补益脏器等治法及方药各不相同。吾师徐凤芹教授长期从事中西医结合治疗心血管疾病的临床工作,曾作为陈可冀院士学术继承人及陈可冀名医工作室负责人,与陈院士传承团队一起致力于总结陈院士的学术思想尤其是活血化瘀理论及通补理论,在此学术基础上,针对高脂血症合并动脉粥样硬化创新性提出:“脉浊”理论。吾师认为,此病病位在脉,病机为本虚标实,本虚即五脏及气血阴阳的亏虚,标实即痰、瘀、热、毒、浊等。徐凤芹教授以“脉浊”理论为依据,以化浊通脉治法为纲创立的化浊通脉方是治疗AS及高脂血症的成方。化浊通脉方由虎杖、山楂、郁金等六味中药组成,是中国中医科学院西苑医院徐凤芹教授临床治疗AS类疾病的经验方,能有效针对AS类疾病“湿、热、毒、瘀、虚”的病机特点。前期笔者所在课题组的动物实验表明,化浊通脉方能调节AS兔血脂水平,且与辛伐他汀作用相似,但是具体机制不明[5]。本实验观察化浊通脉方对 RAW264.7源性泡沫细胞形成过程中RCT相关主要基因的影响,从体外探索该方抗AS的分子生物学机制。
材料和方法
1 材 料
1.1 细胞培养:RAW264.7细胞株来源于北京协和细胞资源中心,将购得的细胞株分装冻存,剩余RAW264.7细胞在含有10%胎牛血清的DEME高糖培养液中静置于37.0℃、5%CO2恒温培养箱培养,视细胞状态更换培养液。当细胞融合成片至视野的70%~80%时,移入超净台;吸去培养瓶中残液,每瓶加胰酶1 ml,置孵箱孵育(37℃、5%CO2)3 min;细胞全部漂浮后,每瓶加10% FBS DMEM 1 ml终止,抽吸于离心管中,1000 r/min,离心2 min,而后以1∶3的比例进行细胞传代,平分于3个5 ml细胞培养瓶中培养。
1.2 化浊通脉方原液配置:化浊通脉方原液由我院制剂室配制,药物虎杖、荷叶、决明子各15 g,金樱子30 g,生山楂、郁金各20 g等,共1剂,以双蒸水300 ml浸泡30 min,大火烧开后转小火煎3 min,共得药液200 ml(0.575 g/ml,即每毫升药液含生药0.575 g),以滤纸过滤后再经过0.22 μm滤膜杀菌,分装保存于-20℃冰箱,使用前1 h室温下融化。给药前配制成不同质量浓度(稀释300倍:含化浊通脉方生药1.917 mg/ml;稀释120倍:含化浊通脉方生药4.792 mg/ml;稀释60倍:含化浊通脉方生药9.583 mg/ml)的受试液。化浊通脉方原液以该方君药虎杖中的大黄素和虎杖苷为质量控制指标,经HPLC检测,每毫升原液中含大黄素0.326 mg,含虎杖苷0.094 mg。
1.3 实验主要试剂:澳洲胎牛血清(Gibco公司,批号:1914970);DMEM 高糖培养液(美国Hyclone,批号:AGK568431);细胞活力检测试剂盒(CCK-8):(南京恩晶生物科技有限公司,批号E1CK- 00208);氧化性低密度脂蛋白(ox-LDL):(广东奕源生物科技有限公司,批号:2018-02-13);胰蛋白酶(南京恩晶生物科技有限公司,批号:EG20180129);油红O染色料、TRI试剂(美国Sigma-Aldrich公司,批号:SLB5248V);胆固醇检测试剂盒(北京普利莱基因技术有限公司提供,批号:E100520180228、E100620180224);逆转录试剂盒、荧光定量PCR试剂盒(北京天根生化科技有限公司,批号KR107)。
1.4 主要仪器及设备:超净工作台(哈尔滨市东联电子技术开发有限公司,型号:SCB-1360);恒温CO2培养箱(日本SANYO公司,型号:MCO-15AC);酶联免疫检测仪(美国BioTek公司,型号:Synergy H1);倒置相差显微镜(德国Leica公司,型号:DMIRB) ;低温离心机(德国Eppendorf公司,型号:Eppendorf centrifuge 5810R);荧光定量PCR仪(美国ABI公司,型号:7500)。
2 实验方法
2.1 建立泡沫细胞模型:所在课题组前期以80μg/ml
ox-LDL诱导RAW264.7细胞成功建立泡沫细胞模型[6],将RAW264.7细胞以浓度1.0×105个/ml种植于6孔板中,空白组、泡沫细胞组分别用含 10%FBS DMEM 及含80 μg/ml ox-LDL 、10%FBS DMEM培养液,各自培养24h后,培养液PBS 洗涤3次,4%多聚甲醛固定30 min后,吸出多聚甲醛溶液,再以 PBS 重复清洗2次后加入油红O染色液,30 min后弃去染液,自来水洗涤3次,倒置显微镜下察看并拍照记录。
2.2 CCK-8法细胞增殖抑制实验:调整RAW264.7细胞浓度为0.5×105个/ml,在96孔板中接种,加入含ox-LDL的DEME培养液4 μl,加入浓度为80 μg/ml的ox-LDL,再设置3个复孔,在处理组中同时加入10 μl浓度不同的经双蒸水稀释的化浊通脉方溶液,培养24h;从培养箱中取出96孔板,每孔分别加入CCK-8试剂10 μl,放回培养箱中共孵育2 h后,摇床摇匀3 min;在450nm波长处,酶标仪测定其光吸收值;上述实验重复3次。
2.3 酶法检测降脂效应:将试验细胞分为4组:模型组(80 μg/ml ox-LDL)、小剂量化浊通脉方组(80 μg/ml ox-LDL+稀释300倍原液)、中剂量化浊通脉方组(80 μg/ml ox-LDL加稀释120倍原液)、大剂量化浊通脉方组(80 μg/ml ox-LDL加稀释60倍原液)种植于96孔板中,孵育24 h后吸取培养液备用,PBS洗涤3次,裂解液裂解10 min,将裂解液转移至1.5 ml离心管中,BCA蛋白定量试剂盒测定蛋白质浓度,其后2000xg离心5 min,取上清液进行总胆固醇、游离胆固醇测定,具体按试剂盒说明书进行。
2.4 荧光实时定量PCR法检测:细胞浓度调为1.0×105个/ml,种植于6孔板中,按照2.3方法将细胞共分为4组,培养处理24 h后弃掉培养液,PBS清洗两次,每孔加入TRI试剂1 ml,提取细胞总RNA,逆转录试剂盒合成cDNA后-80℃保存。
引物序列:ABCA1引物:上游5’ -ACTTAGGGCACAATTCCACAAGA-3’,下游5’-CTCCTGTGGTGTTTCTGGATGA-3’;ABCG1引物:上游5’-TCACCCAGTTCTGCATCCTCTT-3’,下游5’- GCAGATGTGTCAGGACCGAGT -3’;SRBI引物:上游5’ -AACCGCAGCCTCCATTTC -3’,下游5’-CCGTTCCATTTGTCCACC- 3’;PPAR-γ引物:上游5’-AAGACCACTCGCATTCCT -3’,下游5’-CCACAGACTCGGCACTCA -3’;GAPDH引物:上游 5’- GTGTGAACGGATTTGGCCGT-3’,下游5’ GACAAGCTTCCCATTCTCGG 3’。
PCR反应条件为95℃ 1 min模板变性,95℃ 5秒PCR循环中模板变性,60℃ 15 s退火/延伸共40个循环。以甘油醛-3-磷酸脱氢酶 (GAPDH )为内参,以2-ΔΔCt计算各组基因相对表达量。
2.5 统计学方法:利用GraphPad Prism 4软件绘制试验剂量-效应曲线,利用单因素方差分析进行数据组间比较,P<0.05为差异有统计学意义。
结 果
1 泡沫细胞模型建立 油红O染色后置于光学显微镜下观察,光镜200倍放大。空白对照组的 RAW264.7 细胞未见着色; 80μg/ml ox-LDL 与 RAW264.7细胞共同孵育24 h后染色,在大部分细胞内侧可见聚集大量红色脂滴,聚集的红色脂滴超过整个细胞周长的2/3,泡沫化明显,符合泡沫细胞模型标准,本试验以 80μg/ml ox-LDL 作为诱导泡沫细胞模型的干预浓度,见图1。
2 化浊通脉方对RAW264.7来源泡沫细胞的增殖抑制作用 通过 CCK-8 法分析,化浊通脉方在稀释10-80倍区间对泡沫细胞有明显的抑制作用,提示该方对泡沫细胞有细胞毒作用。基于降低药物对于泡沫细胞的细胞毒作用这一考虑,本实验选取稀释化浊通脉方原液60倍、120倍、300倍作为后续实验浓度,见图2。
3 化浊通脉方对泡沫细胞总胆固醇的作用 大剂量化浊通脉方能够降低泡沫细胞内总胆固醇量(P=0.037);小剂量及中剂量化浊通脉方降脂效果均不明显,n=3,(P>0.05),见图3。
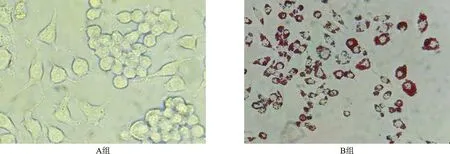
A:空白组;B:80μg/ml ox-LDL组
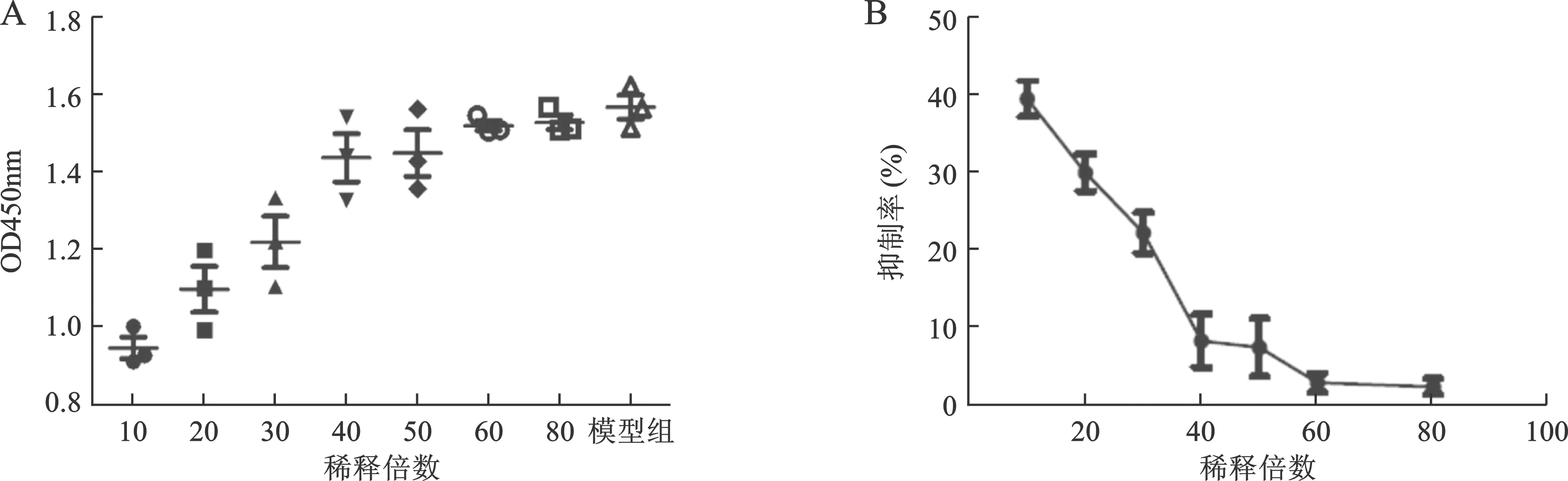
左图:不同浓度化浊通脉方对泡沫细胞作用的OD值比较(n=3);右图:化浊通脉方对泡沫细胞作用24h的剂量-效应曲线
图2 化浊通脉方对RAW264.7来源泡沫细胞抑制效应
4 ABCA1、SR-BI、ABCG1、PPAR-γ基因表达 RT-PCR检测显示,化浊通脉方能够提高 ABCA1 基因表达(P=0.044),该方60倍稀释后能提高 ABCA1 基因表达(P<0.05),120倍及300稀释能提高该基因表达(P>0.05),见图4A。对于 SRBI 基因,该方能够提高该基因表达(P=0.0028),以60倍稀释最为明显(P<0.05),120倍与300倍稀释组与模型组比较(P>0.05),见图4B。化浊通脉方对ABCG1基因表达无明显作用(P=0.26),见图4C。不同浓度化浊通脉方都能降低PPAR-γ表达(P=0.0006),见图4D。
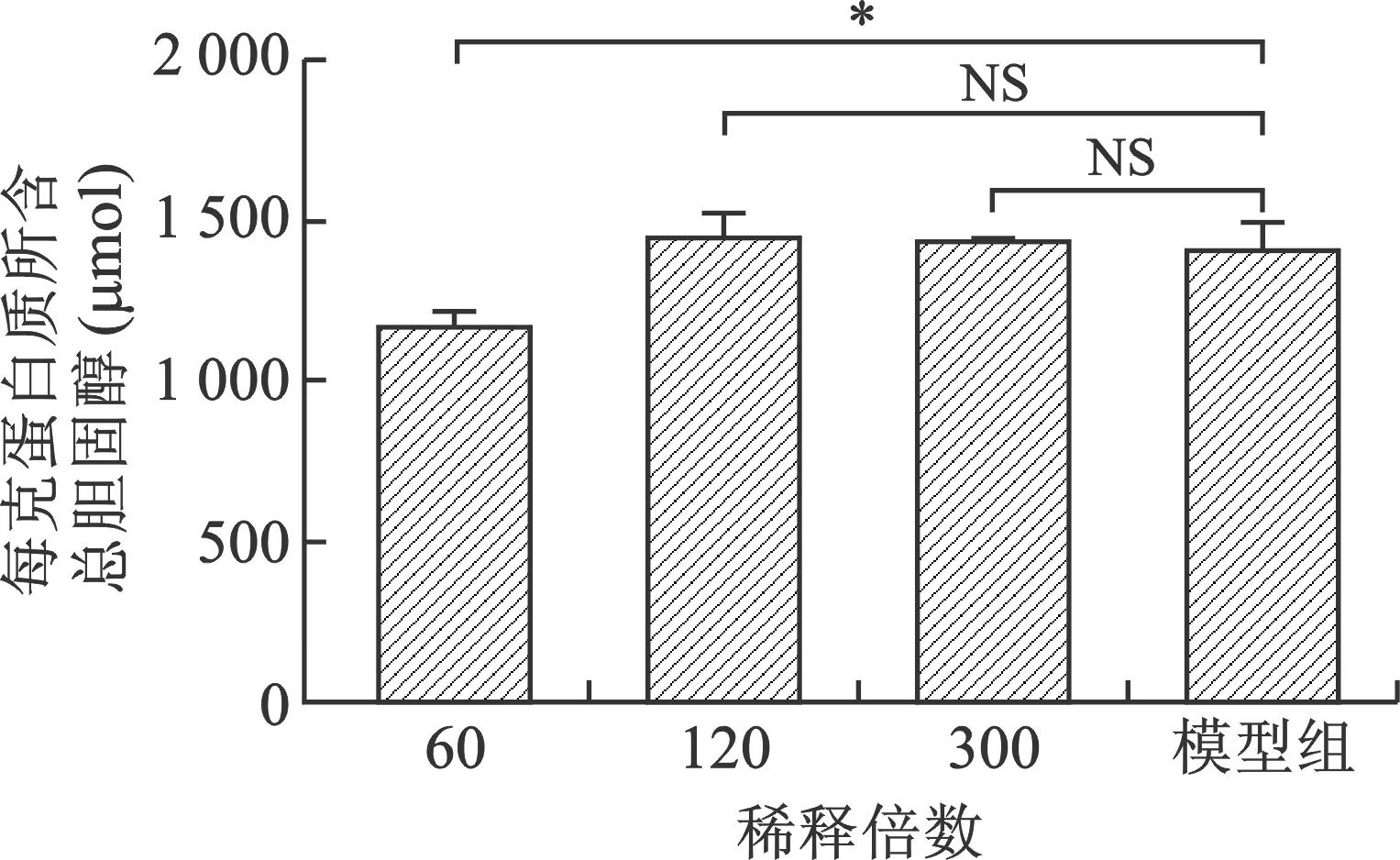
*:与模型组比较,P<0.05;NS :与模型组比较,P>0.05
图3 各组胆固醇含量比较

A:化浊通脉方对泡沫细胞ABCA1基因表达作用(n=3);B:化浊通脉方对泡沫细胞SR-BI基因表达作用(n=3);C:化浊通脉方对泡沫细胞ABCG1基因表达作用(n=3);D:化浊通脉方对泡沫细胞PPAR-γ基因表达作用(n=3)。*:与模型组比较,P<0.05;NS :与模型组比较,无统计学差异
图4 各组基因表达比较
讨 论
脂代谢异常是引起AS发病的主要因素之一,RCT对于恢复脂代谢异常具有重要意义。组织细胞胆固醇逆向转运(RCT)总起来说可以分广义和狭义两种,广义的RCT是指肝脏外的细胞如动脉血管平滑肌细胞和巨噬细胞内的胆固醇转运至细胞外,与血液中的高密度脂蛋白(High densityli poprotein,HDL)结合,再由HDL转运至肝脏代谢,经过肝肠循环后,最后变成一部分胆汁酸由粪便排出体外[7]。在这个过程中HDL参与的RCT主要分三个步骤:胆固醇从外周细胞中流出;HDL中胆固醇的酯化;HDL胆固醇酯的转运与清除[8]。狭义的RCT仅指胆固醇从平滑肌细胞和巨噬细胞等外周细胞内流出,从上述可知,HDL的形成和代谢贯穿了 RCT途径抗动脉粥样硬化的所有环节。
目前的研究表明,ABCA1、ABCG1、SR-BI以及PPAR-γ是参与细胞RCT过程的关键基因。细胞内的游离胆固醇转运到细胞外受体主要有以下3种途径[9]:膜孔扩散、易化扩散和主动转运,ABCA1、ABCG1介导了主动转运,SR-BI介导了易化扩散,PPAR-γ可通过调控介导胆固醇流出及血浆转运相关基因的表达而在胆固醇代谢中发挥重要作用,其通过ABCA1、SR-BI参与RCT[10]。
ABCA1和 ABCG1介导游离胆固醇流出的主动转运过程,即是ABCA1 ABCG1利用ATP提供的能量参与了胆固醇和磷脂从外周细胞内流出。细胞内外的脂质平素处于一个动态平衡,ABCA1的表达可以随着细胞内胆固醇增多而上调,研究证实ABCA1通过启动胆固醇逆向转运,在维持机体脂质平衡、清除多余脂质的过程中发挥重要作用[11]。ABCG1的表达增加则能够促进游离胆固醇和磷脂流出至成熟HDL,此外ABCG1还可以使细胞膜上的游离胆固醇发生重构,促进膜孔扩散[9]。以提高ABCA1或者ABCG1表达为目的的抗AS研究已有报告,如有学者发现苦瓜蛋白能够抑制小鼠AS斑块形成,并且能够降低小鼠血清总胆固醇与低密度脂蛋白胆固醇水平,体外实验证实苦瓜蛋白通过显著上调ABCA1蛋白表达实现抗AS效应[12-13]。在本研究中,化浊通脉方能够增加ABCA1基因表达,尤其以大剂量最为明显,而对于ABCG1,化浊通脉方无明显作用。
SR-BI介导了细胞内游离胆固醇转运到细胞外的易化扩散。SR-BI是位于细胞膜上的同源低聚糖蛋白,它能够识别并结合HDL中载脂蛋白的α螺旋结构并形成有一定功效的复合物,并能够转变成横跨细胞膜内外的疏水孔道,辅助游离胆固醇通过,从而促进了胆固醇由HDL转运至细胞外[14]。此外,在广义胆固醇逆向转运过程中,肝脏摄取血液中胆固醇主要通过SR-BI,SR-BI选择性摄取 HDL中的游离胆固醇及胆固醇酯,在胆固醇 7α-羟化酶等一系列酶的作用下被摄取进入肝脏的胆固醇生成胆汁酸[15]。因而SR-BI也可作为抗AS药物研究的靶点之一,贾连群等研究发现,化瘀祛痰方能够显著降低AS小鼠血清胆固醇、胆固醇酯以及低密度脂蛋白,其机制可能和提高肝脏SR-BI、肝脏低密度脂蛋白受体(LDL-R)、胆固醇7α-羟化酶(CYP7A1)基因表达有关[16]。在本次研究中,我们也发现化浊通脉方能够提高SR-BI基因表达,且以大剂量最为明显,提示SR-BI基因是化浊通脉方的又一重要靶点。
PPAR-γ是一种核激素受体(Nuclear hormone recptor),已知的PPAR受体共有3 个亚型,分别是α、β以及γ,PPAR-γ是被研究最深入的亚型,已有研究显示PPAR激动剂能有效治疗AS类疾病,但有严重的副作用或者致癌风险。如PPAR-γ激动剂罗格列酮因其心血管风险于2011年被EMA和美国FDA从市场上暂停和限用[17],在动物实验中吡格列酮被发现可导致膀胱肿瘤,流行病学调查发现吡格列酮有诱发膀胱癌的风险[18-19]。另一方面,最近有研究报告显示PPAR抑制剂对于肝癌具有治疗作用[20-21]。在本次研究中,大、中、小剂量化浊通脉方能够明显抑制PPAR-γ的表达,提示化浊通脉方抗AS效应可能是通过提高ABCA1和SR-BI得以实现。
基于RCT在胆固醇代谢中的重要地位[22],本研究结果初步证明了化浊通脉方能提高泡沫细胞中胆固醇逆转运关键基因ABCA1、SR-BI的表达从而实现抗AS效应。同时意外的发现化浊通脉方能够抑制PPAR-γ,这显示了本方具有复杂的作用特点。结合PPAR激动剂具有潜在致癌效应以及PPAR抑制剂的抗肿瘤作用,我们推断化浊通脉方可能在抗AS效应的基础上有抗癌的作用,而其具有的抑制PPAR基因表达的作用也是未来值得进一步研究的方向。
