N-乙酰半胱氨酸腹腔注射对LPS诱导小鼠急性肺损伤的预防作用观察
2019-12-17冯艳王荣丽
冯艳,王荣丽
(西南医科大学附属医院,四川泸州 646000)
急性肺损伤(ALI)是多种因素引起的弥漫性肺实质损伤,也是全身炎症反应综合征或多器官功能障碍综合征在肺部的典型表现,其特点是肺泡-毛细血管屏障损伤所造成的弥散性肺泡损伤及肺间质水肿,炎症细胞浸润及炎症介质过量表达和释放[1,2]。ALI的机制错综复杂,尚未完全阐明,但越来越多的证据表明多种信号通路及相关的蛋白可调节ALI的炎症反应[3]。丝裂原活化蛋白激酶(MAPK)是一类丝/苏氨酸蛋白激酶,普遍存在于真核细胞,高度进化保守,能够被多种因素激活。JNK属于MAPK家族成员之一,是一种应急激活的蛋白激酶(SAPK),参与许多炎症信号的转导。N-乙酰半胱氨酸(NAC)作为祛痰药广泛应用于临床,其是一种含有巯基的化合物,能裂断痰液中黏蛋白的二硫键(SS),将黏蛋白分解,降低痰的黏滞[4]。除此之外,NAC还有抗氧化、抗炎作用[5,6]。Mao等[7]发现NAC通过TLR-4 / NF-κB 信号通路减轻LPS诱导的急性肺损伤程度。张艰等[8]发现NAC对ALI的炎症抑制可能是通过抑制p38MAPK的激活起作用。NAC能否通过JNK信号通路对LPS诱导的ALI发挥保护性调控,鲜见报道。2019年2~5月,本研究通过建立LPS诱导的ALI模型探讨NAC对ALI的预防作用,并进一步探讨其机制。
1 材料与方法
1.1 动物、试剂、仪器 30只BALB/c 雌性小鼠,体质量19~23 g,购于重庆莱彼特生物科技有限公司,自由饮食、普通光照饲养于西南医科大学动物实验中心。动物实验的开展取得了西南医科大学实验动物伦理委员会批准。NAC购于大连美仑生物公司;脂多糖购于Sigma;MPO检测试剂盒购于南京建成生化试剂公司;小鼠血管细胞黏附分子(VCAM)ELISA试剂盒购于武汉科鹿生物科技公司;小鼠TNF-α ELISA 试剂盒购于武汉科鹿生物科技公司;Western blotting相关试剂购于武汉拜意尔生物科技有限公司;水合氯醛购于厦门海标科技有限公司。酶标仪购于Diatek公司;电泳仪及电泳槽购于北京市六一仪器厂;台式离心机购于上海安亭科学仪器厂;冷冻离心机购于湖南湘仪实验室仪器开发有限公司。
1.2 NAC腹腔注射及小鼠ALI模型制作 30只BALB/c雌性小鼠,随机分为5组:NAC 1、2、3组,模型组,对照组,各组分别为6只。参照文献[9]鼻孔滴入10 μg LPS制作ALI模型。各组均以水合氯醛腹腔麻醉。对照组鼻孔滴入50 μL PBS,模型组小鼠鼻孔滴入LPS 10 μg (LPS溶于50 μL的PBS溶液中)。NAC 1、2、3组分别腹腔注射NAC 100、200、300 mg/kg,0.5 h后小鼠鼻孔滴入LPS 10 μg。各组小鼠于滴鼻处理后7 h被处死。颈椎脱臼法处死小鼠后,取出双肺,右肺上叶测定肺干湿重比(W/D),取左肺经4%甲醛液固定行病理组织学检查,取右肺中叶检测MPO、VCAM-1、TNF-α,取右肺下叶检测pJNK蛋白。
1.3 小鼠肺组织病理变化观察及肺W/D测算 采用HE染色观察小鼠肺组织病理。小鼠左肺组织采用4%多聚甲醛进行固定,常规脱水、透明、浸蜡、包埋、切片,后进行HE染色,使用200倍光学显微镜下对小鼠肺组织病理学情况进行记录。取小鼠右肺组织,将肺组织表面的水分和血液用滤纸吸干后称W,置于70 ℃烘烤箱内烘干48 h至恒重,计算肺组织W/D。
1.4 小鼠肺组织MPO 、TNF-及VCAM-1检测 取小鼠肺组织,使用匀浆器充分匀浆(冰上操作),10 000 r/min离心10 min,收集离心后上清,即为肺脏组织匀浆液。采用ELISA方法,根据MPO试剂盒说明书的操作步骤测定匀浆液在480 nm处的吸光度值(OD值),根据吸光度值计算不同肺脏组织的MPO活性。计算公式:MPO活性=(测定OD值-对照OD值)/11.3×取样量(克)。采用ELISA法检测肺组织匀浆中TNF-α、VCAM-1,用酶标仪在450 nm 波长下测定吸光度(OD 值),通过标准曲线计算肺组织TNF-α、VCAM-1的浓度。
1.5 小鼠肺组织p-JNK蛋白检测 采用Western blotting法。肺组织块用PBS漂洗,制成匀浆,提取并测定蛋白浓度。配制SDS-PAGE 浓缩胶、SDS-PAGE分离胶,按浓缩胶80 V、分离胶120 V进行恒压电泳。准备转膜滤纸和PVDF膜,恒流转膜。将转好的膜加入封闭液,室温封闭。除去封闭液,加入以下一抗:抗GAPDH 单克隆抗体,抗p-JNK抗体,过夜。然后将膜在室温下与驴抗兔二抗一起温育,随后用TBST洗涤4次。滴加ECL混合溶液到膜的蛋白面侧,暗室中曝光。胶片进行扫描存档,使用 GAPDH 作为参考,AlphaEaseFC软件处理系统分析目标带OD值。
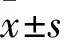
2 结果
2.1 肺组织大体病理表现及肺W/D 对照组肺组织结构清晰,肺泡间隔无增宽,可见少量炎性细浸润。模型组肺组织损伤严重,肺泡间隔增宽,肺组织间质及肺泡腔可见大量炎细胞浸润;NAC预处理的各组肺组织相对模型组随剂量增加损伤程度减轻;NAC3组光镜下可见肺泡壁多数完整,肺泡隔较模型组明显变窄,肺组织炎性细胞浸润明显减少。NAC 1、2、3组,模型组,对照组肺W/D分别为7.20±0.49、6.04±0.62、5.02±0.42、7.93±0.69、4.36±0.20。与对照组相比,模型组肺组织W/D升高(P<0.001);与模型组相比,NAC 1 、2、3组肺W/D降低(P均<0.05),且NAC1、2、3组之间两两比较,P均<0.05。
2.2 各组肺组织MPO活性、TNF-α含量 、VCAM-1含量及p-JNK蛋白表达比较 与对照组相比,模型组肺组织MPO活性,TNF-α、VCAM-1含量,p-JNK蛋白相对表达量升高(P<0.001);与模型组相比,NAC 1 、2、3组肺组织MPO活性,TNF-α、VCAM-1含量,p-JNK蛋白相对表达量降低(P均<0.05),NAC 1、2、3组肺组织MPO活性、TNF-α含量、p-JNK蛋白相对表达量之间两两比较,P均<0.05。NAC 各组VCAM-1含量两两比较:NAC 1组与3组、2与3组之间比较,P均<0.05;NAC1、2组之间比较,P>0.05。见表1。
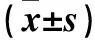
表1 各组肺组织MPO活性,TNF-α、VCAM-1含量及p-JNK蛋白相对表达量
3 讨论
ALI是由严重感染、创伤、休克、中毒、吸入性有害气体、急性胰腺炎等引起的急性进行性呼吸衰竭[9,10]。其病理生理机制表现为肺泡-毛细血管屏障损伤、炎症、氧化损伤和肺泡细胞凋亡[2]。在 ALI 炎症过程中,炎症细胞在肺内大量积聚浸润,炎症介质过度释放、活化和抗炎因子相对减少,引发体内炎症反应失衡。此外,炎性细胞因子和趋化因子可以募集中性粒细胞和其他炎性细胞,以进一步释放促进肺部炎症的炎性因子和细胞因子,导致 ALI 的发展。目前ALI的治疗干预措施,如低潮气量通气或俯卧位,主要是支持或旨在通过机械通气避免额外的肺损伤[11]。然而,机械通气不能够逆转ALI患者病情,且由于ALI患者肺脏病变不均一,仍有部分患者会出现呼吸机相关肺损伤,进而使得病情恶化[12]。NAC是一种具有抗炎特性的含硫醇抗氧化剂[6]。本研究采用LPS滴鼻建立ALI动物模型。研究结果发现,NAC预处理能够减轻LPS诱导的ALI,降低了W/D、MPO活性,抑制了炎性细胞因子TNF-α、黏附分子VCAM-1的分泌以及JNK的磷酸化。NAC预处理能够减轻LPS诱导的ALI肺组织病理损伤,表明NAC对ALI产生了有效的保护作用。
肺泡屏障功能的破坏,导致对水、蛋白质和其他溶质的渗透性增加,是临床和实验性 ALI 的标志[13]。在动物研究[14]中,肺血管通透性可以根据肺组织样品的W/D来评估。本研究结果发现,NAC能够显著降低W/D,且呈剂量依赖性降低,表明NAC可改善肺微血管通透性,抑制浆液向肺组织的渗漏。
白细胞浸润,特别是中性粒细胞浸润是LPS 损伤后的肺部炎症的特征[15]。中性粒细胞激活后从脉管系统迁移到肺泡腔内,导致炎性细胞因子水平升高,促进肺损伤的发展和持续[16]。MPO是中性粒细胞粒细胞中的一种丰富的酶,可产生次氯酸,用于杀死入侵的细菌,因此,MPO活性反映了中性粒细胞的浸润数目和活性[17]。本研究结果发现NAC可显著降低MPO活性,表明NAC可抑制中性粒细胞浸润,改善小鼠肺损伤程度。TNF-是ALI早期阶段的生物标志物,可引发炎症级联反应,引起血管内皮细胞损伤,并诱导肺泡上皮细胞产生其他细胞因子,如IL-6[18]。实验中,NAC干预可使肺组织中TNF-α分泌水平明显降低,呈剂量依赖性降低,表明NAC显著抑制TNF-α的分泌,来改善ALI小鼠的炎症反应。中性粒细胞向发炎肺部的迁移是由多种因素介导的,其中细胞黏附分子和趋化因子被认为是最重要的因素[19]。外周血中性粒细胞通过VCAM-1透过肺泡毛细血管屏障募集到发炎的肺组织中[20]。VCAM-1主要由血管内皮细胞表达。正常生理条件下,肺血管内皮细胞不表达或者仅少量表达VCAM-1,内毒素、促炎因子等刺激致黏附分子大量表达[21]。经NAC干预后,VCAM-1的表达显著降低,并呈剂量依赖性降低,表明NAC可以降低黏附分子的表达,减轻VCAM-1所介导的中性粒细胞在肺组织中的募集和锚定,从而减轻ALI。
MAPK家族的成员主要包括JNK,细胞外信号调节激酶(ERK)和p38MAPK。MAPK信号转导通路高度进化保守,能够对不同的刺激做出协调和整合,调控着细胞的生长繁殖、分化、成熟、凋亡等过程,也是细胞内触发炎性反应的主要通路。JNK一旦被激活则成为p-JNK,其包含双磷酸化的功能区与c-Jun N端的活化区结合,使其第63、73位丝氨酸残基磷酸化。c-Jun是转录因子活化蛋白1(AP-1)的组成部分,而活化的AP-1是与应激和炎症有关基因的关键反式激活剂。本研究结果发现,LPS诱导ALI小鼠的肺组织中JNK磷酸化明显增强,肺组织炎症介质升高,且模型组的p-JNK表达量最大,肺组织炎症介质含量最高,提示JNK信号通路参与了LPS诱导的ALI炎症反应。为了明确NAC对LPS诱导ALI的保护性作用是否是通过JNK信号通路来实现的,我们给予3种不同剂量NAC预处理ALI大鼠,结果发现NAC预处理组p-JNK蛋白表达均有不同程度的减少,且呈剂量依赖性方式降低,表明NAC能够抑制JNK的磷酸化。JNK生物学活性是在其磷酸化状态下实现的,NAC可能通过抑制p-JNK表达在一定程度上抑制LPS诱导的ALI炎症反应。
综上所述, NAC能够通过减轻ALI小鼠肺水肿,中性粒细胞浸润及TNF-α、VCAM-1的表达发挥有效保护作用;NAC能够抑制LPS诱导的ALI小鼠JNK信号通路的激活。NAC可能通过抑制JNK信号通路对LPS诱导的ALI发挥保护性作用。
