EZH1/2抑制剂UNC1999对肝癌细胞的影响
2019-12-17唐秀鑫邓小红辛晓萍何晓顺黄俊琪
唐秀鑫,邓小红,辛晓萍,李 劼,何晓顺,黄俊琪
(中山大学附属第一医院器官移植科//广东省器官捐献与移植免疫重点科实验室//广东省器官移植国际科技合作基地,广东 广州 510080)
原发性肝癌是常见的、高死亡率的消化道恶性肿瘤,其病理类型绝大部分为肝细胞肝癌(hepatocellular carcinoma,HCC)[1]。在全球癌症病例中,HCC 发病率居第6 位,死亡率居第4 位[2]。中国是肝病大国,HCC 在我国的死亡率更是高居第2 位[3]。HCC 难以早期发现、极易发生转移是治疗难关。目前肝癌的治疗方法包括手术切除、局部消融、肝动脉化疗栓塞等外科治疗及免疫治疗,外科治疗由于癌细胞可早期经血循环转移而容易复发;免疫治疗虽取得了一定进展,但仍然存在某些不良事件[4-6]。所以,直接靶向肿瘤的药物治疗是一个值得研究的突破口。Zeste 增强子同源物1(enhancer Zeste of homolog 1,EZH1)和Zeste 增强子同源物2(enhancer Zeste of homolog 2,EZH2),均是多梳蛋白抑制复合物2(polycomb repressive complex 2,PRC2)中具有催化功能的亚基,能够通过催化组蛋白H3 的第27 位赖氨酸(H3K27)的甲基化,进而调控相关基因,介导转录沉默[7]。PRC2已被报道与多种肿瘤密切相关[8-10],EZH1/2 作为PCR2 重要的组成成分,也参与了多种肿瘤的发生发展[11-13],其中包括肝癌[14-15]。EZH1/2 在不同疾病中具有重要作用[16-19],因此已有多种特异性抑制EZH1/2 活性的抑制剂被开发出来,用于多种疾病发生发展机制的辅助研究。UNC1999 是一个EZH1/2 特异性双重抑制剂[19],对EZH1 与EZH2 的抑制效率相差不大,已被报道能抑制多种肿瘤[20-21]。那么,EZH1/2抑制剂UNC1999是否能发挥抗肝癌作用?以及其中的作用机制如何?因此,我们想通过探讨该新的药物对肝癌的影响及作用机制,为肝癌的药物治疗方案提供新的参考。
1 材料与方法
1.1 材 料
肝癌细胞SMMC-7721 来源于中国科学院干细胞库;DMEM 培养基、PBS 缓冲液、青链霉素、胎牛血清及胰酶均为Gibco 产品;EdU 细胞增殖检测试剂盒、细胞凋亡试剂盒及细胞周期试剂盒均为Solarbio 产品;qRT-PCR 引物为英潍捷基产品;cDNA 逆转录试剂盒、SYBR Premix ExTaqTMⅡ、CCK-8 试剂盒及Western blot 所用到抗体分别购自Thermo Scientific、Takara、日本同仁及Abcam 公司。
1.2 方 法
1.2.1 细胞培养 使用含体积分数100 mL/L 胎牛血清及体积分数1%双抗的DMEM 高糖培养基培养肝癌细胞SMMC-7721(培养条件为37 ℃、体积分数5%CO2)。
1.2.2 CCK-8 实验 将细胞悬液以2 500 个/孔的密度铺于96 孔板,每孔100 μL,37 ℃、体积分数5%CO2培养24 h 至细胞贴壁。由于两种药物均溶于DMSO,因此实验设为DMSO 组、UNC1999 组,分别加入终浓度梯度为0、10、15、20 μmol/L 的DMSO 溶液、UNC1999 药液,并分别作用0、12、24、36 h。后每孔加入CCK-8 试剂10 μL,37 ℃孵育0.5 h,后置于450 nm 下检测每孔OD 值。
1.2.3 EdU 细胞增殖实验 接种细胞于96 孔板,每孔1×105个,每组设置6 个复孔,培养24 h 至贴壁,分别加入两种药物15 μmol/L,作用12 h 后终止,弃去培养基。每孔加入50 μmol/L EdU-培养基共100 μL,培养2 h 进行标记,后弃去上清。PBS 清洗2 遍,每次5 min。每孔加入50 μL 细胞固定液(含40 g/L多聚甲醛的PBS),室温孵育30 min,弃固定液。每孔加入50 μL,2 mg/mL 甘氨酸,摇床孵育5 min,弃甘氨酸溶液。每孔加入100 μL PBS,脱色摇床清洗5 min,弃PBS。每孔加入100 μL 渗透剂(含体积分数0.5% Triton X-100 的PBS)脱色摇床孵育10 min,PBS 清洗1 次,5 min。每孔加入100 μL 1X Apollo 染色反应液,避光、室温、脱色摇床30 min,弃染色反应液。加入每孔加入100 μL 渗透剂脱色摇床清洗3 次,每次5 min,弃渗透剂。每孔加入100 μL 1X Hoechst 33342 反应液,避光、室温、脱色摇床30 min,弃染色反应液。每孔100 μL PBS 清洗3 次。最后于荧光显微镜下进行观测。
1.2.4 平板克隆形成实验 以每孔500 个细胞接种于6 孔板中,置于37 ℃、体积分数5% CO2培养箱中,静置培养24 h至细胞贴壁。分别加入两种药物15 μmol/L,作用12 h 后终止。之后每3 d 更换一次培养基,直至出现肉眼可见的细胞克隆便终止培养。75%乙醇固定20 min,后用质量分数0.1%结晶紫染色30 min,置于缓慢水流下洗去结晶紫,晾干后拍照。
1.2.5 划痕实验 将细胞以5×105个/孔的密度接种于6孔板中,置于37 ℃体积分数为5%CO2培养箱中,静置培养24 h至细胞贴壁。分别加入两种药物15 μmol/L,作用12 h后终止,弃去培养基,更换为无血清的培养基。使用无菌的200 μL 枪头的尖端在孔中垂直划3条平行直线,PBS轻轻清洗3次以去除脱落细胞,培养72 h 后,于倒置显微镜下拍照。
1.2.6 Transwell 法侵袭、迁移实验 侵袭实验:于Transwell 小室内铺上100 μL 基质胶(浓度为250 μg/L),待胶凝固。用无血清培养基将细胞制成单细胞悬液,并调整密度至5×105/mL。在小室外加入600 μL的含体积分数10%FBS的DMEM培养基,在小室中加入200 μL的细胞悬液,置于37 ℃、体积分数5%CO2培养箱中12 h。后分别加入两种药物15 μmol/L,作用12 h 后终止。取出小室,弃去小室内外的培养液,用棉签轻轻擦去未迁移的细胞,用无钙PBS 洗2 遍,再用棉签轻轻擦拭一遍。75%乙醇固定20 min,适当风干。质量分数0.1%结晶紫染色,室温过夜。在显微镜下选择5 个具有代表性的视野,进行拍照、计数。迁移实验:不需预先铺胶,其余同侵袭实验。
1.2.7 流式细胞术检测细胞凋亡 以5×105个细胞/每孔将细胞接种于培养皿中,置于37 ℃体积分数为5% CO2培养箱中,静置培养24 h 至细胞贴壁。分别加入两种药物15 μmol/L,作用12 h 后终止,弃去培养基,消化细胞得到细胞沉淀。将细胞沉淀重悬在1 mL binding buffer 中,37 ℃孵育10 min,1 000 r/min(r=145 mm)离心5 min,去除上清,按照说明书分别加入染色试剂Annexin V/PI。室温避光孵育15 min 后加入binding buffer,于1 h内上机检测。
1.2.8 流式细胞术检测细胞周期 以5×105个细胞/每皿将细胞接种于培养皿中,置于37 ℃体积分数5% CO2培养箱中,静置培养24 h 至细胞贴壁。分别加入两种药物15 μmol/L,作用12 h 后终止,弃去培养基,消化细胞得到细胞沉淀。将细胞沉淀样品轻轻弹散,加入适量预冷的体积分数75%~80%乙醇。样品置于-20 ℃固定过夜。1 000 r/min(r=145 mm)、4 ℃离心10 min后,应用预冷PBS 重悬,洗1~2 遍。按照说明书加入0.5 mL染色剂PI,室温避光孵育15~30 min,后上机检测。
1.2.9 RNA-seq 将DMSO 处理的细胞为对照组,UNC1999 处理的细胞为处理组(作用浓度与作用时间同样分别为15 μmol/L、12 h),各3 个生物学重复,每样品约含有1×107个细胞,提取总RNA 后使用Illumina 高通量测序平台进行转录组测序。得到每个样品的序列表达量之后,使用edgeR 分析每个比较组中的差异基因。用BH方法对P值进行多重假设检验校正。将FDR≤0.05 且|log2FC|≥1的基因作为候选的差异表达基因。并且对差异基因进行GO 注释分类和KEGG 富集分析,探测差异基因的生物学意义。
1.2.10 实时荧光定量PCR 法 使用Trizol 提取细胞总RNA,后按照说明书进行实时荧光定量PCR 法,上机程序为:95 ℃5 s,60 ℃30 s,共做40个PCR 循环。引物序列如下示(5′-3′):GAPDH(GGGAAACTGTGGCGTGAT)、EZH2(CCCTGACCTCTGTCTTACTTGTGGA)、EZH1(GCTTCCTTCACCCTTTTCATGCCACCC)、NECTIN4(GCATCTACGTCTGCCATGTCAG)。
1.2.11 Western Blot 使用蛋白抽提试剂盒提取细胞蛋白,并用BCA 法测浓度。于聚丙烯酰胺凝胶中电泳,PVDF 膜电转,封闭完毕孵育一抗4 ℃过夜:β-actin(1∶1 000)、EZH1(1∶1 000)、EZH2(1∶500)、H3K27me3(1∶500);PBST 洗膜后孵育二抗1 h,再洗膜。ECl 化学发光液显色后于化学发光成像分析系统仪器中曝光。
1.3 统计学分析
实验数据均使用Graphpad Prism 5.0 软件进行统计。两组间比较,数据呈正态分布且方差齐的数据采用t检验;呈正态分布但方差不齐的数据采用校正t检验。多组间比较数据呈正态分布且方差齐,采用完全随机设计的方差分析,实验组与对照组比较采用Dunnett′t检验,检验为双侧检验。其中P<0.05 为差异具有统计学意义。
2 结果
2.1 UNC1999 抑制肝癌细胞的活力
将终浓度为0、10、15、20 μmol/L浓度的DMSO、UNC1999 分别作用0、12、24、36 h 至肝癌细胞SMMC-7721,CCK-8 法检测细胞OD450nm值,筛选UNC1999 的较佳作用浓度及时间。综合考虑后,选择UNC1999 较佳作用浓度及时间分别为15 μmol/L、12 h(F=125.3,P=0.0000),将该结果作为后续的所有实验的处理条件。该处理条件与DMSO 组相比,OD450nm值差异具有统计学意义(t=5.132,P=0.0068;图1)。
2.2 UNC1999 抑 制SMMC-7721 的增殖和 克 隆形成能力
进行EdU 和平板克隆形成实验,进一步检测UNC1999 对细胞增殖和克隆形成能力的影响。通过比较DMSO 组(图2A)与UNC1999 组(图2B)阳性细胞的比例,发现UNC1999 组的细胞增殖比例降低,差异具有统计学意义(t=12.730,P=0.0002;图2C)。将DMSO 组(图2D)与UNC1999组(图2E)的细胞克隆数量进行比较后,结果为UNC1999 组的细胞克隆数量减少(t=3.138,P=0.0349;图2F)。
2.3 UNC1999 抑制肝癌细胞的迁移能力

图1 UNC1999 抑制SMMC-7721 的活力Fig.1 The decreased cell viability of SMMC-7721 after UNC1999 treatment
为探究UNC1999 是否对SMMC-7721 的迁移能力产生影响,进行划痕实验,分别观察在划痕0 h(图3A,B)以及72 h(图3C,D)后细胞的迁移情况。发现相对于DMSO(图3C),UNC1999 组(图3D)中SMMC-7721 的划痕距离增大,差异具有统计学意义(t=4.341,P=0.0049;图3E)。
2.4 UNC1999 抑制肝癌细胞的侵袭及迁移能力
继续对SMMC-7721 的迁移、侵袭能力进行Transwell 实验的验证。通过对比两组间细胞的侵袭及迁移数量,发现UNC1999(图4B)比DMSO 组(图4A)的侵袭数量减少,差异具有统计学意义(t=3.882,P=0.0178,图4E);同时UNC1999 组(图4D)比DMSO 组(图4C)迁移数量减少,差异具有统计学意义(t=10.630,P=0.0004;图4F)。
2.5 UNC1999 对肝癌细胞凋亡无显著影响
为探讨UNC1999 对SMMC-7721 细胞凋亡情况的影响,采用流式细胞术进行检测。检测的结果包括流式细胞术结果图(图5A,B)、结果统计图(图5C,D)。相比DMSO(图5A),UNC1999 的早期凋亡比例(t=1.707,P=0.1186)及晚期凋亡比例(t=1.663,P=0.1308)均无显著改变,差异无统计学差异(图5C-D)。
2.6 UNC1999 影响肝癌细胞的细胞周期
肿瘤细胞的异质性之一体现在其细胞周期的变异,为再进一步探究UNC1999 是否通过影响肿瘤细胞的细胞周期来发挥作用,我们进行流式细胞术检测细胞周期的情况。结果发现:与对照组相比(图6A),UNC1999 组(图6B)出现G0/1 期比例增加(t=5.186,P=0.0066,图6C)、S 期比例降低(t=6.766,P=0.0025;图6D),差异具有统计学意义。
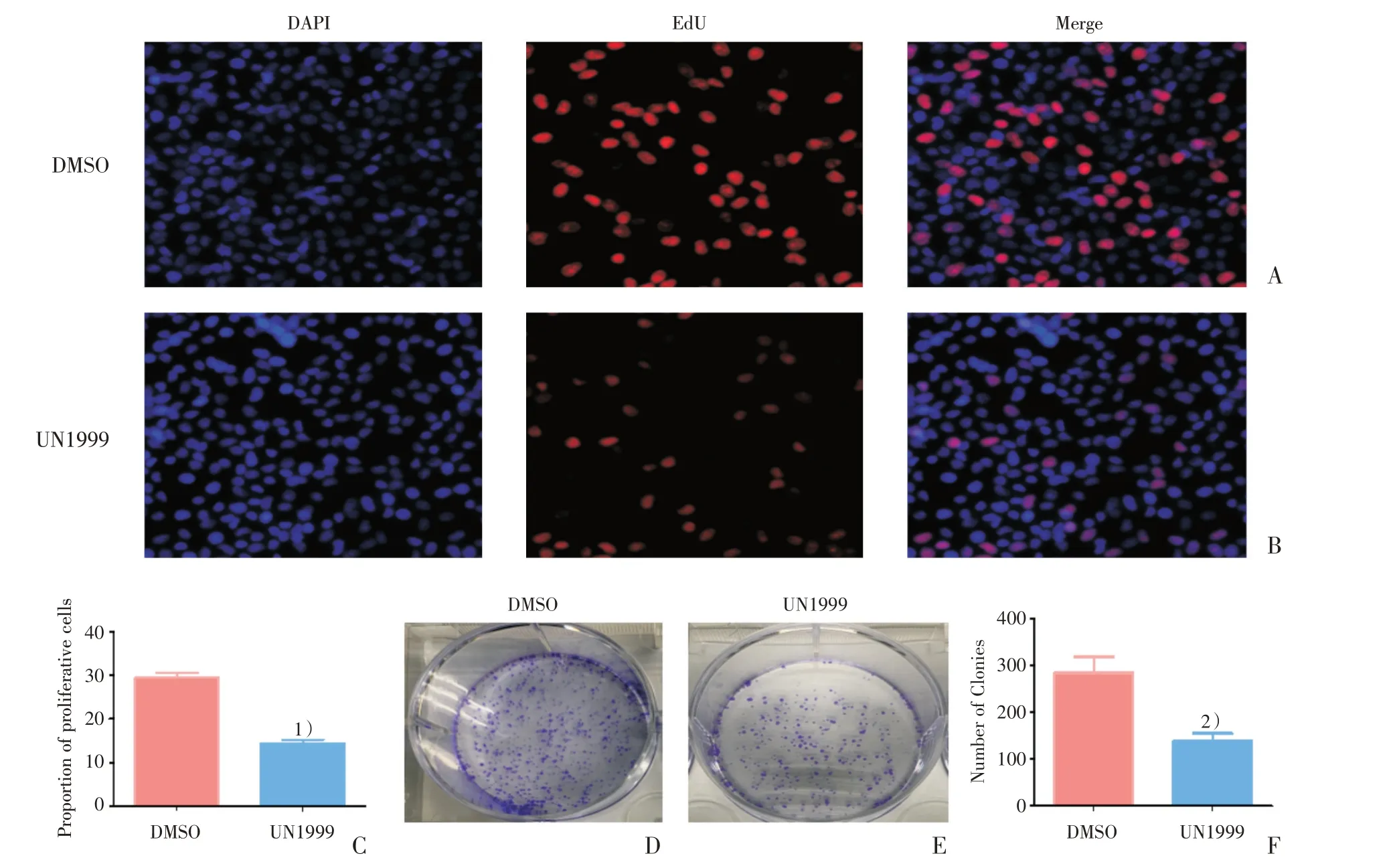
图2 UNC1999 抑制SMMC-7721 的增殖和克隆形成能力Fig.2 UNC1999 inhibited cell growth and colony formation of SMMC-7721
2.7 UNC1999 处 理SMMC-7721 后细胞转 录 组变化情况检测与分析
通过一系列的细胞实验,我们发现UNC1999能够抑制肝癌的多种生物学功能,为进一步研究UNC1999 发挥功能的机制,进行了RNA-seq 检测分析。将样品所测得的序列与所选的参考序列进行比对,统计序列与每一个参考序列的比对结果,如表1 所示。并对两组之间基因的转录情况进行统计比较,以期探究UNC1999 处理后对SMMC-7721 基因表达的影响,结果发现某些基因出现显著性改变(表2、3)。同时对UNC1999 作用的两个基因EZH1及EZH2基因进行统计(表4),检测药物在转录水平上对两个基因的影响情况。进而,通过对两组细胞的转录组学结果进行基因差异分析及富集分析,图7A 为差异表达基因的火山图,每个点代表一个基因,图中红色的点代表统计检验显出差异的基因;图7B 为上下调差异基因分别富集在生物过程(BP)、细胞组分(CC)和分子功能(MF)的情况;图7C 分析统计了差异基因富集的通路所在的级别——A 级(代谢);图7D 为差异基因KEGG富集的点图,点的大小表示此通路中差异表达基因个数多少,而点的颜色对应于不同的P值范围。分析统计结果发现:与DMSO 组相比,UNC1999 处理后SMMC-7721 存在某些的基因转录差异;差异的基因富集在细胞代谢、细胞粘附结合、细胞免疫应激等多个功能种类上(图7B~D)。[备注:FPKM(fragments Per Kilobase per Million mapped reads)为每百万序列中来自某一基因每千碱基长度的片段。FDR 是对P值做多重校正后的值。]
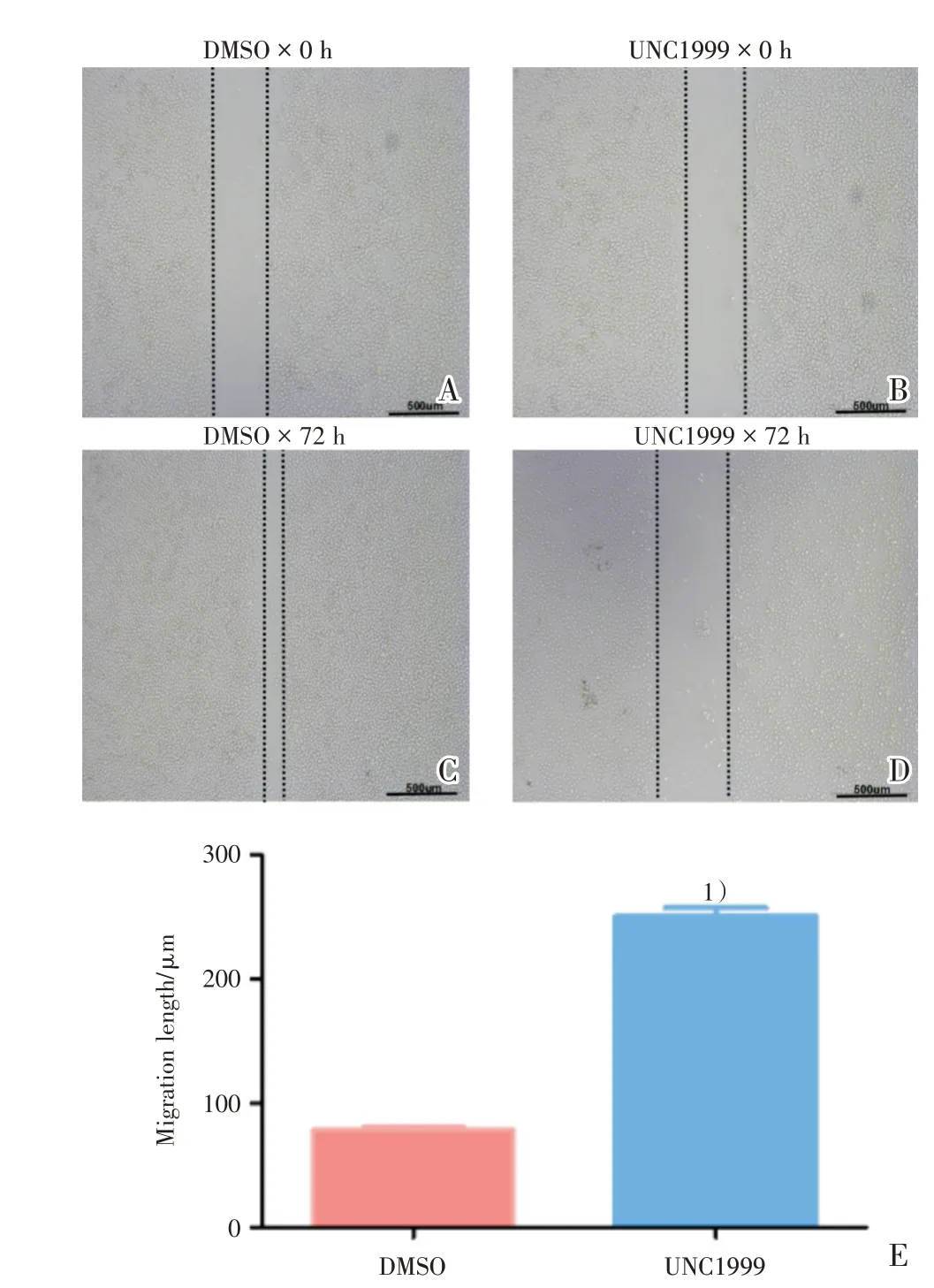
图3 UNC1999 抑制SMMC-7721 的迁移能力Fig.3 The decreased migration ability of SMMC-7721 after UNC1999 treatment
2.8 UNC1999 促进肝癌细胞NECTIN4 的表达
在分析了两组细胞转录学结果之后,发现UNC1999 在转录水平并未影响EZH1及EZH2的表达水平,于是使用qRT-PCR 进行验证;同时发现UNC1999 处理后,SMMC-7721 首位显著上调的基因为NECTIN4(ENSG00000143217),该基因与肿瘤细胞的药物敏感性有关,这引起了我们的注意,遂同样采用qRT-PCR 进行验证。结果发现:与DMSO 组对比,UNC1999 组的EZH1(t=2.279,P=0.0849;图8A)与EZH2(图8B)基因相对表达水平无明显改变(t=1.608,P=0.1832,P>0.05),与转录组学结果一致;NECTIN4(t=8.239,P=0.0012;图8C)基因相对表达水平上调明显,差异具有统计学意义(P<0.05)。
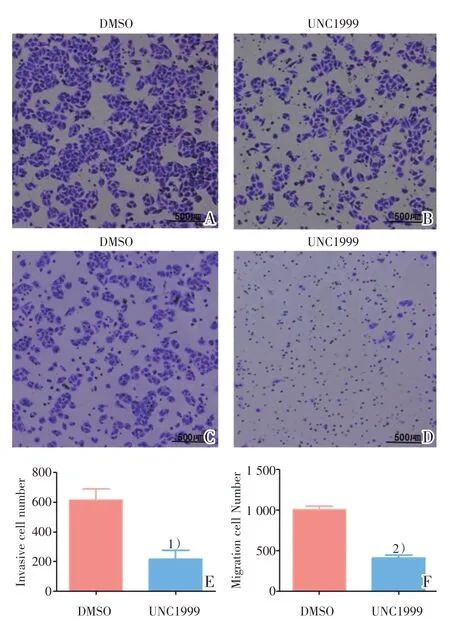
图4 UNC1999 抑制SMMC-7721 的侵袭及迁移能力Fig.4 The inhibited invasive and migrated ability of SMMC-7721 after UNC1999 treatment
2.9 UNC1999抑制肝癌细胞EZH1、EZH2、H3K27me3 的表达
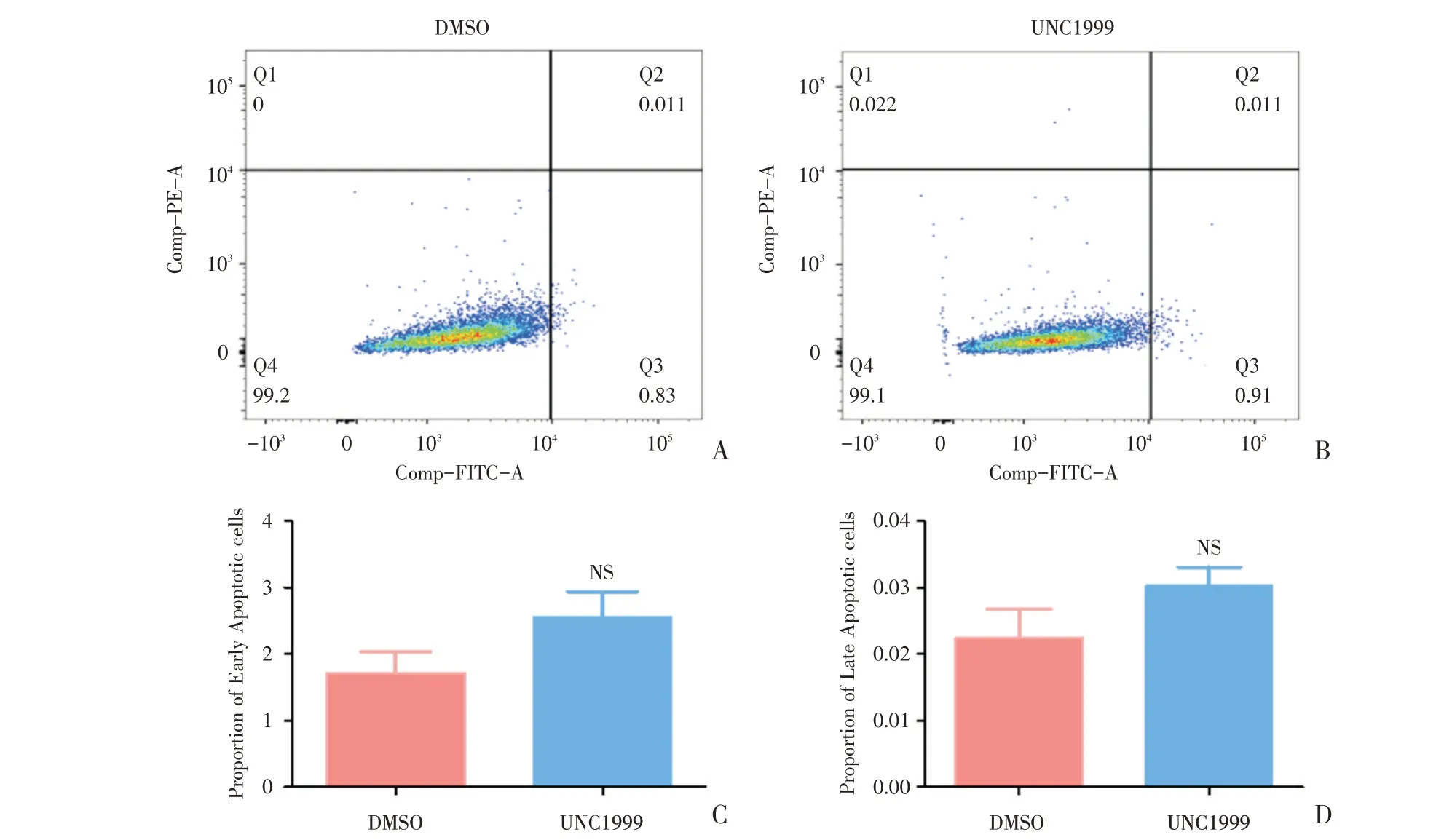
图5 UNC1999 不影响SMMC-7721 细胞凋亡Fig.5 UNC1999 could not influence cell apoptosis of SMMC-7721

图6 UNC1999 影响SMMC-7721 的细胞周期Fig.6 UNC1999 could altered cell cycle of SMMC-7721

图7 UNC1999 影响SMMC-7721 的转录组学结果Fig.7 UNC1999 altered transcriptomics of SMMC-7721

表1 UNC1999 组与DMSO 组的RNA-seq 的统计学结果Table 1 The statistical result of RNA-seq map in DMSO group and UNC1999 group
我们在检测EZH1及EZH2的基因表达水平之后,发现在基因水平上,UNC1999 并未明显抑制两种基因的转录水平,遂进一步在蛋白水平上验证。结果发现UNC1999 能抑制EZH1(t=4.032,P=0.0157;图9A)、EZH2(t=7.197,P=0.0006;图9A)的蛋白表达,差异具有统计学意义(图9C,D)。由于EZH1/2显著的功能之一是对H3K27进行三甲基化,于是同时检测H3K27me3 的蛋白表达情况(t=3.489,P=0.0251;图9B),发现UNC1999 能抑制其表达(图9B),差异具有统计学意义(图9E)。
3 讨论
在本研究中,我们通过采用EZH1/2的特异性抑制剂UNC1999 处理肝癌细胞SMMC-7721,检测了用药后SMMC-7721 的多个生物特性,并初步探讨了药物对肝癌影响的作用机制。结果显示UNC1999 能抑制肝癌细胞的增殖、侵袭、迁移能力;并能阻滞肝癌细胞由G0/1 期向S 期转化,但影响程度较小;而对细胞凋亡无明显影响。提示UNC1999 对肝癌的抑制作用不是通过促进凋亡或阻滞细胞周期来实现。为进一步研究其中的作用机制,进行RNA-seq 测序发现UNC1999 能影响多个基因的表达,并验证发现UNC1999 能通过在蛋白水平上抑制EZH1、EZH2及其催化H3K27me3的功能从而发挥抑制肝癌作用。EZH1/2阻断后诱导肝癌受到抑制,这一过程可能同时存在一种或者多种调节,例如:引发了自然杀伤细胞介导的肝癌细胞清除[15];诱导了多种抑癌microRNA 表达上调[22-23];抑制了肝癌干细胞的自我更新[24]。这些可能存在的机制需要进一步的验证。另外,UNC1999 处理后NECTIN4显著上调,该基因属于免疫球蛋白样跨膜细胞粘附分子蛋白的成员[25],是某些病毒(如麻疹病毒)入侵宿主细胞过程中的细胞受体,已被报道参与抑制AKT-mTOR 信号通路从而引起细胞自噬[26]。自噬能够促进和维持肝癌进展[27-28],SMMC-7721 转录组结果提示UNC1999 作用后,肝癌细胞发生改变的基因所富集的信号通路之一是PI3K-AKT-mTOR(图7D),所以我们推测UNC1999 发挥抑制肝癌的机制之一,可能为通过NECTIN4抑制AKT-mTOR 信号通路进而抑制SMMC-7721 自噬,最终抑制肝癌。这一推测同样需要后续的研究。NECTIN4的特殊异构体被报道能预测抗肿瘤药物对肿瘤的细胞毒性和靶向治疗的反应性[29]。临床上,肝癌的常用抗癌药物为索拉非尼,但是据报道索拉非尼只对约30%的肝癌病人有效,且会出现继发性耐药[30-31],肝癌的耐药性是其化疗的严重障碍之一。UNC1999处理肝癌细胞之后NECTIN4表达水平明显升高,该结果启示我们:将UNC1999 与抗肝癌药物联合应用,或许能增加肝癌细胞对抑癌药物的敏感性从而改善耐药问题,甚至两者相互协同发挥更大抗癌作用。这一启发值得深入探讨。

表2 UNC1999 组中上调的基因列表Table 2 The up-regulated genes in UNC1999 group

表3 UNC1999 组中下调的基因列表Table 3 The down-regulated genes in UNC1999 group

表4 UNC1999 组与DMSO 组中EZH1 及EZH2 的表达统计情况Table 4 The statistics of EZH1/2 in UNC1999 group and DMSO group
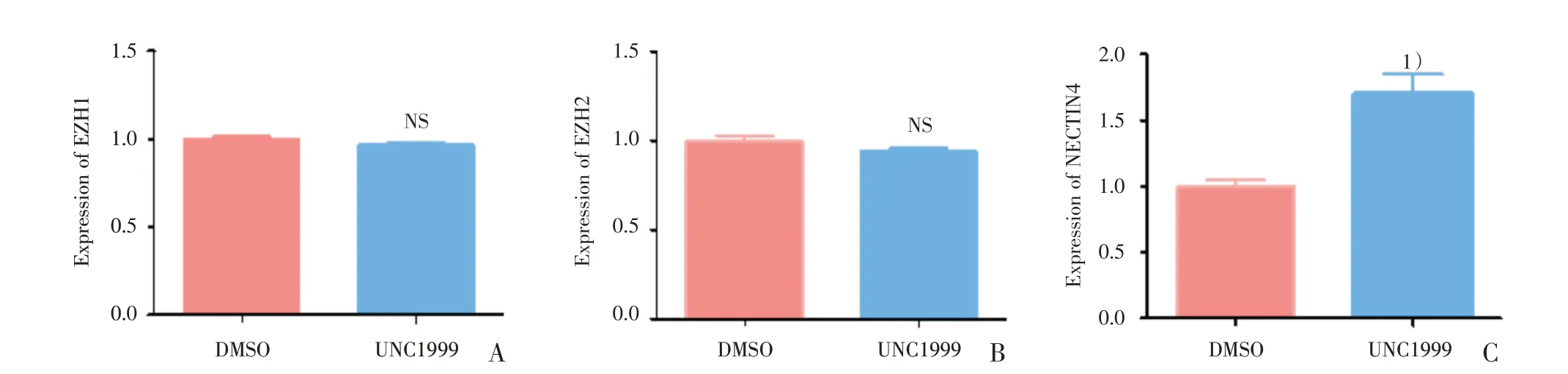
图8 UNC1999 促进NECTIN4 的表达Fig.8 UNC1999 promoted NECTIN4 expression in SMMC-7721

图9 UNC1999 抑制SMMC-7721 的EZH1/2 及H3K27me3 蛋白的表达Fig.9 UNC1999 inhibited EZH1,EZH2 and H3K27me3 expression in protein level
综上,我们发现并研究了特异性的表观遗传子EZH1/2抑制剂UNC1999 对肝癌细胞的抑制作用及其机制,揭示表观遗传子EZH1/2与肝癌细胞密切关系;同时发现与抗癌药物治疗反应性相关的NECTIN4特殊异构体,在UNC1999 处理后显著升高,提示表观遗传抑制剂与抗癌药物的联合应用可能成为肝癌的治疗新策略。
