2型固有淋巴细胞主导的小鼠呼吸道变应性炎症模型的建立
2019-12-17孟祥慈张洪瑜徐智斌方淑斌付清玲
孟祥慈,张洪瑜,徐智斌,方淑斌,付清玲
(中山大学附属第一医院耳鼻咽喉科医院,广东广州 510080)
支气管呼吸道变应性炎症,包括变应性鼻炎和哮喘,是以慢性气道炎症浸润、气道高反应性及气道重构为特征的呼吸道炎症疾病,其反复发作且难以治愈,严重影响患者的生活质量,造成巨大的个人和社会经济负担[1]。过去认为,呼吸道变应性炎症是一种由多种细胞及细胞因子参与的,与Th1/Th2 免疫应答失调相关的慢性呼吸道炎症疾病[2-3]。近年来越来越多的证据表明固有淋巴细胞(innate lymphoid cells,ILC)可保护机体免受病原体的侵犯,并参与许多疾病的生理病理过程[4-5]。ILC 主要可分为ILC1、ILC2 和ILC3 三个亚群。其中,2 型固有淋巴细胞(group 2 innate lymphoid cell,ILC2)可分布于多个组织器官,如肠粘膜、脾脏、肺脏等[6],其可受上皮源性细胞因子白介素(interleukin,IL)-25、IL-33 和胸腺间质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)的刺激而活化,并爆发性地释放大量Th2型相关细胞因子IL-5、IL-13 等而在变应性炎症的发病中起重要作用[5,7-9]。在其中,主要起作用的为IL-33,其可通过IL-33/ST2 信号通路促进ILC2 的活化,可诱发以ILC2 为主导的呼吸道变应性炎症[10-13]。应用免疫细胞缺陷小鼠发现ILC2 可以不依赖于获得性免疫细胞而独立诱发小鼠气道高反应性或哮喘,而且在动物的肺、纵隔淋巴结等内均发现了大量ILC2[14]。鉴于ILC2 为新近发现的固有免疫细胞,而其又在呼吸道变应性炎症的发病尤其是早期阶段中起重要作用,那建立以ILC2 为主导的动物模型将是详细研究ILC2 在呼吸道变应性炎症发病中的作用机制的必备之需。应用缺乏T、B细胞的小鼠来建立呼吸道变应性炎症模型因可摒除获得性免疫细胞的影响而可直接反应ILC2的作用。因此,本课题主要应用野生型C57BL/6和T、B 细胞缺陷的Rag1-/-小鼠经气道滴注给予IL-33 建立ILC2 介导的小鼠呼吸道变应性炎症模型,并检测肺部炎症浸润程度和肺泡灌洗液中炎症细胞及Th2 型细胞因子水平,为阐明ILC2在呼吸道变应性炎症的发生发展中的作用提供方法依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 动物均为6~8 周龄的雌性SPF级小鼠,体质量15~17 g,健康状况良好,饲养于中山大学动物实验中心(北校园)SPF 级动物房,进动物房后常规检疫一周。其中,野生型C57BL/6 小鼠购于北京维通利华实验动物技术有限公司【生产许可证号为SCXK(京)2016-0006】,Rag1-/-小鼠(C57BL/6 背景)由中山大学中山医学院张辉教授惠赠并于中山大学动物实验中心(北校园)繁殖【生产许可证号为SCXK(苏)2015-0001】,小鼠于出生4 周后剪取一段末端鼠尾用琼脂糖凝胶电泳检测小鼠Rag 野生型(192 bp)及Rag 突变型(197 bp)相关基因,选取雌性Rag1-/-小鼠用于后续实验。本实验已经获得中山大学动物实验伦理委员会批准(NO.2018000008)。
1.1.2 实验试剂 鼠源IL-33 购自美国Peprotech公司,苏木精-伊红(H&E)和碘酸-雪夫(PAS)染色液购自中国Solarbio 公司,流式抗体购自美国BD 公司,IA 型胶原酶和DNA 酶购自美国Sigma 公司,ELISA 试剂盒购自欣博盛公司。
1.2 实验方法
1.2.1 ILC2 介导的小鼠呼吸道变应性炎症模型的建立 将8 只C57BL/6 和8 只Rag1-/-小鼠分别随机平均分为对照组和模型组。将鼠源IL-33 用dd H2O 配制成50 μg/mL,并分别于第1、3、5 天经气道滴注20 μL 予模型组小鼠,对照组小鼠则给予20 μL dd H2O。第6 天处死小鼠收集标本,其中肺组织用于病理染色和分析ILC2 的水平,肺泡灌洗液用于检测各类炎症细胞的数量和炎症因子的表达水平(图1)。
1.2.2 肺组织病理染色 取左侧肺组织制成石蜡切片后进行苏木精-伊红(H&E)和碘酸-雪夫(PAS)染色,然后利用正置显微成像系统观察小鼠肺组织周围炎性浸润和支气管腔杯状上皮的数量并进行评分[15-16]。
1.2.3 流式分析 将肺泡灌洗液离心获得细胞沉淀,加入抗CD45-FITC、抗CD11b-APC-Cy7、抗CD64-PE、抗Ly-6G-Alexa Fluor 700、抗Siglec-FAlexa Fuor 647、抗Ly6C-PE-Cy7、抗I-A/I-E-Per-CP-Cy5.5 流式抗体进行孵育,通过流式分析检测炎症细胞总数以及嗜酸/中性粒细胞的数量[17],定义方法为:白细胞(leukocytes):CD45+;中性粒细胞(neutrophils):CD45+CD11b+Ly-6G+;嗜酸性粒细胞(eosinophils):CD45+CD11b+Ly-6G-CD64-Siglec-F+。将小鼠右侧肺组织经Collagenase IA(1 mg/mL)和DNase I(50 μg/mL)消化后制成单细胞悬液,加入抗CD45-APC-Cy7、抗CD127-PE-Cy7、Lineage Cocktail-FITC、抗CD90.2-PE、抗ST2-PerCPeFluor710 流式抗体进行孵育,应用CytoFLEX(BECHMAN COULTER)流式细胞仪进行流式分析检测ILC2 的表达水平[18],定义为:CD45+Lin-CD90.2+CD127+ST2+,并应用CytExpert 流式分析软件进行分析。

图1 建立ILC2 介导的小鼠呼吸道变应性炎症模型的流程示意图Fig.1 Schematic diagram for the development of ILC2-dominant murine asthma model
1.2.4 酶联免疫吸附实验 按照ELISA 试剂盒说明书,检测肺泡灌洗液中IL-5 和IL-13 的表达水平。
1.3 统计学分析
所有实验数据采用SPSS 22.0 软件进行统计分析并用Graph Pad Prism 7.0 画图,每组实验数据资料均以95%置信区间的中位数表示,因数据不符合正态分布,则应用Mann-WhitneyU分析组间差异,P<0.05 则差异为有统计学意义。
2 结果
2.1 气道滴注IL-33 可显著引发小鼠肺组织炎症浸润
首先,小鼠肺组织H&E 染色表明,C57BL/6和Rag1-/-小鼠在经受3 次气道滴注IL-33 后,气道周围与对照组小鼠相比均表现出显著的炎症浸润(图2A、C)。同时,小鼠肺组织PAS 染色的结果显示,经IL-33 滴注后的C57BL/6 和Rag1-/-小鼠气道上皮中杯状细胞的数量亦显著上升(图2B、D)。上述两种不同类型小鼠肺组织病理染色结果表明:气道滴注IL-33 可显著引发C57BL/6 和Rag1-/-小鼠肺组织的炎症反应和呼吸道上皮细胞的杯状化生。
2.2 IL-33 显著提高小鼠肺泡灌洗液中炎症细胞的数量和Th2 型细胞因子的表达水平
呼吸道变应性炎症可根据浸润炎症细胞的不同分为嗜酸性粒细胞和嗜中性粒细胞两种类型。为了进一步明确IL-33 诱导的肺组织炎症浸润的类型,我们进一步通过流式分析小鼠肺泡灌洗液中炎症细胞。我们发现经IL-33 气道滴注后,C57BL/6 和Rag1-/-小鼠肺泡灌洗液中白细胞、嗜中性粒细胞和嗜酸性粒细胞的数量均较对照组小鼠显著升高,且嗜酸性粒细胞较嗜中性粒细胞在两类小鼠中均表现更为明显(图3)。
此外,我们通过ELISA 检测小鼠肺泡灌洗液中炎症因子的表达水平发现,模型组小鼠Th2 相关的炎症因子(IL-5、IL-13)均较对照组显著增高(图4),而Th1/Th17 相关的炎症因子则未被检测到(结果未展示)。因此,IL-33 气道滴注可引发小鼠肺组织中嗜酸性粒细胞的浸润和Th2 型细胞因子的表达升高。
2.3 模型组小鼠肺组织中ILC2 的表达水平明显升高
由于IL-33 可诱导ILC2 的活化,我们进一步通过流式分析了小鼠肺组织中ILC2 的表达水平。我们发现,无论是野生型C57BL/6 小鼠还是T/B 细胞缺陷的Rag1-/-小鼠,其在IL-33 的作用下肺组织中ILC2 的数量均可显著升高(图5)。不过野生型小鼠ILC2 的水平远高于Rag1-/-小鼠,也提示T/B 细胞免疫缺陷小鼠也影响ILC2 的水平。我们的结果进一步揭示IL-33 激发的肺部炎症组织浸润可由ILC2 介导。

图2 小鼠肺组织病理染色结果Fig.2 The results of the pathological staining for murine lung tissues
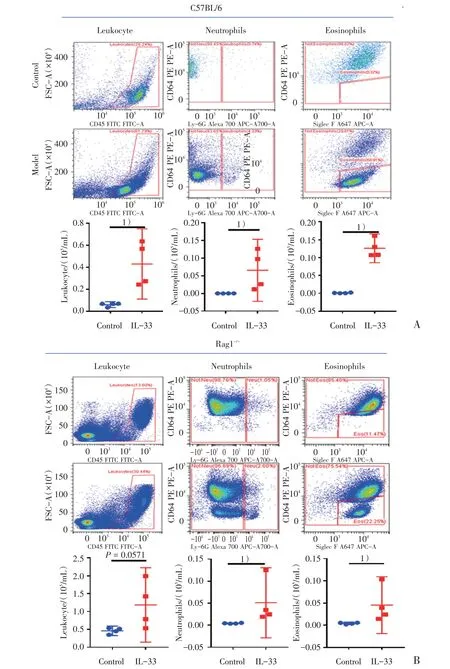
图3 小鼠支气管肺泡灌洗液中炎症细胞的数量Fig.3 The numbers of inflammatory cells in murine BALF
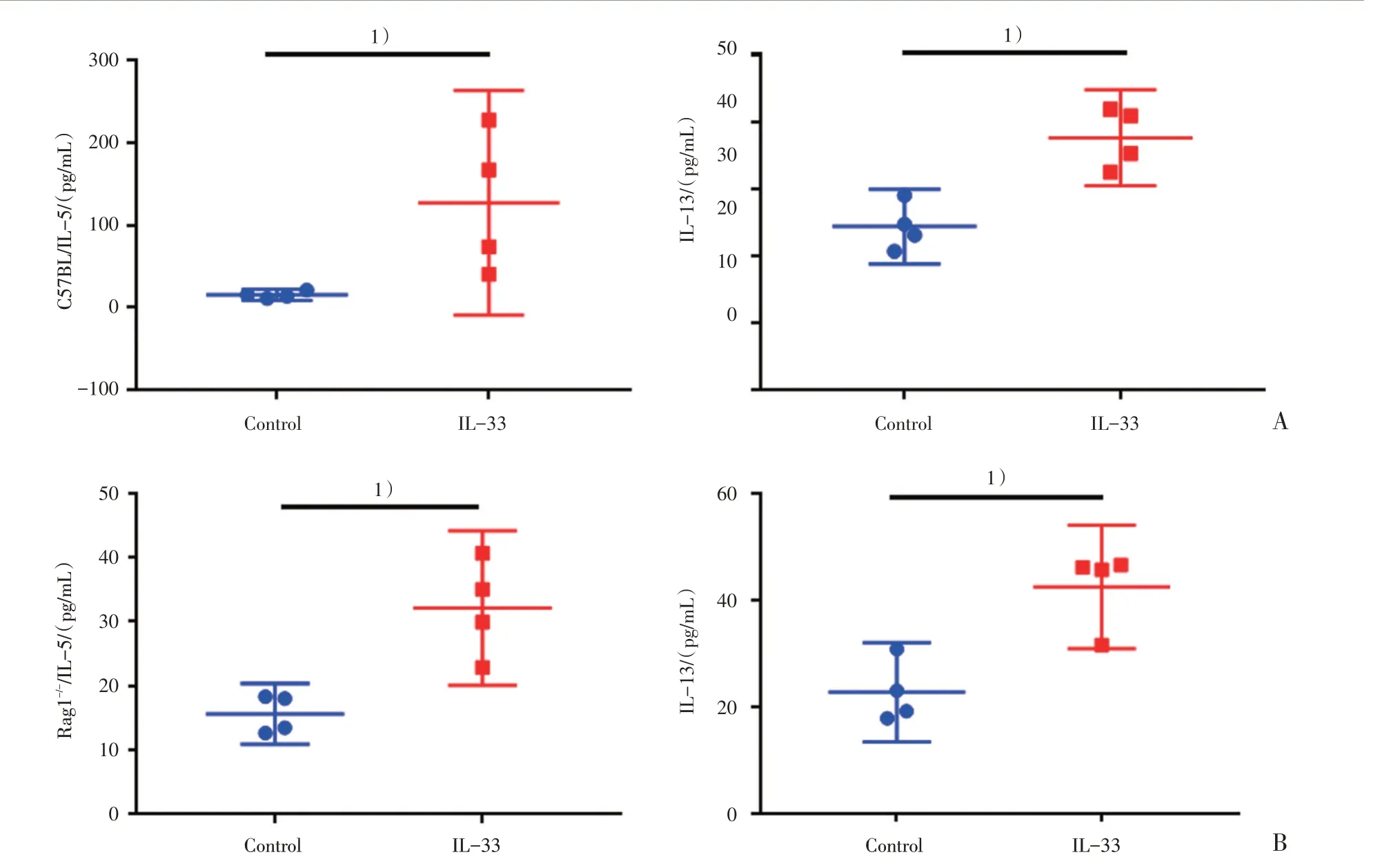
图4 小鼠支气管肺泡灌洗液中Th2 型细胞因子的表达水平Fig.4 The levels of inflammatory cytokines in murine BALF
3 讨论
综上所述,本研究发现野生型和T、B 细胞缺陷小鼠均可在IL-33 气道滴注的情况下产生由ILC2 为主导的嗜酸性粒细胞浸润为主的呼吸道炎症,表明两种不同类型的小鼠均可用于此类型呼吸道变应性炎症的造模。
目前,利用卵清蛋白和尘螨等过敏原进行致敏激发野生型小鼠可建立由Th2 介导的嗜酸性粒细胞浸润为主的呼吸道变应性炎症[19-22],而ILC2作为近些年发现的新型固有免疫细胞,建立由ILC2 介导的小鼠呼吸道变应性炎症模型有利于更好地研究ILC2 在呼吸道变应性炎症发生发展过程中的作用。由于野生型小鼠基因图谱与人类类似,可充分复制人类呼吸道变应性炎症的病理生理学变化,且具生长周期短、易于繁殖、研究成本低、便于操作等优势,是用于建立呼吸道变应性炎症模型较为理想的动物,但在建立以ILC2 为主导的呼吸道变应性炎症模型中的可行性仍不清晰;而Rag1-/-小鼠由于参与免疫球蛋白V-D-J重组的Rag1 基因缺陷,导致其无法形成成熟的T、B 细胞[23],可排除适应性免疫的影响从而更好地反应固有免疫在呼吸道变应性炎症中的重要作用[24],但Rag1-/-小鼠相对于普通野生型小鼠而言较难获得、繁殖周期长、研究成本高且操作较为复杂。因此,本研究同时成功通过气道滴注IL-33 在野生型C57BL/6 小鼠和Rag1-/-小鼠中诱导成功了以ILC2 水平升高为标志的呼吸道变应性炎症,并发现野生型小鼠和Rag1-/-小鼠在ILC2 的表达水平上存在差异,本研究也为这两类小鼠在此类模型中的应用提供了依据。而野生型C57BL/6 小鼠方便易得,在不具有Rag1-/-小鼠的实验室可以用野生型小鼠开展有关ILC2 的相关实验研究,也是具有一定说服力的,尤其是在先期研究发病机制及药物对ILC2 的调控作用方面更具有可行性及可操作性。

图5 小鼠肺组织中ILC2 的表达水平Fig.5 The levels of ILC2 in murine BALF
文献报道雄性激素可以抑制ILC2 的功能[19],这意味着雌性小鼠更易建立以ILC2 为主导的小鼠模型。因此,为保持数据的稳定性,在本实验中我们均采用雌性小鼠用于模型的建立。我们首先采用经气道滴入IL-33 的方法对C57BL/6 小鼠进行造模,并对小鼠肺组织中的炎症反应进行全面的评估,我们成功地在C57BL/6 小鼠上建立了ILC2 介导的嗜酸性细胞浸润为主的呼吸道变应性炎症模型:肺泡灌洗液中性粒细胞和嗜酸性粒细胞的明显增多且Th2 相关细胞因子水平增高,肺组织中表现出显著的炎症浸润和杯状细胞增生,同时肺组织中ILC2 的表达水平显著上升。为了进一步排除T/B 细胞对炎症反应的影响,我们采用了同样的方法,经气道滴入IL-33 对缺乏T/B细胞的Rag1-/-小鼠进行造模,发现我们同样能诱导出类似的呼吸道变应性炎症模型。我们的结果表明,不管是否存在T/B 细胞,IL-33 均可诱导嗜酸性粒细胞浸润为主的炎症反应,而肺部ILC2 水平也显著升高,这与既往Fort 等的研究结果是一致的[25-27],即ILC2 在嗜酸性粒细胞浸润为主的呼吸道炎症中起着十分重要的作用。不过,我们发现野生型小鼠ILC2 的水平远大于Rag1-/-小鼠,而有文献报道T 细胞和ILC2 间存在相互作用关系形成正反馈而进一步扩大变态反应炎症[28],也表明T/B 细胞免疫缺陷小鼠也影响ILC2 的水平,Rag1-/-小鼠因缺乏T/B 细胞也同样会影响ILC2,我们的结果也间接验证了这一理论。
本研究主要对以ILC2 为主导的小鼠呼吸道变应性炎症模型的建立进行了探讨,不过我们并未进行更深入的机制探讨,这是本研究的局限之处,这将在后续的工作中进一步完善。
综上,本研究使用两种小鼠成功建立了以ILC2 要为主导的呼吸道变应性炎症模型,为研究ILC2 在哮喘、变应性鼻炎发生发展过程中的重要作用奠定了坚实的基础。
