上调FoxM1增强骨髓间充质干细胞抗脂多糖诱导肺泡上皮细胞凋亡
2019-12-17张莉珊陈钦桂葛珊慧徐彩霞
张莉珊,陈钦桂,葛珊慧,徐彩霞,曾 勉
(中山大学附属第一医院1.MICU;2.转化医学中心,广东广州 510080)
急性肺损伤(acute lung injury,ALI)是一种常见危重症,死亡率高达45%,严重威胁重症患者的生命并影响其生存质量。ALI 发生的病理生理机制包括肺泡-毛细血管屏障的破坏导致的肺水肿,由于肺泡上皮细胞凋亡和肺部炎症增加导致的气体交换受损等两个方面[1-3]。尽管在过去五十年中ALI 的治疗取得了巨大进步,但是ALI 的病死率仍居高不下,作为主要治疗策略的呼吸支持和保守液体控制治疗其治疗效果有限[4],亟需探索新的治疗策略。从病理生理机制入手,通过抑制肺泡上皮细胞凋亡和减轻肺部炎症来治疗ALI,是目前的主要研究方向之一。间充质干细胞(mesenchymal stem cells,MSC)是多能间质细胞,可以分化为多种细胞类型,其在免疫调节、促进血管新生及抗炎等方面均表现出良好的应用前景及临床疗效[5]。已经有较多证据显示MSC 对肺泡上皮细胞具有抗凋亡作用[6-8],同时有研究提示MSC 可通过旁分泌效应发挥抗ARDS的作用[9-10]。叉头盒蛋白M1(forkhead box M1,FoxM1)是转录因子家族的成员,在维持细胞增殖和凋亡之间的稳态中起重要作用,被认为对细胞周期的调节有重要作用[11]。目前,对于FoxM1的研究主要集中在癌症发生的各个环节,我们知道FoxM1 因子失调表达会造成异常的细胞增殖,导致癌症。但近些年来,不少研究证实了FoxM1具有维持干细胞功能的作用[12-13]。我们课题组前期研究亦发现干扰FoxM1 可以影响干细胞的分化功能。然而,关于过表达FoxM1是否可影响骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)对肺泡上皮细胞的抗凋亡作用尚不清楚。为此,本研究在前期研究基础上进一步探讨上调BMSC的FoxM1表达水平对其抗脂多糖诱导肺泡上皮细胞凋亡作用的影响,并初步探索其可能机制,为寻求ALI新的防治方法提供一定思路和实验依据。
1 材料与方法
1.1 材 料
1.1.1 药品与试剂 低糖DMEM 培养基、高糖DMEM 培养基、胎牛血清(fetal bovine serum,FBS)(美国Gibco 公司),LPS(Sigma-Aldrich 公司),青霉素-链霉素(Thermo Fisher 公司),2.5 g/L 胰酶-0.02% EDTA 溶液(Thermo Fisher 公司),PBS 溶液(Beyotime 公司),Anti-Mouse/Rat CD29 PE(eBioscience公司),PE Mouse Anti-Rat CD90、PE-CD117(BD Pharmingen 公司),LV-FoxM1-PURO(滴度≥1×108TU/mL),LV-PURO(滴度≥1×108TU/mL),嘌呤霉素(Beyotime 公司),RIPA 裂解液、PMSF、SDS-PAGE 蛋白上样缓冲液、SDS-PAGE 凝胶配制试剂盒、BCA 蛋白浓度测定试剂盒(Beyotime 公司),SDS-PAGE 电泳液(自配),Western 转膜液(自配),TBST 缓冲液(自配),PVDF 膜(0.45 μm,Merck millipore 公司),5%BSA 封闭液(Beyotime 公司),Anti-FOXM1 抗体(Abcam 公司),Anti-GAPDH 抗体(cell Signaling Technology 公司),特超敏ECL 化学发光试剂盒(Beyotime 公司),TUNEL[Terminal dexynucleotidyl transferase(TdT)-mediate Dutp nick end labeling]试剂盒(KeyGEN Bio-TECH 公司),DAPI(美国Invitrogen 公司),Annexin V-FITC apoptosis assay kit 试剂盒(absin 公司)。
1.1.2 仪 器 生物安全柜,超净工作台,二氧化碳培养箱(Thremo Fisher 公司),低温高速离心机(Eppendorf 公司),RPICS XL-MCL 流式细胞仪(Beckman Coulter 公司),Axio Observer A1 倒置显微镜(Zeiss 公司),电泳仪电源(Bio-Rad 公司),ImageQuant LAS 4000 数字成像系统(General Electric 公司),Transwell 装置(corning costar,USA)。
1.1.3 实验动物 3 周龄,雄性SD 大鼠3 只(平均体质量为300 g),SPF 级,由中山大学实验动物中心提供,实验动物生产许可证分别为SCXK(粤)2016-0029 和SYXK(粤)2017-0081。本动物试验经中山大学实验动物伦理委员会批准,实验过程中对动物处置符合动物伦理学要求。
1.2 实验方法
1.2.1 大鼠BMSC 的分离培养 本实验沿用课题组之前报道的全骨髓贴壁法分离培养[14]SD 大鼠BMSC,具体实验方案如下。腹腔注射0.6 mL/100 g乌拉坦麻醉大鼠,采用颈椎脱臼法处死健康3 周龄SPF 级SD 大鼠,体积分数75%乙醇中浸泡5 min以消毒。在超净工作台内使用无菌手术器械分离双侧股骨、胫骨,剔除表面肌肉及结缔组织,采用4 ℃PBS 清洗3 次。然后剪开两骨骺端,用1 mL一次性无菌注射器抽取纯低糖DMEM 培养基冲出骨髓腔内容物至装有4 mL 100 mL/L 胎牛血清低糖DMEM 培养基(100 mL/L 胎牛血清、100 U/mL青霉素及0.1 mg/mL 链霉素)的15 mL 离心管,反复冲洗直至骨髓腔变白。收集滤液离心(300×g,4 min),弃上清,用含100 mL/L FBS 低糖DMEM 培养基重悬,接种于底面积为25 cm2的培养瓶中,37 ℃、体积分数为5% CO2的培养箱中培养。前3 d 每天给予换液,当细胞汇合度达到80%时给予2.5 g/L 胰蛋白酶37 ℃下消化3 min,以1∶3 比例传代去除混杂细胞克隆群,每2~3 d 换液一次,每日观察细胞生长情况,选择生长良好者继续传代,第3 代以后即可用于后续实验。
1.2.2 人肺泡上皮细胞培养 本研究采用与人肺泡上皮细胞具有相似生物学特性的A549 细胞作为替代,人肺腺癌细胞(A549)从American Type Culture Collection 获取,其具有Ⅱ型肺泡上皮细胞表型。采用含10%FBS 的DMEM 高糖培养液在37 ℃,体积分数为5%CO2培养箱中培养。
1.2.3 大鼠BMSC 的鉴定 取第3 代BMSC 使用2.5 g/L 胰酶消化,经PBS 溶液洗涤2 次后重悬,调整细胞浓度为5×106细胞/mL 的单细胞悬液,分别加入PE 标记的抗大鼠CD29、CD90、CD117 单克隆荧光抗体,避光冰上孵育30 min,PBS 溶液洗涤3次以去除未结合的抗体,用500 μL预冷PBS溶液重悬后应用流式细胞仪检测BMSC 的表面标志。
1.2.4 重组慢病毒载体转染BMSC 及相关检测MSC 实验分3 组:FoxM1 过表达组(FoxM1)、阴性对照病毒组(Vector)及空白对照组(WT)。在六孔板中以1×105/孔接种MSC,37 ℃、体积分数为5%CO2条件下培养24 h 后以感染复数(multiplicity of infection,MOI)=10 加入重组慢病毒载体,感染后第3 天加入嘌呤霉素5 μg/mL(空白对照组除外)继续培养3 d,当细胞汇合度达60%予以传代,传代2 次后收集细胞,取经嘌呤霉素筛选稳定转到的细胞株用于后续实验。
采用Western blot 检测过表达FoxM1 的效果。实验分组同上,使用RIPA 强裂解液(含1 mmol/L PMSF)裂解提取上述3 组BMSC 总蛋白,冰上裂解,4 ℃、14 000 ×g离心10 min,取上清为样本,BCA 法测定蛋白浓度;每孔取30 μg 蛋白上样,10%SDS-PAGE 凝胶电泳后转移至PVDF 膜,用5%BSA封闭液封闭10 min,分别加FoxM1(1∶500)、GAPDH(1∶1 000)一抗,4 ℃孵育过夜,TBST缓冲液洗涤5 min×3 次,二抗室温孵育1 h,滴加ELC 发光试剂显影,以GAPDH 为内参照,用Quantity One 图像分析软件对蛋白条带进行灰度分析,确定光密度值。
1.2.5 A549-MSC 共培养体系建立 本实验采用Transwell 小室(0.4 μm 孔径;Corning costar,USA)完成细胞共培养体系的建立,探讨MSC 条件培养基对A549 凋亡的影响:取对数生长期的A549 细胞和MSC 分别接种于Transwell 装置中,A549 接种于Transwell 装置的下室,MSC 接种于Transwell 装置的上室,置于培养箱中培养24 h,往A549 加入LPS(100 μg/mL),并将铺有BMSC 的Transwell 小室嵌入铺有A549 的6 孔板中,再次置于培养箱中培养24 h。实验分5 组:con 组、LPS 组、LPS+MSCWT组、LPS+MSCVector组、LPS+MSCFoxM1组。
1.2.6 TUNEL 法检测各组A549 细胞的凋亡 在建立共培养体系时在下室放置玻璃片接种A549以制作细胞爬片,按照上述共培养处理后取出细胞爬片。40 g/L 的多聚甲醛固定30 min,PBS 洗涤3 次,预 冷的100 μL 1%TritonX-100/10 mmol/L PBS 处理5 min,PBS 洗涤3 次,按照一步法TUNEL试剂盒说明书加入TUNEL(TdT+红色荧光素标记的dUTP),并于37 ℃湿盒中避光孵育60 min,PBS洗涤,加入DAPI,封片,荧光显微镜下以543 nm 激发波长,发射波长571 nm 观察红色荧光凋亡细胞,阳性细胞为细胞核染成蓝色。
1.2.7 流式细胞仪检测各组A549细胞的凋亡 用2.5 g/L 胰酶消化共培养下室A549 细胞,300 ×g,4 ℃离心4 min。收集处理后的各组细胞用冷PBS洗涤2 次,加入300 μL 的Binding Buffer 重悬细胞;每组加入5 μL Annexin V-FITC、避光、室温孵育15 min;上机前5 min 再加入5 μL Propidium Iodide(PI)染色,补加200 μL 的Binding Buffer,在1 h 内用流式细胞仪分析细胞。
1.2.8 共培养后培养基的细胞因子 使用MILLIPLEX MAP 液相芯片检测平台对共培养体系中细胞上清进行高通量多因子水平差异的检测,包括ITAC、GM-CSF、Fractalkine、IFNy、IL-10、MIP-3a、IL-12(p70)、IL-13、IL-17A、IL-1b、IL-2、IL-21、IL-4、IL-23、IL-5、IL-6、IL-7、IL-8、MIP-1a、MIP-1b、TNFa 多种细胞因子。按照上述步骤建立共培养体系后置于培养箱24 h 后,收集培养基于-80保存,12 h 后送检。实验分4 组:Con 组、LPS 组、LPS+MSCWT组、LPS+MSCFoxM1组。因为LPS+MSCVector组在前面的TUNEL 与流式细胞实验的中所得的结果与野生型LPS+MSCWT组相比,差异无统计学意义,故未对这组进行MILLIPLEX MAP 液相芯片检测多因子。
1.3 统计学处理
采用SPSS 24.0 软件对数据进行统计学分析,呈正态分布的实验数据采用均数±标准差()表示,数据处理两样本间比较,数据呈正态分布且方差齐时采用t检验;多组间比较先进行正态分布和方差齐性检验,数据呈正态分布且方差齐时采用单因素方差分析(one way ANOVA),多组间比较有差异时,组间两两比较采用Turkey 检验。数据呈非正态分布或方差不齐时3 组比较采用Kruskal WallisH检验,实验数据采用M(P25~P75)表示。P<0.05 表示差异有统计学意义。
2 结果
2.1 大鼠BMSC 分离培养
采用全骨髓贴壁法分离培养大鼠BMSC,初接种24 h 后部分细胞贴壁,可以观察到贴壁细胞呈集落样,但仍有较多悬浮于培养液内,前3 d 每天换液,瓶内未贴壁细胞逐步被清除。传代培养至第3 代的细胞均为贴壁生长,无明显悬浮细胞,光镜下细胞形态呈纺锤状(图1)。

图1 第三代大鼠BMSC 光镜下形态Fig.1 Microscopic morphology of third generation rat BMSC
2.2 大鼠BMSC 细胞表面标志物鉴定
按上述方法完成BMSC 的原代培养并传代培养至第3代,培养瓶中细胞主要为BMSC,取培养瓶中细胞悬液行流式细胞测定(方法见1.2.3)。流式细胞术检查结果显示,培养的细胞高度表达间充质干细胞特异性表面标志物CD29(+),CD90(+),且几乎不表达造血干细胞表面标志物CD117(-),见图2。提示本研究分离培养出来的BMSC符合骨髓间充质干细胞的生物学特性[14],可用于以下实验。
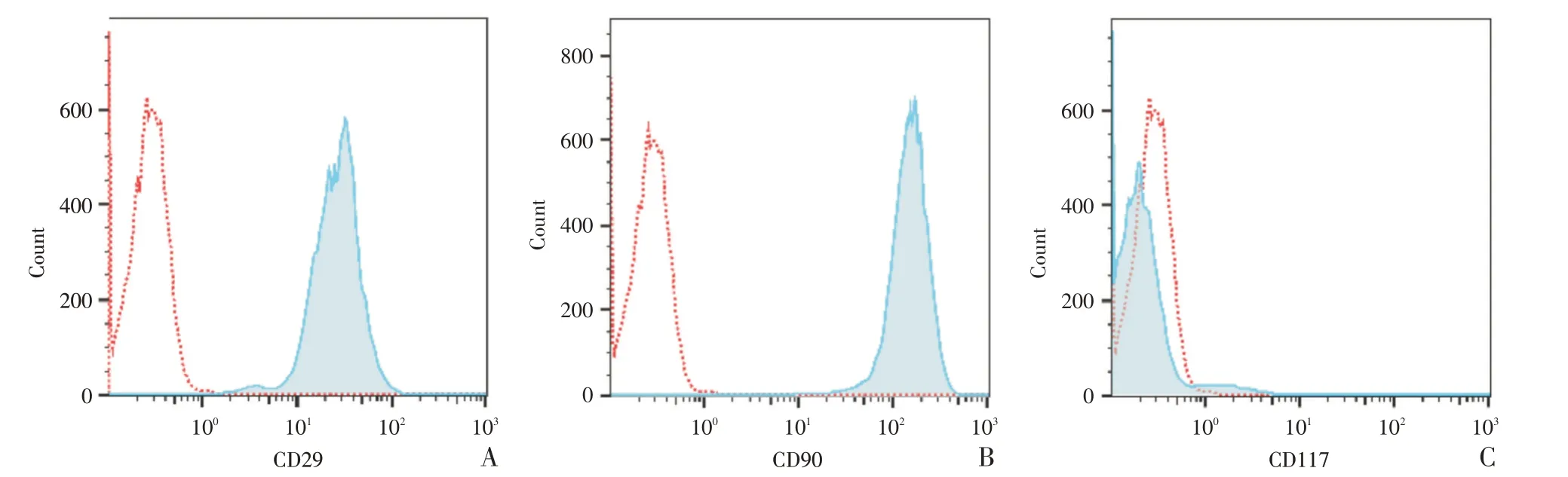
图2 BMSC 的特异性表面标志物表达水平Fig.2 Specific surface marker expression levels of BMSC
2.3 重组慢病毒载体转染后各组BMSC FoxM1蛋白表达水平
重组慢病毒载体转染BMSC 后,采用Western blot 检测目的蛋白FoxM1 的表达。与转染空病毒载体的BMSC 以及野生型BMSC 相比,转染携带FoxM1 过表达慢病毒载体后BMSC 的FoxM1 蛋白表达水平显著上升,约为野生型BMSC 组的4 倍(P<0.05;图3),差异具有统计学意义。然而,野生型组与空病毒载体组BMSC 相比,差异无统计学意义(P>0.05;图3)。
2.4 过表达FoxM1 的BMSC 对LPS 诱导的A549细胞凋亡的影响

图3 BMSC FoxM1 过表达Fig.3 FoxM1 overexpression in bone mesenchymal stem cells
为了直观观察凋亡情况,我们采用TUNEL 试验进行检测。结果如图4 所显示,对照组,LPS 组,LPS+MSCWT组、LPS+MSCVector组 和LPS+MSCFoxM1组间比较差异有统计学意义(F=304.247,P=0.000)。与未用LPS 处理的对照组相比,用100 μg/mL LPS处理的四组实验组导致TUNEL 阳性细胞数显著增加,凋亡率和TUNEL 阳性率均明显升高,差异具有统计学意义(P<0.01;图4),证实了LPS 确实可诱导A549 细胞凋亡。同时,BMSC-A549 共培养体系+LPS 的实验组与单纯LPS 处理组比较,凋亡率和TUNEL 阳性率明显下降,差异具有统计学意义(P<0.01;图4)。与LPS+MSCWT、LPS+MSCVector两组实验组相比,LPS+MSCFoxM1组的凋亡率或TUNEL 阳性细胞率显著减少,差异具有统计学意义(P<0.05,图4)。这些结果表明,FoxM1 过表达MSC 显著减轻LPS 诱导的肺泡上皮细胞凋亡。
为了量化FoxM1 过表达MSC 对LPS 诱导的肺泡上皮细胞凋亡的抑制作用,本研究还通过AnnexinV-FITC 和PI 双染法检测凋亡细胞的百分比,并用流式细胞仪分析。,对照组,LPS 组,LPS+MSCWT组、LPS+MSCVector组和LPS+MSCFoxM1组间比较差异有统计学意义(F=930.759,P=0.000)。与对照组相比,当用100 μg/mL LPS 处理细胞时,细胞凋亡率显着增加,差异具有统计学意义(P<0.01;图5)。以空白组作为对照,LPS 组晚期凋亡率52.63%,早期凋亡率25.52%;LPS+MSCWT组晚期凋亡率37.21%,早期凋亡率25.22%;LPS+MSCVector组晚期凋亡率38.28%,早期凋亡率24.46%、LPS+MSCFoxM1组晚期凋亡率26.75%,早期凋亡率13.23%。BMSC-A549 共培养体系+LPS 的实验组与单纯LPS 处理组比较,凋亡率和TUNEL 阳性率均下降,差异具有统计学意义(P<0.01;图5),与LPS+MSCWT、LPS+MSCVector两组实验组相比,LPS+MSCFoxM1组的凋亡率或TUNEL 阳性细胞率显著减少,差异具有统计学意义(P<0.01;图5),该结果提示过表达FoxM1 的MSC 能够下调LPS 诱导的肺泡上皮细胞的凋亡。
2.5 共培养体系的细胞因子水平
Milliplex 检测结果显示,与LPS+MSCWT组相比,LPS+MSCFoxM1组共培养后的A549 细胞释放的IL-13、IL-21、IL-23、MIP-1a、MIP-1b 等细胞因子水平均明显增加;其次,与单纯LPS 组相比,无论是LPS+MSCWT组还是LPS+MSCFoxM1组的MIP-3a水平均降低,其中LPS+MSCFoxM1组降低程度更大(图6)。
3 讨论
ALI 是一种急性弥漫性炎症性肺损伤,其炎症损伤的细胞主要是肺泡上皮细胞和肺微血管内皮细胞,因此抑制肺泡上皮细胞的凋亡可以减轻肺损伤的发生发展。目前尚未有治疗ALI 有效和特异性的方法,许多临床前研究表明,MSC 是一种潜在的治疗手段。脂多糖(LPS)作为高度促炎分子,常用于体外模拟体内炎症和受损状态。为此,本研究采用LPS 处理A549 细胞模拟体内内毒素引起的急性肺损伤中肺泡上皮细胞的损伤。通过TUNEL 和流式细胞术等体外实验探索MSC 对LPS 诱导的肺泡上皮细胞(A549)凋亡的影响,结果显示使用MSC 与A549 细胞共培养确实降低了TUNEL-阳性细胞和Annexin-阳性细胞比例,抑制了A549 细胞的凋亡,这与Chen[8]等研究结果一致。然而,由于MSC 移植的低存活率因素限制其功能的进一步发挥,为克服这一缺点,可采取多种方法以提高其疗效,其中就包括基因修饰,通过改变MSC 某些关键基因的表达水平而改变其旁分泌因子的种类,从而实现疗效最大化。倪晓彬等[16]的研究表明VEGF和Bcl-2双基因修饰的MSC通过旁分泌效应减少缺氧心肌细胞凋亡。但是肺组织中关于这方面的研究甚少,因此我们着重研究上调FoxM1基因的MSC对A549的抗凋亡作用。
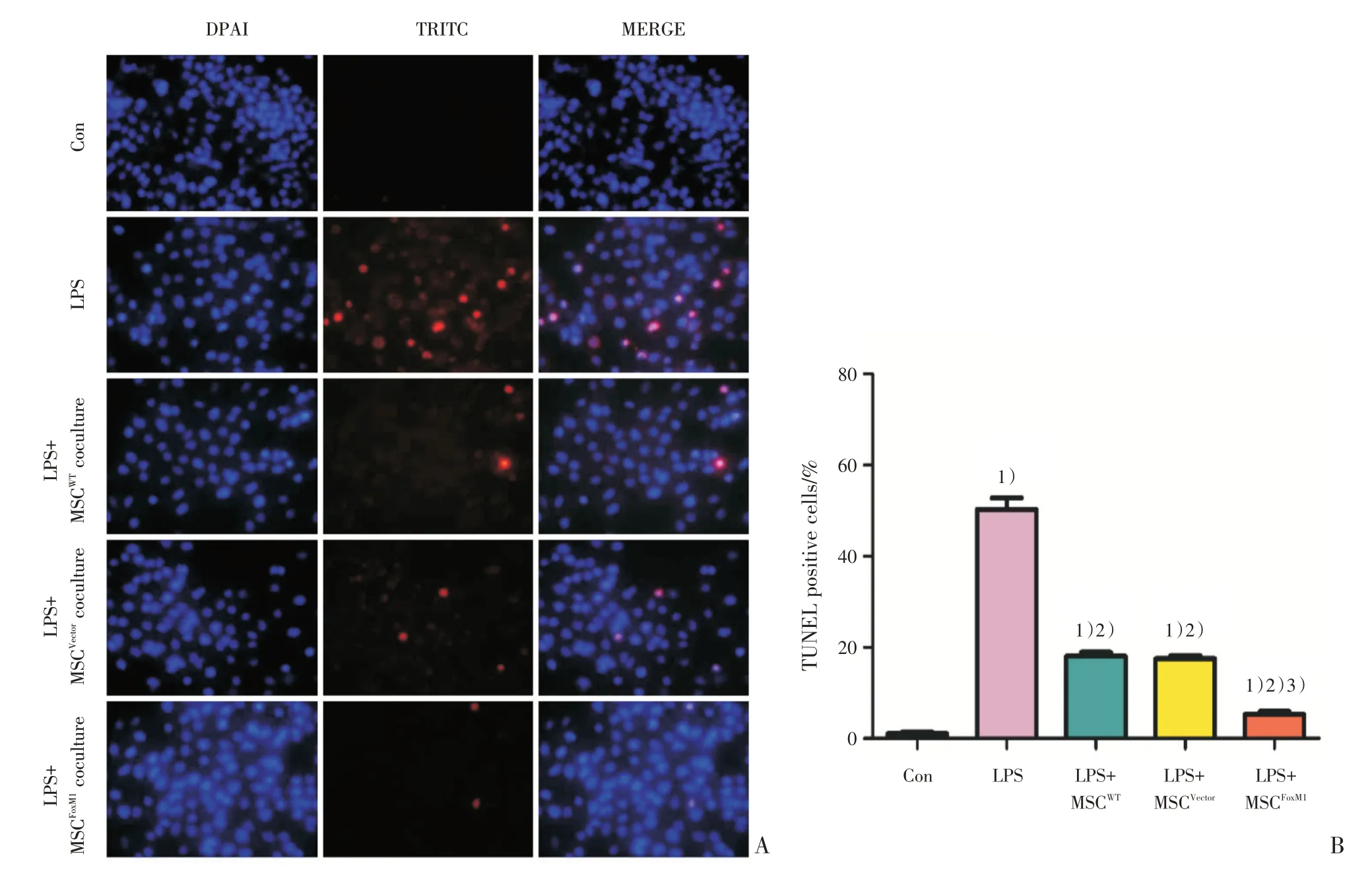
图4 TUNEL 检测A549 细胞凋亡情况Fig.4 A549 cell apoptosis was analyzed by the TUNEL assay
叉头框转录因子M1(FoxM1)属于Forkhead Box(Fox)转录因子家族,已经有研究表明FoxM1是一种与细胞增殖、生长和死亡有关的转录因子[16],关于FoxM1 的研究目前主要集中在增殖方面,其可以直接靶向增殖相关基因。有研究表明,在许多恶性实体瘤中FoxM1 均过表达,并且已有研究显示过表达FoxM1 基因可以抑制多种细胞的凋亡[17]。然而,关于过表达FoxM1 的MSC 尚未有报道。本研究通过提取大鼠骨髓间充质干细胞,构建重组慢病毒载体调控BMSC 的FoxM1 蛋白表达水平,采用非接触式Transwell 装置实现BMSC与A549 细胞的共培养,率先探索了过表达FoxM1基因的BMSC 对脂多糖诱导的肺泡上皮细胞凋亡水平的影响。结果显示,上调MSC 的FoxM1 表达水平可增强MSC 抗脂多糖诱导肺泡上皮细胞凋亡作用,继而减轻肺损伤的发生发展,这提示上调MSC 的FoxM1 基因表达水平可以增强其在治疗ALI 中的疗效。但是,有关过表达FoxM1 的MSC对肺泡上皮细胞凋亡的影响机制尚不清楚,仍需要进一步实验证明。

图5 流式细胞术检测细胞凋亡Fig.5 Analysis of A549 cells apoptosis by Flow Cytometry
为了进一步了解过表达FoxM1 的BMSC 对于抗A549 细胞凋亡的作用机制,本研究还通过检测BMSC 与A549 共培养培养基的细胞因子,初步探索其可能机制。由于共培养体系中两种细胞物种不同,BMSC 来源于大鼠,A549 来源于人,而MILLIPLEX MAP 液相芯片检测针对的是人来源的细胞因子,提示了所检测培养基中的细胞因子来源于A549。结果显示,过表达FoxM1 的BMSC对A549 细胞释放IL-13、IL-21、IL-23 等细胞因子有促进作用,对MIP-3a 的释放有抑制作用。已经有研究表明FoxM1 作为转录因子家族的成员,对炎症反应过程中细胞因子的表达具有调控作用[18]。已知凋亡的肺泡上皮细胞能够分泌多种炎症细胞因子,趋化中性粒细胞、单核细胞和淋巴细胞等炎症细胞,加重肺组织损伤[19]。但是,目前尚未有研究报道过表达FoxM1 的BMSC 对A549 细胞释放细胞因子的影响。IL-13 具有免疫调节和抗炎作用,能够抑制炎症因子产生[20],IL-21 是免疫调节因子,可调节免疫细胞的分化和增殖[21]。MIP-3α(巨噬细胞炎症蛋白-3),又称为CCL20,它对淋巴细胞具有强烈的趋化[22],在急性肺损伤的进程中能促进免疫细胞在肺内聚集,从而促发一系列损伤级联反应。因此我们推测过表达FoxM1 基因的BMSC 可能通过促进A549 细胞释放抑炎因子和免疫调节因子,或者是抑制趋化因子的释放,从而发挥抗肺泡上皮细胞凋亡的作用,进而改善LPS 诱导的急性肺损伤。IL-23 发挥前炎症因子的作用,介导炎症反应的发生[23]。MIP-1a(CCL3)、MIP-1β(CCL4)都是趋化因子家族成员,能够通过影响到下游巨噬细胞和单核细胞的富集程度,进而参与到组织细胞炎症性损伤过程。有趣的是,我们的研究发现过表达FoxM1 基因的BMSC 能同时促进A549 细胞释放促炎细胞因子IL-23、MIP-1a、MIP-1b,这可能与过表达BMSC 在ALI 中对A549 细胞发挥双向免疫调节作用相关。关于BMSC 对A549 细胞分泌细胞因子的调节作用、影响因素和相互作用机制尚有许多问题未解决,有待进一步研究阐明。
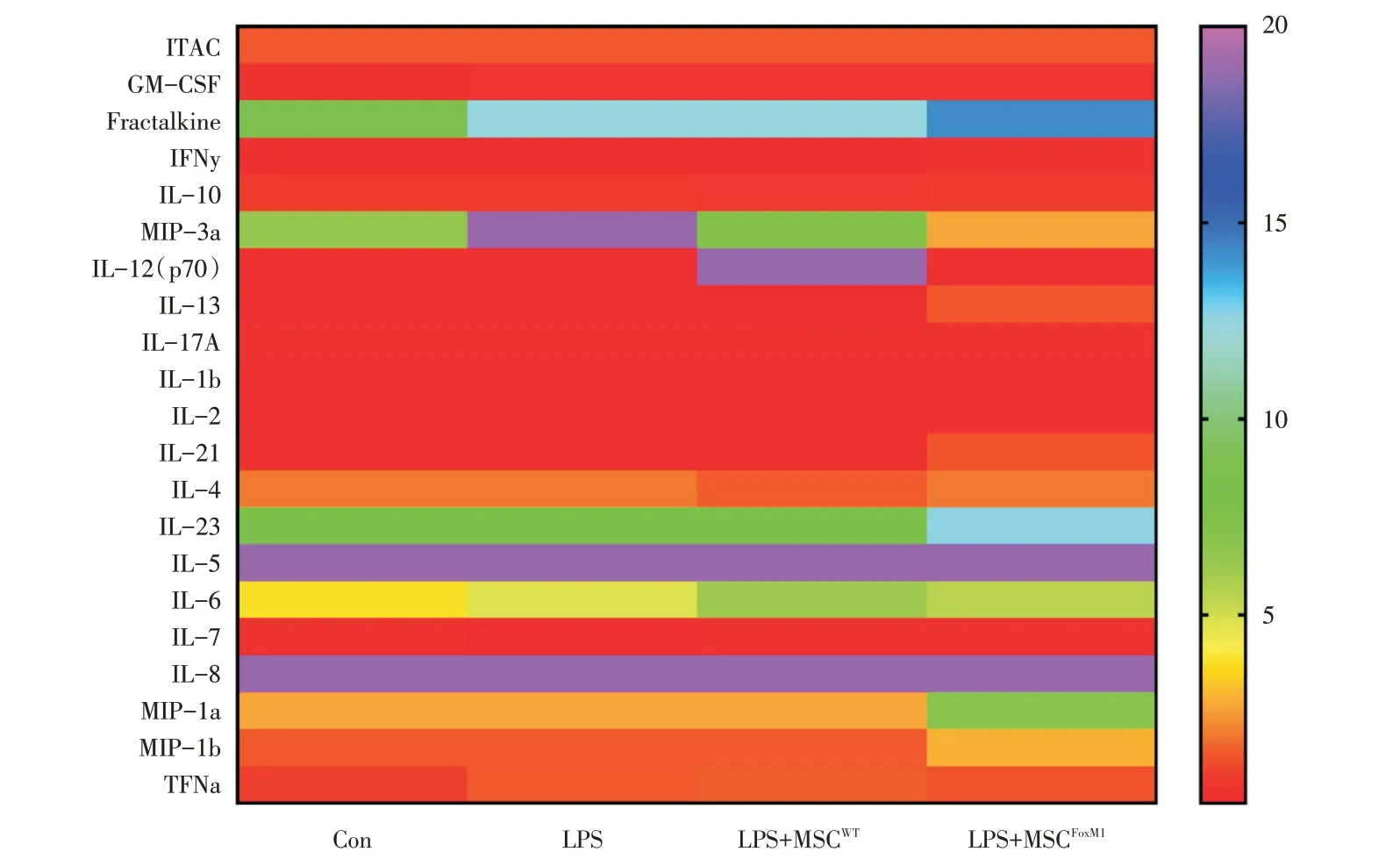
图6 MILLIPLEX MAP 液相芯片检测多因子Fig.6 MILLIPLEX MAP of liquid phase chip detection
总之,本研究初步探索上调BMSC 的FoxM1表达水平对其抗脂多糖诱导肺泡上皮细胞凋亡作用的影响,研究结果显示过表达FoxM1 基因的BMSC 可以降低LPS 诱导的肺泡上皮细胞的凋亡水平,且发现了在BMSC-A549 共培养体系中一些细胞因子水平的改变,加深了对基因修饰的BMSC 对肺组织细胞的调控机制的认识,有望为急性肺损伤的干细胞治疗提供新的启示,具有一定的临床应用前景,但仍需要更多的体内实验研究来进一步探索其中的调控机制。
