靶向Rac1的siRNA对口腔鳞状细胞癌HSC-3细胞的影响
2019-12-16王海业麻颖宜
王海业 麻颖宜
Rho家族又称Rho GRP酶,是一类GTP结合蛋白,具有GTP酶活性,在细胞增殖、分化、凋亡、运动转移和和血管生成等多种过程中发挥着关键作用[1]。Ras相关C3肉毒素底物1(Rac1)是Rho家族成员,被证实在胃癌[2]、皮肤癌[3]和卵巢癌[4]等多种肿瘤中异常高表达,可通过调控细胞增殖、转移和凋亡等在肿瘤的发生发展中发挥着重要作用。近年有研究指出,Rac1在口腔鳞状细胞癌中高表达,但其在口腔癌进展中的具体作用尚不明确[5]。口腔鳞状细胞癌是口腔癌中最为常见的病理类型,约占口腔癌的90%以上[6]。本研究以人口腔鳞状细胞癌HSC-3细胞为研究对象,采用小干扰RNA(siRNA)技术靶向抑制细胞中Rac1的表达,观察Rac1对HSC-3细胞增殖、侵袭和凋亡的影响,并探讨其可能的分子机制,以期为口腔癌的治疗提供新的靶点。
1 材料与方法
1.1细胞、试剂与仪器 HSC-3细胞株购于美国ATCC,RPMI-1640培养基购于美国Gibco公司;胎牛血清购于美国Hyclone公司,胰蛋白酶购于中国碧云天公司,青霉素、链霉素购于上海先锋药业公司,Rac1抗体购于美国Proteintech公司,PVDF膜购于美国Millipore公司,脱脂奶粉购于瑞士Nestle公司,siRNARac1及其阴性对照siRNA-NC购于上海吉玛制药公司,β-catenin、c-Myc、Bcl-2、Cleaved Caspase-3和GAPDH等抗体均购于美国Santa Cruz公司,HRP-羊抗兔二抗购于美国Zymed公司,脂质体2000和RNA提取试剂盒购于美国Invitrogen公司。RIPA裂解液、CCK-8、超敏ECL发光和BCA蛋白浓度测定等试剂盒均购于上海Beyotime公司,细胞凋亡检测试剂盒购于中国万类生物公司,RT-PCR试剂盒购于上海Transgene公司;Transwell小室购于美国Costar公司,ELX800酶标仪购于美国Biotek公司,WD-9413B凝胶成像系统购于北京六一仪器厂,NaoDrop 2000紫外分光光度计购于美国Thermo公司,9700PCR仪购于美国ABI公司,PY-16电热恒温培养箱购于美国Crystal公司。
1.2实验方法
1.2.1HSC-3细胞培养、分组与转染 在37℃和5%CO2的常规培养条件下以含10%胎牛血清、100 μg/ml链霉素和100 U/ml青霉素的RPMI-1640培养基培养HSC-3细胞。接种适量的对数生长期HSC-3细胞于6孔细胞板上,常规条件下培养过夜。
实验分为未转染组(未做任何处理)、siNC组(转染siRNA-NC)和siRac1组(转染siRNA-Rac1)。观察细胞密度达70%以上时,参照脂质体2000说明书步骤将200 pmol的siRNA-NC和siRNA-Rac1转至siNC组和siRac1组细胞中。孵育4 h后,弃培养液,加入新鲜培养液继续培养24 h。
1.2.2HSC-3细胞中Rac1 mRNA表达的检测 采用RT-PCR检测。参照RNA试剂盒说明书步骤提取HSC-3细胞的总RNA。再根据RT-PCR试剂盒说明书将定量后的RNA进行逆转录。以逆转录产物为模板进行PCR扩增,2-ΔΔCT法计算HSC-3细胞中Rac1 mRNA的表达。反应体系:模板 1μl、上下游引物(10μM)各0.5μl、SYBR GREEN MasterMix 10μl,加入 dd H2O补至20μl。反应条件:95℃ 36 0s,95℃30 s、60℃ 30 s、72℃ 30 s,共40个循环。其中,由上海吉玛公司合成的引物序列如下:GAPDH引物F:5′-GAAGGTCGGAGTCAACGGAT-3′和 R:5′-CCTGGAAGATGGTGATGGGAT-3′;Rac1引 物 F:5′-CGAGAAACTGAAGGAGAAGAAGC-3′和 R:5′-AAGGGACAGGACCAAGAACGAG-3′。
1.2.3HSC-3细胞增殖的检测 采用CCK-8法检测。以胰蛋白酶消化收集各组细胞,细胞计数后以每孔4×104个接种至3张96孔细胞板上。每组设置5个复孔。置于培养箱中分别培养24、48和72 h后,弃培养液加入10μl CCK-8试剂孵育4 h。以酶标仪在490 nm波长处检测各组细胞吸光度(OD)值。实验重复3次。
1.2.4HSC-3细胞侵袭的检测 采用Transwell小室检测。将无血清培养基稀释的Matrigel胶缓慢铺到Transwell小室膜上,置于培养箱中静止2 h。胰蛋白酶消化收集各组细胞,加入无血清培养基制备浓度为3×104个/ml的单细胞悬液。将Tanswell小室放入24孔细胞板中,在下室加入含胎牛血清的培养基800 μl,上室内加入细胞悬液200μl,每组设置3个重复。置于培养箱中常规培养24 h后,取出Transwell小室,经磷酸缓冲液洗涤后,小心除去上室中残留的细胞,分别以4%多聚甲醛和0.5%结晶紫对细胞进行固定和染色。磷酸缓冲液冲洗晾干后,放于倒置显微镜下观察穿膜细胞数,结果以随机选取的5个视野的均值表示。实验重复3次。
1.2.5HSC-3细胞凋亡的检测 采用流式细胞仪检测。收集转染24 h后的各细胞,加入磷酸缓冲液洗涤细胞后,加入500μl Binding Buffer重悬细胞。再分别加入Annexin V和PI各5μl避光下室温孵育15 min后,上机检测。重复检测3次。
1.2.6HSC-3细胞中 Rac1、β-catenin、Cleaved caspase-3、Bcl-2和c-Myc蛋白表达的检测 采用Western blot检测。收集转染后的各组HSC-3细胞,加入细胞裂解液提取总蛋白,并根据BCA蛋白浓度测定试剂盒检测总蛋白的浓度。将蛋白样品与上样缓冲液以1∶1比例混合并置于沸水中煮沸3~5 min。以每孔20μl上样液上样至SDS-PAGE凝胶孔中,80 V电压电泳2 h。湿转法转印到PVDF膜上。取出PVDF膜,浸入到TBST液中(含5%脱脂奶粉)封闭2 h。将膜与封闭液稀释的一抗工作液(1∶1000)放入杂交袋中,封口4℃下孵育24 h。将膜取出并以封闭液洗涤5 min×3次后,将膜与封闭液稀释的二抗工作液(1∶2000)放入杂交袋中,封口常温孵育1h。再次洗膜后,滴加ECL发光剂反应3 min。采用凝胶图像处理系统以GAPDH为内参,分析目的条带的光密度值。
1.3统计学方法 采用SPSS 22.0统计分析;实验数据以(±s)形式表示,三组组间数据采用单因素方差分析,方差齐性采用LSD检验,两组组间采用独立样本t检验;P<0.05为差异有统计学意义。
2 结果
2.1Rac1 mRNA和蛋白的表达 转染siRNA-Rac1后HSC-3细胞中Rac1表达下降;siNC组中Rac1 mRNA和蛋白的表达水平与未转染组相比无显著性差异(P>0.05),但siRac1组中Rac1 mRNA和蛋白的表达水平较未转染组明显降低(P<0.01)。见图1和表1。

图1 Western blot检测HSC-3细胞中Rac1蛋白的表达
2.2Rac1对HSC-3细胞增殖的影响 下调Rac1表达可抑制HSC-3细胞增殖。未转染组和siNC组比较,HSC-3细胞在24、48和72 h增殖过程中的OD值无明显差异(P>0.05);但siRac1组细胞在24、48和72 h生长增殖过程中的OD值较未转染组均明显降低(P<0.01)。见表2。
2.3Rac1对HSC-3细胞侵袭的影响 下调Rac1表达可抑制HSC-3细胞侵袭。三组侵袭细胞数分别为76.48±9.55、72.86±11.05和32.22±3.36。单因素方差分析三组间侵袭细胞数差异显著(F=24.201,P=0.001);与未转染组比较,siRac1组中侵袭细胞数明显减少(P<0.05);而siNC组与未转染组间无显著差异(P>0.05)。
表1 各组HSC-3细胞中Rac1 mRNA和蛋白的相对表达量±s
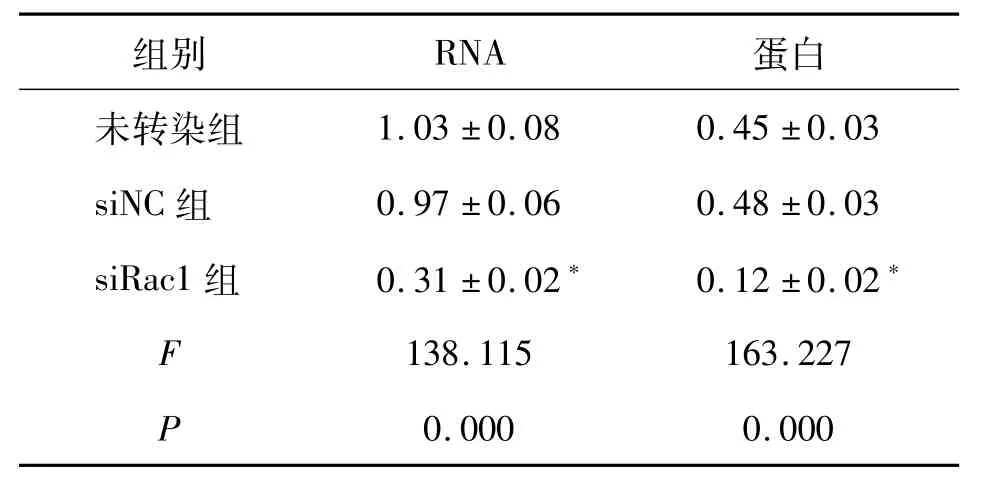
表1 各组HSC-3细胞中Rac1 mRNA和蛋白的相对表达量±s
*与未转染组比较,P<0.01
组别 RNA 蛋白未转染组1.03±0.08 0.45±0.03 siNC组 0.97±0.06 0.48±0.03 siRac1组 0.31±0.02* 0.12±0.02*F 138.115 163.227 P 0.000 0.000
表2 各组不同时点HSC-3细胞的吸光度值比较/±s
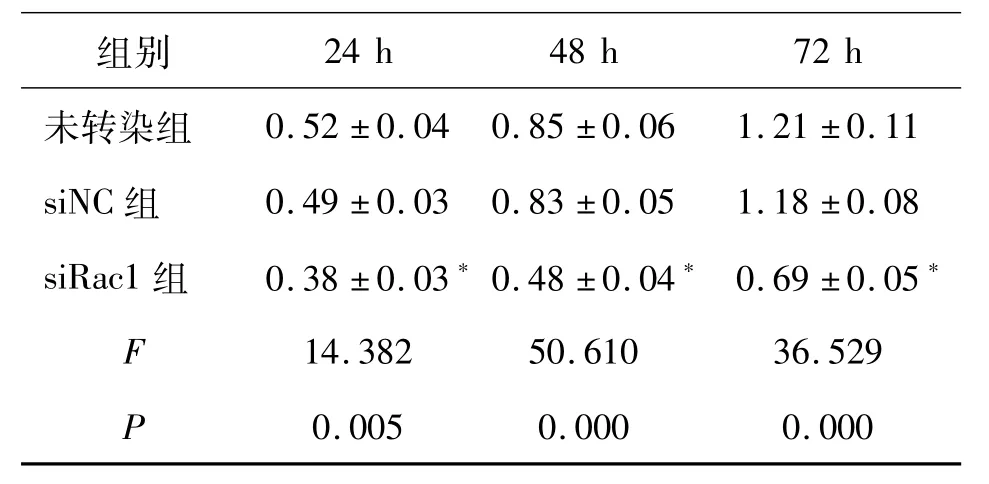
表2 各组不同时点HSC-3细胞的吸光度值比较/±s
*与未转染组比较,P<0.01
组别24 h 48 h 72 h未转染组0.52±0.04 0.85±0.06 1.21±0.11 siNC组 0.49±0.03 0.83±0.05 1.18±0.08 siRac1组 0.38±0.03*0.48±0.04*0.69±0.05*F 14.382 50.610 36.529 P 0.005 0.000 0.000
2.4Rac1对HSC-3细胞凋亡的影响 下调Rac1表达可诱导HSC-3细胞凋亡。各组的细胞凋亡率分别为(3.06±0.25)%、(3.18±0.32)%和(13.82±1.24)%,三组间存在显著差异(F=201.764,P=0.000);与未转染组比较,siNC组细胞凋亡率无显著改变(P>0.05),但siRac1组细胞的凋亡率明显升高(P<0.05)。见图2。

图2 AnnexinV-fitc流式细胞检测HSC-3细胞的凋亡
2.5Rac1对Wnt/β-catenin信号通路的影响 下调Rac1表达可抑制Wnt/β-catenin信号通路的激活。siNC组Wnt/β-catenin信号通路相关蛋白β-catenin、c-Myc,以及其下游凋亡调控蛋白 Bcl-2和Cleaved Caspase-3的表达水平与未转染组比较无明显差异(P>0.05),但 siRac1组β-catenin、c-Myc和Bcl-2T蛋白的表达水平均明显低于未转染组,而Bcl-2蛋白的表达水平明显高于未转染组(均P<0.01)。见图3和表3。
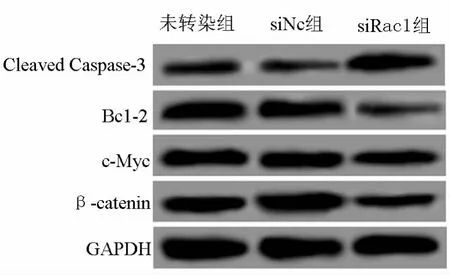
图3 Western blot检测 Wnt/β-catenin信号通路相关蛋白的表达
3 讨论
Rac1基因位于人类7p22染色体上,全长29kb;通过与GTP结合激活或与GDP结合失活的循环作用在调控细胞生物学功能如细胞运动、增殖和凋亡等中发挥着重要作用,其异常表达与包括肿瘤在内的多种疾病的发生发展关系密切[7]。研究者分别对胃癌、结肠癌、乳腺癌、胰腺癌的研究[8~11]发现,Rac1在癌组织中高表达,且其表达水平与肿瘤分化、浸润、增殖、侵袭、转移和预后等有关,抑制其表达有望成为延缓和治疗肿瘤发生发展的重要策略。
口腔癌是一种位居全球第六位的恶性肿瘤,近年来其发病率呈升高趋势,且发病年龄趋于年轻化,严重威胁着人们的身体健康[12]。目前口腔癌发生发展的机制并不完全清楚,探讨其发生发展的机制,寻找有效的分子靶点对口腔癌治疗具有重要意义。张月等[5]指出,Rac1在口腔鳞状细胞癌组织中表达水平显著高于癌旁组织,且其表达水平与肿瘤有无转移有关,与上皮间质转化相关蛋白E-cadherin的表达无关;但Rac1在口腔癌进展中的作用并不清楚。
表3 各组细胞中Wnt/β-catenin信号通路的相对表达量比较/x±s

表3 各组细胞中Wnt/β-catenin信号通路的相对表达量比较/x±s
*与未转染组比较,P<0.01
-catenin c-Myc Bcl-2 Cleaved Caspase-3未转染组组别 β 0.68±0.05 0.74±0.05 0.57±0.03 0.26±0.03 siNC组 0.72±0.05 0.69±0.06 0.54±0.03 0.23±0.03 siRac1组 0.35±0.03* 0.42±0.03* 0.11±0.02* 0.68±0.05*F 62.898 38.100 270.955 132.488 P 0.000 0.000 0.000 0.000
本研究以人口腔鳞状细胞癌HSC-3细胞为研究对象,采用脂质体法转染siRNA-Rac1后成功下调HSC-3细胞中Rac1表达后,检测到HSC-3细胞的增殖和侵袭能力减弱,细胞凋亡能力增强。结果表明,靶向Rac1的siRNA可抑制HSC-3细胞的增殖、侵袭并诱导细胞凋亡。提示,Rac1通过调控癌细胞增殖、侵袭和凋亡,促进口腔癌的恶性进展。
细胞信号途径转导在口腔癌等多种肿瘤细胞的增殖、侵袭和凋亡等过程中发挥着重要作用,而经典的Wnt/β-catenin转导途径就是其中之一。β-catenin是Wnt/β-catenin通路的关键调控因子,其过度积累进入细胞核,通过调控靶基因转录激活Wnt/βcatenin通路,参与肿瘤的发生发展[13,14];c-Myc是Wnt/β-catenin通路下游的靶基因,也是一种原癌基因,在促进细胞增殖、侵袭和抑制凋亡等过程中发挥着重要作用[15,16];Bcl-2是公认的抑凋亡蛋白,而Caspase-3是细胞凋亡的重要执行因子,两者是检测细胞凋亡的常见指标[17,18]。在髓母细胞瘤和胰腺癌中,活化的Rac1可通过促进β-catenin表达激活Wnt/β-catenin通路,进而促进肿瘤的恶性进展[19,20]。
为深入阐明Rac1调控口腔癌进展的分子机制,本研究进一步检测显示,在Rac1低表达的HSC-3细胞中β-catenin、c-Myc和Bcl-2蛋白的表达水平均明显降低,而Cleaved Caspase-3蛋白的表达水平明显升高。结果表明,抑制Rac1可通过抑制Wnt/βcatenin信号通路活化抑制HSC-3细胞增殖、侵袭并诱导细胞凋亡。提示活化的Rac1可能通过激活Wnt/β-catenin信号通路促进口腔癌发生发展。
综上所述,Rac1在口腔癌的发生发展过程中发挥着重要的促进作用,靶向抑制其表达可通过Wnt/βcatenin信号通路抑制HSC-3细胞增殖、侵袭并诱导细胞凋亡,Rac1有望成为口腔癌治疗的潜在靶点。
