一株肉牛A型多杀性巴氏杆菌的分离与鉴定
2019-12-16张贵刚徐丽媛黄海碧韩四娥李化生关平原刘国英
张贵刚,徐丽媛,黄海碧,韩四娥,李化生,关平原,刘国英
(金宇保灵生物药品有限公司兽用疫苗国家工程实验室,呼和浩特 010030)
多杀性巴氏杆菌(Pasteurella multocida,Pm)是一种可感染各种动物的重要病原菌,主要引发牛出血性败血症、牛肺炎、猪肺疫、猪萎缩性鼻炎、禽霍乱等,也能够感染野生鸟类、海洋哺乳动物和人。Pm的致病机理相对复杂,健康动物的口腔、鼻腔和扁桃体常常存在Pm,被感染动物的呼吸道和消化道黏膜等处在发病前也已寄生了大量Pm。当机体抵抗力下降时,病原菌首先冲破免疫防线,侵入机体并繁殖,发生外源性感染。接着Pm随淋巴液进入血液,导致内源性感染[1-3]。研究认为,Pm侵入机体感染和繁殖与菌体的荚膜有着很大的关系,它们在体内繁殖时能够产生大量内毒素,导致机体发生病变[4]。Pm菌体有5个荚膜血清型,分为A、B、D、E和F型,每种荚膜血清型都可引起不同动物发病。相同荚膜血清型的不同菌株对相同宿主的毒力强弱和致病性也不同。A型和B型Pm毒力最强,感染动物的死亡率较高,发病常呈流行性。D型Pm的宿主范围广泛,但毒力相对较弱,多为散发性。E型菌株非常少见,F型菌株常见于患病火鸡中[5,6]。文献报道显示,2008年后我国牛感染Pm的病例中,病原多为A型Pm,主要引发犊牛肺炎(又称“运输热”)和牛肺炎(地方流行性肺炎)[7]。在欧美国家,死亡率较高的牛呼吸系统疾病多是由Pm导致。调查报道显示,2014年英国牛场中多杀性巴氏杆菌病的爆发率相对较高[8]。可见,Pm分离株是引起牛呼吸系统疾病的主要原因,给养牛业造成了严重的经济损害。本研究采用常规微生物学方法和分子生物学技术,对河北省患有呼吸系统疾病肉牛进行病原分离培养和分型鉴定,为有效预防与治疗提供参考,同时也为疫苗生产提供菌种资源。
1 材料和方法
1.1 病料与菌株在河北省某肉牛场采集病牛鼻拭子5份;多杀性巴氏杆菌A型阳性菌株由金宇保灵生物药品有限公司国家工程实验室病原学平台保存。
1.2 培养基和主要试剂营养琼脂培养基购自广东环凯微生物科技有限公司;马丁肉汤培养基购自北京中海生物科技有限公司;胎牛血清购自内蒙古金源康生物工程有限公司;快速革兰氏染液购自珠海贝索生物技术有限公司;细菌基因组DNA提取试剂盒购自天根生化科技有限公司;Phusion Hot Start II DNA Polymerase购自美国Thermo Scientific公司;Premix TaqTM、6×Loading Buffer、DL2000 Marker均为大连宝生物工程有限公司产品。
1.3 实验动物昆明系小白鼠购自内蒙古大学动物中心,体重18~22 g
1.4 病原分离培养将无菌采集的5份鼻拭子分别划线接种至5%鲜血琼脂培养基,同时接种到适量血清马丁肉汤培养基中,37℃过夜培养,观察菌落生长特性。挑取少量可疑多杀性巴氏杆菌菌落,无菌操作涂片,进行革兰氏染色镜检。将染色鉴定为可疑多杀性巴氏杆菌的HB5和HB25菌株在固体培养基和液体培养基上进一步纯化,记做G2代。
1.5 PCR鉴定
1.5.1 引物的设计合成 参照文献[9]合成多杀性巴氏杆菌特异性基因kmt1,以及荚膜血清特异性基因capA、capB、capD、capE、capF序列引物,参照文献[10]合成细菌16S rDNA序列引物,引物均由北京华大基因有限公司合成,序列信息见表1。
1.5.2 种属PCR及分型鉴定 取HB5和HB25菌株的G2代细菌培养物2 mL,用细菌基因组DNA提取试剂盒提取菌液DNA,并采用多杀性巴氏杆菌kmt1基因通用引物进行种属PCR扩增。反应体系:PremixTaqTM12.5 μL,上、下游引物(10 μmol/L)各0.5μL,DNA 模板1 μL,无酶水补至总体积25 μL。反应条件:95℃预变性5 min;扩增循环30×(95℃ 60 s,55℃ 30 s,72℃ 60 s);72℃再延伸7 min, PCR产物在1.5%琼脂糖凝胶中进行电泳。对PCR阳性的样品分别加入5个荚膜血清特异性基因引物,进行分型鉴定,反应体系与条件同上。
1.5.3 16SrDNA基因扩增及测序 以上述PCR鉴定为阳性Pm的DNA为模板,用高保真酶Phusion Hot Start II DNA Polymerase和16S rDNA基因序列引物进行PCR扩增。PCR体系:无酶水27.8 μL,dNTP Mix(10 mmpl/L each)0.8 μL,5× Phusion HF Buffer 8 μL,Phusion Hot Start II High-Fidelity DNA Polymerase (2 μ/μL)0.4 μL,上、下游引物(10 μmol/L)各0.5 μL,DNA 模板2 μL。反应条件: 98℃预变性30 s;扩增循环30×(98℃ 10 s,55℃ 30 s,72℃ 30 s);72℃延伸10 min, PCR产物经电泳检测后,送上海英维捷基公司测序。
1.6 致病性试验将连续纯化3代的HB25菌液进行菌落计数,并梯度稀释至10、20、30、40 CFU。随机分为4个攻毒组与1个对照组,每组5只小鼠。4个攻毒组小鼠分别腹腔注射10、20、30、40 CFU的HB25菌液0.1 mL,对照组小鼠均腹腔注射马丁肉汤培养基0.1 mL,次日观察小鼠发病死亡情况。

表1 引物信息Table 1 Primers used in this study
2 结果
2.1 形态学鉴定结果在5%鲜血琼脂培养基上,病原菌形成光滑、湿润、圆形的水滴样菌落,革兰氏染色阴性,显微镜下呈球形或短杆状,散在分布(图1)。
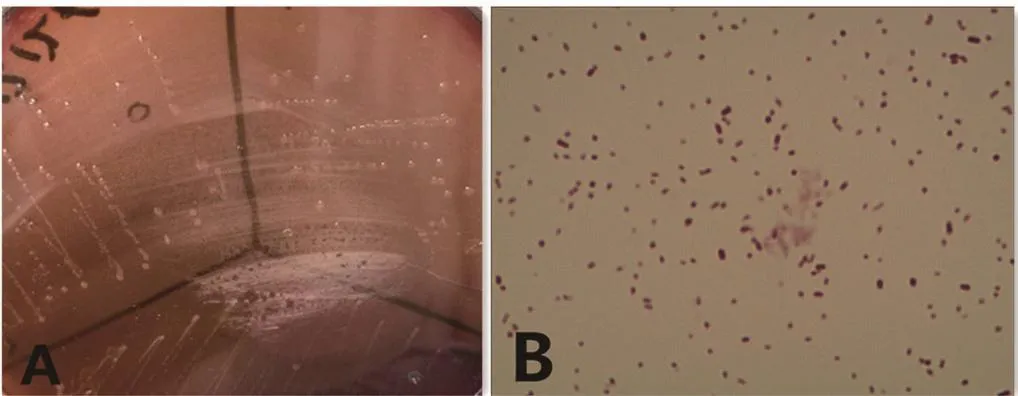
图1 分离菌株的形态学鉴定Fig.1 Morphological identification of isolated strain
2.2 PCR及分型鉴定结果经分离培养和染色鉴定为可疑的G2代Pm菌株HB5和HB25,采用Pm种属kmt1基因序列引物进行PCR扩增。电泳结果显示,HB5菌株无扩增条带,HB25菌株扩增出现约460 bp大小的目的条带,鉴定为Pm(图2)。进一步用荚膜血清特异性基因分型引物PCR鉴定HB25菌株,电泳结果显示,条段大小约为1044 bp,说明HB25菌株为A型Pm(图3)。

图2 多杀性巴氏杆菌kmt1基因PCR电泳图Fig.2 PCR result of kmt1 gene
2.3 16S rDNA基因扩增及序列分析HB25分离株经16S rDNA基因PCR扩增,结果如图4所示。将扩增产物测序后在NCBI进行BLAST比对,并对其序列进行遗传进化分析。结果显示,本菌株与阳性菌株SSF1-8以及GenBank中公布的8个Pm菌株16S序列相似性均在99%以上(图5),结合患病牛临床表现及分离菌培养特性可确定所分离菌株为牛源Pm。

图3 HB25菌株分型鉴定结果Fig.3 Typing of strain HB25 by PCR
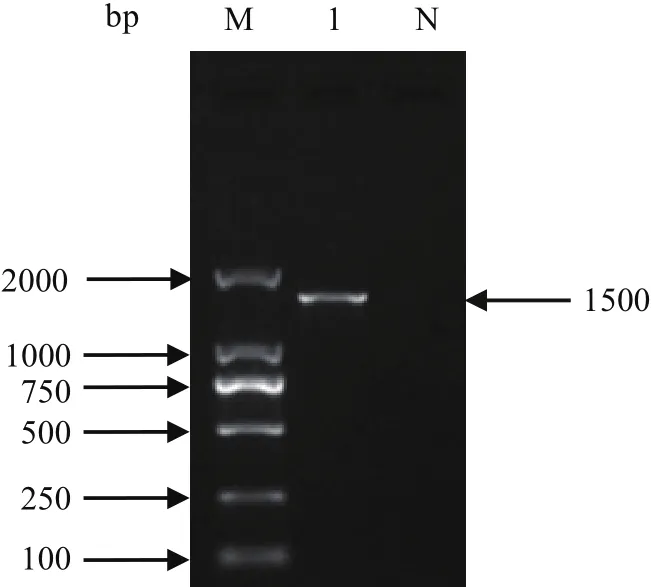
图4 HB25菌株16S rDNA基因PCR结果Fig.4 PCR result of 16S rDNA of strain HB25
2.4 致病性试验结果对4个攻毒组小鼠分别腹腔注射0.1 mL经梯度稀释的10、20、30、40CFU的HB25纯菌液,对照组按相同方式和剂量注射马丁肉汤培养基。24 h后,30 CFU组和40 CFU组小鼠均100%死亡;20 CFU攻毒组小鼠死亡4只,死亡率为80%;10 CFU组2只死亡,死亡率40%(表2)。可见,菌株HB25对小鼠的最小致死量为3CFU。
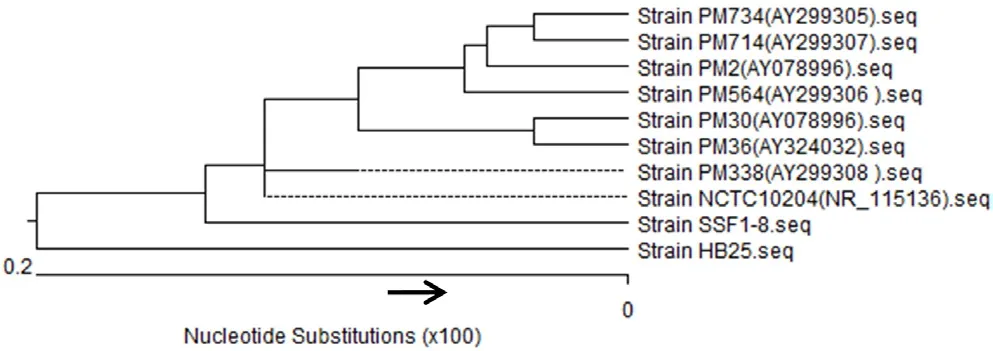
图5 HB25菌株16SrDNA基因遗传进化树Fig.5 Phylogenetic trees of strain HB25 based on 16SrDNA gene

表2 菌株HB25的毒力检测结果Table2 Results of virulence test of strain HB25
3 讨论
Pm是呼吸道一种较为常见的条件性致病菌,当宿主受到其他病原感染(细菌、病毒、寄生虫等)时,抵抗力下降,或是外界环境恶劣(寒冷、潮湿、拥挤等),宿主受到应激刺激时,都可能诱发多杀性巴氏杆菌病。近几年,我国养牛业发展迅速,不同地区之间的奶牛肉牛运输尤其频繁,加大了牛巴氏杆菌病发生和流行的概率[11]。研究发现,Pm的5个血清型之间在宿主嗜性、抗原特异性和致病性等方面存在较大的差异,不同血清型之间交叉保护性较低,给多杀性巴氏杆菌病的防治增加了困难。前些年,我国牛群感染的Pm以荚膜血清B型为主,但近几年,研究者不断从病死牛中分离到荚膜血清A型Pm,而现有的巴氏杆菌疫苗主要是针对荚膜血清B型,对A型Pm的保护率很低,导致我国牛群中A型Pm的流行与发生日益增多。目前对于牛巴氏杆菌病的综合防治应采取以疫苗免疫为主的预防控制措施,所以研制针对荚膜血清A型Pm的新型疫苗已迫在眉睫[13-15]。检测结果显示,分离的A型Pm菌株只需3 CFU即可100%致死小鼠,说明菌株毒力很强。本研究分离的菌株为高效预防该病的疫苗研制提供了基础性实验材料。
