肠道微生物与心力衰竭诊治的研究进展
2019-12-16陈子俊朱滨杨春杨玲
陈子俊,朱滨,杨春,杨玲*
肠道内含有超过两千种、百万亿个微生物,其总数与人体细胞总数相当[1]。这些定植在肠道的微生物在机体的生理或病理过程中发挥了重要作用[2],其可参与营养物质的代谢吸收,调节肠道上皮屏障功能及影响肠道局部或全身免疫炎性反应,肠道微生物的代谢产物入血尚可产生“类内分泌样”效应[3]。肠道微生物广泛的生理作用引起了研究人员的关注与重视,关于其在非胃肠疾病进程中作用机制的研究也日益增多。而心力衰竭是各种心脏疾病的发病终末阶段,其患病率为1.5%~2.0%,5年内病死率高达50%,与恶性肿瘤相当[4]。在过去的十几年中,研究人员对心力衰竭发病机制的理解逐渐从“神经-体液机制”向“神经-体液-免疫等多靶点调节”转变[5],其中,“心力衰竭肠道假说”逐渐为研究人员所认识[6]。该假说主张心力衰竭导致的血液再分配可引起肠壁水肿及肠上皮缺血损伤,进而造成肠道通透性增加及肠上皮屏障功能受损,从而使进入血液循环的肠道微生物及细菌内毒素增多,刺激机体产生肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)、白介素6(interleukin-6,IL-6)等促炎性因子,并通过调节相关信号通路进一步加重心肌细胞损伤、影响心肌功能[7]。此外,尚有研究证实某些特定的肠道微生物及其代谢产物与心力衰竭之间存在相关关系,进一步证实了“心力衰竭肠道假说”的可能性[8-9]。本文将对心力衰竭时肠道微生物组成变化及其代谢产物在心力衰竭中的作用机制进行阐述,同时介绍通过干预肠道微生物治疗心力衰竭的研究进展。
1 心力衰竭时肠道微生物组成变化
已有研究显示,心力衰竭时肠道微生物组成存在特征性改变[8-11]。通过16S rRNA基因扩增测序检测发现与健康受试者相比,心力衰竭患者便样本中Eubacterium rectale、Faecalibacterium prausnitzii、Dorea longicatena及 SMB53明 显减少,Ruminococcus gnavus、Streptococcu及Veillonella增加[8-10],且该变化不受心力衰竭病因影响;LUEDDE等[11]亦在射血分数降低的心力衰竭患者中观察到肠道微生物丰富度及核心菌群数量降低,如Blautia及Collinsella丰度下降。进一步的研究指出Collinsella的减少是心力衰竭时肠道微生物组成的标志性改变,当冠心病或糖尿病患者合并心力衰竭后,其原本表现为增多的Collinsella也将减少并低于健康人水平[11-13]。以上结果表明,心力衰竭患者存在某些特定的肠道微生物组成变化,该变化可能与心力衰竭的发生、发展密切相关。
2 心力衰竭时肠道微生物组成发生变化的可能机制
心力衰竭时肠道微生物的组成会发生特征性变化已得到广泛证实,但其发生机制尚未明确,推测心力衰竭引起肠道微生物组成变化的机制可能为:(1)心力衰竭导致的血液再分配可引起肠壁水肿及肠上皮缺血损伤,进而引起肠道内pH值降低及肠道上皮细胞产生抗微生物蛋白减少,这些肠道内局部微环境的变化最终引起肠道微生物的组成改变[14-16];(2)心力衰竭导致的肠上皮屏障功能受损使其隔离肠道微生物与肠道上皮的功能减弱,以致肠道微生物对肠道上皮细胞的刺激增强,进而引起肠道黏膜局部炎性反应,并对肠道微生物的组成产生影响[17]。目前心力衰竭相关肠道微生物组成的变化原因尚不明了,缺乏直接的试验证据揭示其具体机制,有待进一步深入探讨。
3 肠道微生物在心力衰竭发病机制中的作用
3.1 肠道微生物及其内毒素诱导促炎性因子产生 正常情况下,由于肠道黏膜屏障作用,肠道微生物及其产生的细菌内毒素即脂多糖不能随意进入血液循环;而心力衰竭时心排血量、肠壁血管血流量减少,引起肠壁水肿及肠上皮缺血损伤,进而造成肠道通透性增加及肠上皮屏障功能受损,使进入血液循环的肠道微生物及脂多糖增多[18]。进入血液循环的脂多糖在脂多糖结合蛋白的催化作用下与巨噬细胞表面的Toll样受体4/分化抗原14/髓样分化蛋白2复合物结合,激活相关免疫反应使促炎性因子释放,如TNF-α及IL-6等的释放。这些促炎性因子将引起心肌细胞的线粒体受损及钙稳态失衡,加重心肌细胞损伤及凋亡,最终导致心肌重构并引起心功能下降[7,19-20]。
本文创新点/局限性:
创新点:本文汇总并解读了国内外肠道微生物与心力衰竭相关的最新及权威研究结果,分析了心力衰竭时肠道微生物的变化及其代谢产物在心力衰竭发生、发展中的作用机制,并对肠道微生物治疗心力衰竭的进展及机制进行阐述。
局限性:已有较多研究发现肠道微生物及其活性代谢产物与心力衰竭的发生、发展相关,但识别这些引发生物效应的代谢产物以及探究其与机体的相关受体系统产生的具体信号通路,还需更多的进一步研究。
3.2 肠道微生物诱导免疫炎性反应 以往研究表明,心力衰竭时某些肠道微生物的变化与免疫炎性反应息息相关[21-22],且其过程中产生的炎性因子水平与心力衰竭的严重程度之间存在相关关系[23]。KUMMEN等[21]发现心力衰竭患者肠道中Lachnospiraceae的数量与血液循环中可溶性T细胞激动剂(CD25)的水平呈负相关,且心力衰竭症状越严重的患者其相关性越明显,表明肠道微生物的改变与心力衰竭时持续存在的慢性炎性反应有关,可能与心力衰竭的病情严重程度有关。随后的研究也发现,心力衰竭患者肠道微生物中Faecalibacterium prausnitzii的减少和Ruminococcus gnavus的增加均可诱导机体免疫炎性反应过程[24-25]。Faecalibacterium prausnitzii具有减轻炎性反应作用,有证据表明,由该菌减少所导致的炎性反应亢进与老年心力衰竭患者的不良预后增加密切相关[26]。此外,Ruminococcus gnavus能通过γ-干扰素、白介素17(interleukin-17,IL-17)及白介素22(interleukin-22,IL-22)诱导辅助性T细胞1和辅助性T细胞17等免疫细胞的激活以发挥其促炎效应[22],进而增加赖氨酰氧化酶活性,引起心肌胶原蛋白交联及心肌重构[27]。鉴于以上研究结果,推测心力衰竭患者肠道内抗炎相关微生物的减少及促炎相关微生物的增多可使心力衰竭症状进一步加重。
3.3 肠道微生物影响心力衰竭的其他机制 心力衰竭患者血浆中的鞘氨醇-1-磷酸水平较正常人明显升高,可加剧心肌细胞炎性反应,引起心肌重构及心功能障碍[28],而CUI等[8]研究发现血浆鞘氨醇-1-磷酸水平升高与心力衰竭患者肠道中Veillonella、Coprobacillus、Streptococcus数量的增加密切相关;与此同时,肠道中Veillonella的数量还与烟酸、肉桂酸及乳清酸等抗炎相关心脏保护因子水平呈负相关。然而,目前关于心力衰竭时肠道微生物组成变化与传统血液循环中影响心脏功能活性物质之间关系的研究较少,其具体机制仍有待进一步探讨。
4 肠道微生物代谢产物在心力衰竭发病机制中的作用
研究指出肠道微生物相关代谢产物也在心力衰竭发病机制中发挥重要作用,其产生的有害性代谢产物增多而保护性代谢产物降低,如氧化三甲胺(trimethylamine N-oxide,TMAO)、色氨酸代谢产物增多而短链脂肪酸合成减少,将进一步加速心力衰竭患者的疾病进程(见图1)[8]。
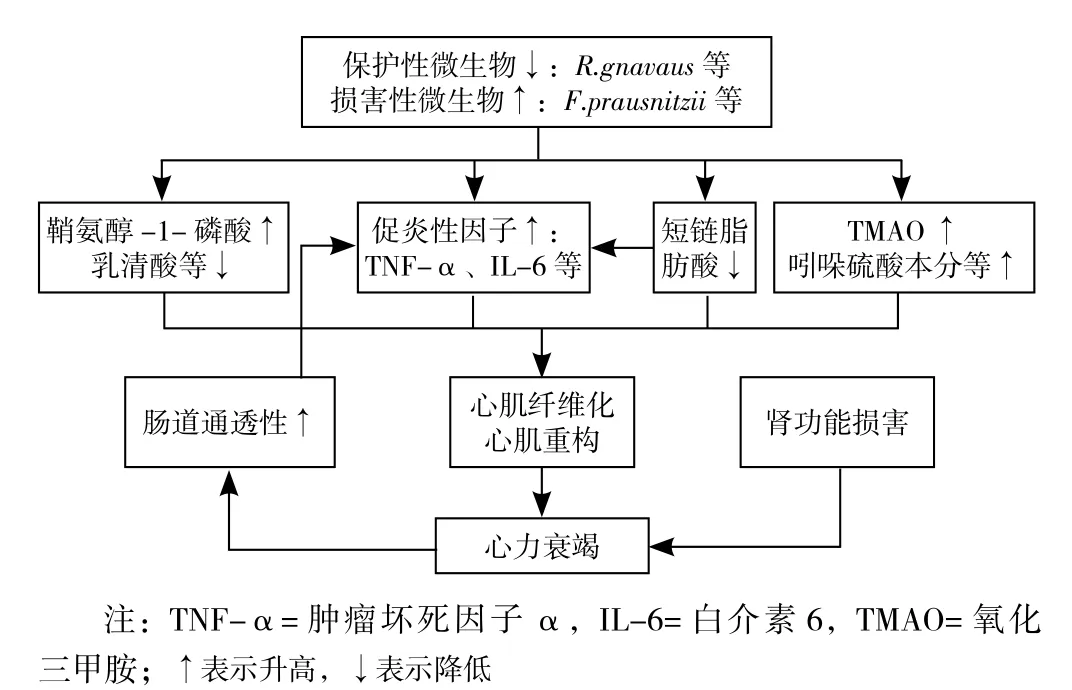
图1 肠道微生物在心力衰竭中的致病作用Figure 1 Pathogenic role of intestinal microbiota in heart failure
4.1 TMAO 多项研究表明,心力衰竭患者循环血液中的TMAO水平升高[8,29-30],其中CUI等[8]通过代谢组学分析心力衰竭患者的粪便和血浆样品发现其三甲胺(TMA)裂解酶表达增强,相关肠道微生物合成TMAO明显增多;此外,心力衰竭患者常因合并肾功能损害而导致血液中TMAO经肾清除减少,从而进一步导致血浆TMAO水平升高[30]。
血液循环中的高水平TMAO可引起心脏血管内皮损伤并对心肌产生直接损害作用[31]。在动物实验中,用TMAO喂养的小鼠表现出转化生长因子β-Smad3信号通路(一种促纤维化信号通路)激活增强,从而加剧心脏纤维化及减弱心室舒张功能;且在小鼠体内注射TMAO后,其血管紧张素的升压效应明显强化[32],由此可推测TMAO可能还可以通过机体内神经体液递质紊乱对心力衰竭产生不良影响,但其具体机制需进一步深入探讨。此外,尚有研究表明TMAO水平与血浆B型钠尿肽升高及纽约心脏协会心功能分级情况密切相关,干预TMAO有望成为心力衰竭治疗的新靶点[33-34]。SUZUKI等[35]还认为血浆TMAO水平可以作为急性心力衰竭死亡风险的预测因子,将其纳入急性心力衰竭患者的入院风险评分有利于提示临床尽早进行必要干预从而改善心力衰竭患者预后。
4.2 组氨酸代谢产物 食物中的组氨酸经肠道微生物代谢后可生成吲哚氧基硫酸盐及对甲酚硫酸盐,这些经由肠道微生物生成的组氨酸代谢产物在心力衰竭的发病过程中发挥重要作用。吲哚氧基硫酸盐和对甲酚硫酸盐被认为是心肾综合征发病机制中一个重要的启动因素,并且有可能导致心脏及肾脏的加速衰竭恶化[36]。体外实验表明,硫酸吲哚酚可以直接诱导培养心肌细胞的肥大及纤维化[37];且将硫酸吲哚酚注射入小鼠腹腔8周后,小鼠心脏即可表现出明显的纤维化改变及心室重构[38]。此外,SAVIRA等[39]还发现组氨酸代谢产物可以由凋亡信号调节激酶1(apoptosis signalregulating kinase 1,ASK-1)介导激活下游丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)及核转录因子κB(nuclear factor-kappa B,NF-κB),进而引起心肌肥厚及心肾纤维化改变。
4.3 短链脂肪酸 短链脂肪酸由肠道微生物酵解膳食纤维产生并分泌入血液循环,其中以乙酸、丁酸、丙酸最为丰富,其一直被认为是心血管系统的保护因子[40]。研究发现心力衰竭患者肠道微生物合成短链脂肪酸明显减少,通过对其粪便和血浆样品代谢组学分析可以观察到,心力衰竭患者肠道内的短链脂肪酸合成酶如丁酸盐、乙酸盐辅酶A(coenzyme A,CoA)转移酶表达明显减弱[8],且其肠道内Faecalibacterium prausnitzii及Lachnospiraceae等相关产短链脂肪酸菌群也减少,从而使其保护心力衰竭的有益作用不能得以充分发挥[8,11,21]。在小鼠实验中,SCHNEEBERGER 等[41]发现丁酸盐膳食可以减少血管紧张素Ⅱ诱导的肠道炎症相关Akkermansia muciniphila的含量,从而抑制肠道炎症,改善肠道屏障功能,且丁酸盐还可以稳定肠道上皮紧密连接蛋白,增加缺氧诱导因子1的表达以维持肠道内低氧微环境,进而保护肠道屏障完整性[42]。短链脂肪酸还可以通过干预肠道内巨噬细胞功能、下调脂多糖诱导的IL-6、白介素2(IL-2)等促炎性因子生成及诱导调节性T细胞的分化从而减轻免疫炎性反应,减缓心力衰竭疾病进程[43-44]。此外,短链脂肪酸尚能调控心血管疾病相关基因的转录,其中包括具有预防心脏疾病作用的Tcap、Timp4等基因的表达上调[45-46],以及与心脏疾病发病相关的Wnt信号通路、早期生长反应蛋白1(Egr1)等基因的表达下调[47-48]。与此同时,也有学者认为短链脂肪酸减少心肌纤维化及改善心肌肥大的功能是其降低血压后产生的间接效应,对高血压模型小鼠进行短链脂肪酸干预后,其血压降低、心肌纤维化改善,但其体内炎性相关因子表达并无明显差异,故短链脂肪酸参与心力衰竭疾病进展的具体机制还需进一步研究[49]。
5 通过干预肠道微生物治疗心力衰竭的进展
尽管肠道微生物与心力衰竭之间的相关机制研究尚需进一步深入,但其用于心力衰竭治疗的应用前景已受到广泛关注,其中可能的干预措施包括通过饮食、抗生素、摄入益生菌等改善肠道微生物的组成以及调节肠道微生物相关代谢产物生理功能。
5.1 饮食 饮食是影响肠道微生物群的重要因素之一[50],未来有望通过调整饮食结构改善肠道微生物的组成及功能来预防或延缓心力衰竭疾病病程。MARQUES等[47]发现通过给高血压模型小鼠喂食高膳食纤维可以增加其肠道内产醋酸盐相关微生物的数量,从而降低血压、改善心肌肥大和纤维化。另外,血液中的TMAO水平很大程度上受饮食影响[6],但在日本、荷兰及美国的3项大型临床研究中也均未发现增加TMAO源食物摄入与心功能下降之间具有相关性[51-53],其可能影响机制期待未来更多的临床及基础研究来进一步深入探讨。
5.2 抗生素 抗生素可通过改变肠道微生物的组成以降低心力衰竭患者血液中脂多糖及促炎性因子水平,从而改善血管内皮功能[54],但需注意的是抗生素也会引起一些严重的不良反应,如菌群紊乱、耐药菌的产生及艰难梭菌感染等[55]。因此通过抗生素改变肠道微生物组成从而达到改善心力衰竭患者病情的研究关键在于探索哪种特定的情况下运用相应抗生素可使心力衰竭患者从中真正获益。
5.3 益生菌与益生元 增加益生菌摄入在改善心血管疾病病情中的益处已得到众多动物实验及临床试验证据支持。LIN等[56]发现给自发性高血压鼠喂养益生菌发酵紫甘薯酸奶后,其Fas蛋白配体(Fas ligand,FasL)和线粒体依赖的凋亡信号通路活性下降,而抗凋亡相关胰岛素样生长因子-I受体(IGF-IR)/胞内磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路及B淋巴细胞因子-XL(B-cell lymphoma-XL,BCL-XL)信号通路活性上调,进而使心肌细胞凋亡减少;此外,增加Lactobacillus rhamnosus GR-1摄入利于维持小鼠心肌梗死后心肌细胞内牛磺酸水平,进而延缓缺血性心力衰竭的发展[57]。在临床试验中,Saccharomyces boulardii近来被证实可以降低心力衰竭患者循环血液中TNF-α、IL-6等促炎性因子及C反应蛋白水平,降低血清肌酐水平,提高慢性收缩性心力衰竭患者的左心室射血分数及改善其心脏功能[55,58]。尽管有学者提出,过多摄入Saccharomyces boulardii有增加真菌血症的风险[59],但此不良反应发生概率较小,谨慎适量摄入Saccharomyces boulardii对改善心力衰竭病情仍有很大的应用前景[55]。益生元是食物中不易消化的分子,包括低聚糖、复杂多糖等,其可以促进肠道内益生菌的繁殖,抑制致病菌的生长[60]。有动物实验表明增加益生元摄入有利于降低体脂、控制血糖,其可通过改善心血管疾病危险因素而延缓疾病进程[61-62]。不过目前尚未有临床试验证据支持摄入益生元在心力衰竭中的可能益处[63],未来还需更多大规模临床、基础研究进一步探讨。
5.4 调节肠道微生物相关代谢产物 有学者提出可通过口服不可吸收的AST-120等活性炭吸附剂以减少肠道内损害性代谢产物[64]。已有动物实验证据表明,给予慢性肾衰竭及合并心力衰竭的小鼠模型一定量的AST-120能吸附肠道内的TMAO及吲哚硫酸酚,并降低这些代谢产物在血液中的水平,从而延缓小鼠心室肥大及心肌纤维化进程[64],但上述研究结果尚未在临床试验中进行验证。而通过胆碱类似物可逆性抑制TMAO合成酶进而有效减少循环血液中的TMAO含量从而辅助冠心病治疗已得到证实,并有望进入临床试验成为治疗冠心病的新药物[33,65]。由于TMAO与心力衰竭发病机制之间的研究尚浅,目前暂未有关于TMAO合成酶抑制剂用于心力衰竭治疗的研究。此外,亦有文献表明,增加保护性代谢产物短链脂肪酸的水平可以改善高血压、肾功能损害等传统心力衰竭风险因素,但其作为心力衰竭治疗的直接干预靶点并未得到实验证据的有力支持[66-69]。
6 小结
“肠道-心脏轴”的概念逐渐为研究人员所认知,越来越多的证据表明,肠道微生物可以通过其代谢产物及调节免疫炎性反应等方式与包括心力衰竭在内的多种心血管疾病产生复杂的交互作用,进而影响疾病的发生、发展。尽管现有关于心力衰竭与肠道微生物的临床类研究并不多,且肠道微生物和心力衰竭相互作用的内在具体机制也未完全明了,但微生物基因组学与代谢组学技术的快速发展也将促进肠道微生物在心力衰竭疾病进程中的相关作用机制的研究,并展示出其作为心力衰竭预防、诊断及治疗新型靶点的广阔应用前景。
本文文献检索策略:
以“microbiota”“heart failure”“trimethylamine N-oxide”“indoxyl sulfate”“short-chain fatty acid”为关键词检索PubMed、Web of Science、Google Scholar等数据库,对于正在研究中的实验通过临床实验注册中心网站获取。检索时间截止为2018年10月。文献纳入标准:肠道微生物及其代谢产物与心力衰竭相关的实验性文章及综述;排除标准:非SCI论文。
作者贡献:陈子俊进行文章的构思与设计,撰写论文;朱滨、杨春、杨玲进行文章的可行性分析,论文的修订,负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
