澳洲坚果幼树矿质元素含量对不同供磷水平的响应特征
2019-12-14杨为海曾利珍曾辉万继锋张汉周邹明宏陆超忠朱文华
杨为海 曾利珍 曾辉 万继锋 张汉周 邹明宏 陆超忠 朱文华

摘 要 以‘HAES741澳洲堅果品种为试材,采用沙培试验,研究营养液不同磷水平(0、0.01、0.1、0.5、2.5、10 mmol/L H2PO4-)下盆栽澳洲坚果幼树矿质元素(钾、磷、钙与镁)含量的变化。结果表明:随着供磷水平的升高,澳洲坚果幼树叶片、茎及根系的钾、磷含量在较低供磷水平(0~0.5 mmol/L)下增长较小或者无明显变化,但在较高供磷水平(2.5~10 mmol/L)时增幅较大,并且各器官的钾、磷含量均与不同供磷水平呈极显著性相关关系。不同供磷水平对茎的钙、镁含量影响不明显,随供磷水平的增加叶片的钙、镁含量显著降低,而根系的钙、镁含量则呈先下降后上升的趋势,均以0.1 mmol/L供磷处理含量较低。
关键词 澳洲坚果;磷;矿质元素;幼树中图分类号 S664.9 文献标识码 A
Response Characteristics of the Mineral Element Contents of Young Macadamia Trees to Different Phosphorus Levels
YANG Weihai1,2,3, ZENG Lizhen1,2,3, ZENG Hui1,2,3, WAN Jifeng1,2,3, ZHANG Hanzhou1,2,3,ZOU Minghong1,2,3, LU Chaozhong1,2,3, ZHU Wenhua4*
1. South Subtropical Crops Research Institute, Chinese Academy of Tropical Agricultural Sciences, Zhanjiang, Guangdong 524091, China; 2. Key Laboratory of Tropical Fruit Biology, Ministry of Agriculture and Rural Affairs, Zhanjiang, Guangdong 524091, China; 3. Hainan Tropical Crops Nutrition Key Laboratory, Zhanjiang, Guangdong 524091, China; 4. Guizhou Subtropical Crops Institute, Xingyi, Guizhou 562400, China
Abstract Using macadamia variety ‘HAES741 as materials, the sandy culture experiments were employed to investigate the changes of the contents of mineral elements (K, P, Ca and Mg) in the potted young trees of macadamia under different phosphorus levels (0, 0.01, 0.1, 0.5, 2.5 and 10 mmol/L H2PO4-) of nutrient solution. The results indicated that with the increase of phosphorus application level, the elements contents of K and P in leaf, stem and root of the young macadamia trees had a small growth or no significant change under the condition of low phosphorus nutrition level (0-0.5 mmol/L), while those increased significantly when supplied with high phosphorus level (2.5-10 mmol/L). In addition, there were highly significant correlations between the K and P contents of different organs and the phosphorus nutrition level. The effect of different phosphorus levels on the Ca and Mg contents in stem was not obvious, but the contents of Ca and Mg in leaf decreased significantly as phosphorus level increased, while those in root reduced firstly and then increased, and their minimums occurred under the 0.1 mmol/L phosphorus level.
Keywords macadamia; phosphorus; mineral element; young tree
DOI10.3969/j.issn.1000-2561.2019.10.017
磷是植物正常生长发育和新陈代谢所必需的大量营养元素之一。植物的磷主要来自土壤,而磷在土壤中的移动性很弱,且极易固着到土壤中的阳离子或团粒结构上,形成难溶性沉淀物,这使得土壤中的磷成为植物最难获取的大量元素[1-2]。在低磷或缺磷条件下,植物将产生一系列的形态、生理、生化和遗传机制主动适应胁迫逆境,一方面可以通过降低植株生长速率[3-4]、活化利用植物体内的磷[5-6]、修饰体内碳代谢过程[5, 7]等以减少对磷的需求,另一方面还可以通过增加根冠比[8-10]、改变根系形态与构型[11-13]、增强根系向外分泌有机酸阴离子与酸性磷酸酶[3, 5, 13],提高Pi载体表达水平[13-15]等来增强对磷的吸收。
澳洲坚果(Macadamiaspp.)系山龙眼科(Proteaceae)澳洲坚果属(Macadamia)常绿乔木果树,已在中国云南、广西与广东等省区的南亚热带地区广泛种植,成为了当地新兴的特色产业。然而,我国南亚热带地区的土壤主要为酸性红壤,有效养分贫乏,其中又以磷最为匮乏[16]。研究表明,在土壤缺磷或低磷时澳洲坚果植株易发生山龙眼状根[17],但山龙眼状根的发生程度主要取决于土壤的有效磷含量,高磷水平会抑制山龙眼状根的发生[17-20]。磷胁迫不仅影响澳洲坚果幼苗生长[21],也影响其叶片光合特性[22]与抗氧化保护酶活性[23],但有关澳洲坚果植株在低磷或高磷环境中对矿质元素的吸收与利用研究尚未见报道。因此,本文通过沙培试验研究营养液不同供磷水平对澳洲坚果植株各器官中主要矿质元素含量的影响,旨在为澳洲坚果植株确定合理的磷肥施用量和高效施肥提供科学依据。
1 材料与方法
1.1材料
试验于2017年在广东省湛江市中国热带农业科学院南亚热带作物研究所澳洲坚果试验基地进行,试验材料为正常生长的一年生‘HAES741澳洲坚果嫁接苗。盆栽试验所用的基质是经去离子水清洗干净的河沙,盆栽用具为14 L棕色塑料花盆。试验所浇灌的营养液选用Yoshida配方营养液,配置营养液所用的元素化合物均为分析纯,用去离子水配置。
1.2 方法
1.2.1 试验设计 试验设置6个不同供磷水平的营养液处理,磷浓度分别为0、0.01、0.1、0.5、2.5、10 mmol/L,并保证营养液的钾离子浓度均维持在10 mmol/L水平。不同供磷处理的磷浓度用KH2PO4·2H2O调配,钾离子浓度用K2SO4调整。营养液的pH用1.0% NaOH和1.0% H2SO4调整至5.8。于3月中旬,选取30株长势与大小基本一致的植株,将其根系所携带的土壤清洗干净后,分别移栽至以河沙为基质的塑料盆中,并置于避雨通风透光的大棚内培养。移栽后,先用去離子水浇灌植株5 d,然后每天施加不同供磷处理的营养液1 L,每个处理5株,单株重复。直至处理后60 d,取出植株且清洗干净,并将植株分成根、茎与叶等3部分样品,经105 ℃杀青30 min后于80 ℃烘干至恒重,再粉碎至80目后待测。
1.2.2 磷、钾元素含量的测定 称取0.2 g干样,采用浓H2SO4-H2O2消煮法消解样品,直至消煮液呈清亮透明状,冷却后用双蒸水定容至100 mL即为待测液,K含量采用火焰光度法测定,P含量采用钼锑抗显色法测定[24]。每份样品重复测定3次,计算每克干重样品中的元素含量。
1.2.3 钙、镁元素含量的测定 称取2.0 g干样,采用干灰化法-稀盐酸溶解法消解样品,经滤纸过滤后,滤液用双蒸水定容至100 mL即为待测液,再添加l mL 5%的氯化镧溶液后,应用原子吸收光谱仪(型号:PE AA-700)测定Ca与Mg的含量[24]。每份样品重复测定3次,计算每克干重样品中的元素含量。
1.3数据处理
应用Microsoft Excel 2007软件进行数据处理,采用SPSS 16.0统计软件对数据进行One-Way ANOVA(LSD检验)分析与回归分析。
2 结果与分析
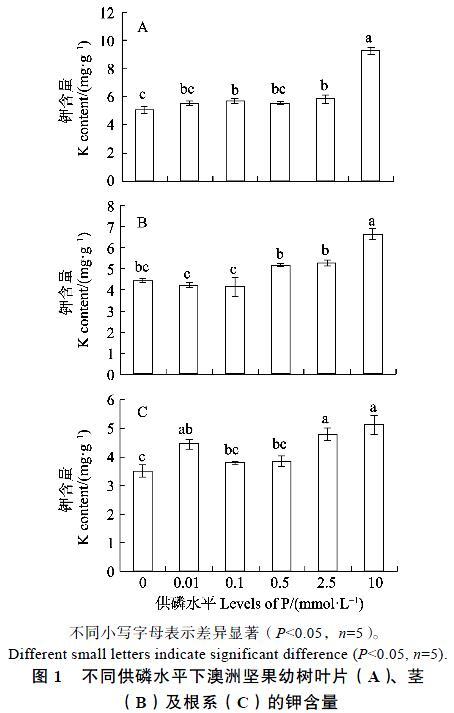
2.1不同供磷水平下澳洲坚果幼树的钾含量
2.1.1 叶片钾含量 不同供磷水平处理植株60 d后,叶片的钾含量随着供磷水平的增加而提高(图1A)。供磷水平在0~0.1 mmol/L时,叶片的钾含量从5.03 mg/g显著增加到5.67 mg/g;而供磷水平在0.1~2.5 mmol/L时,叶片的钾含量基本上保持平稳;但当供磷水平为10 mmol/L时,叶片钾含量迅速跃升至9.27 mg/g。
2.1.2 茎组织钾含量 随着供磷水平的增加,茎组织的钾含量总体上为不断增加的趋势(图1B)。当供磷水平在0~0.1 mmol/L时,钾含量不发生明显变化;而供磷水平在0.1~10 mmol/L时,钾含量则从4.78 mg/g 显著增加到6.63 mg/g,但供磷水平为0.5 mmol/L与2.5 mmol/L的2个处理间钾含量不存在显著性差异。
2.1.3 根系钾含量 根系的钾含量总体上随着供磷水平的增加而逐渐增加(图1C),但供磷水平0、0.1与0.5 mmol/L的3个处理间根系钾含量无显著性差异;供磷水平0.01 mmol/L处理的根系钾含量显著高于其不施磷处理的,但与供磷水平0.1、0.5、2.5、10 mmol/L的4个处理均差异不明显;当供磷水平在0.5~10 mmol/L时,根系的钾含量从3.85 mg/g显著增加到5.12 mg/g,而供磷水平2.5 mmol/L与10 mmol/L的2个处理间钾含量差异不显著。
不同小写字母表示差异显著(P<0.05,n=5)。
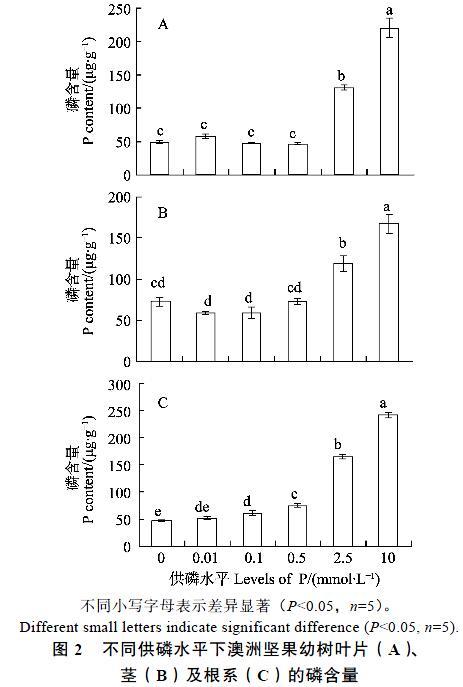
2.2不同供磷水平下澳洲坚果幼树的磷含量
2.2.1 叶片磷含量 供磷水平低于0.5 mmol/L时,叶片的磷含量变化不明显;而供磷水平在0.5~10 mmol/L时,叶片的磷含量从46.5 μg/g迅速增加到220.3 μg/g,累积增长了约3.7倍,并且3个供磷水平处理间的差异均达到显著性水平(图2A)。
2.2.2 茎组织磷含量 随着供磷水平的增加,茎组织的磷含量总体上呈不断增加的趋势(图2B)。供磷水平在0~0.5 mmol/L时,4个供磷水平处理间的磷含量差异不显著;而当供磷水平在0.5~10 mmol/L时,茎组织的磷含量则从72.1 μg/g显著增加到165.7 μg/g,累积增长了约1.3倍。
2.2.3 根系磷含量 根系的磷含量随着供磷水平的增加而明显提高(图2C)。供磷水平在0~0.5 mmol/L时,根系的磷含量从45.2 μg/g 显著增加到71.8 μg/g,累积增长了约0.6倍;而当供磷水平在0.5~10 mmol/L时,根系的磷含量从71.8 μg/g 迅速跃升至242.4 μg/g,累积增长了约2.4倍,3个供磷水平处理间的差异性十分显著。
不同小写字母表示差异显著(P<0.05,n=5)。
2.3不同供磷水平下澳洲坚果幼树的钙含量
2.3.1 叶片钙含量 缺磷条件下,叶片的钙含量显著低于供磷水平为0.01、2.5 mmol/L的2个处理,但明显高于供磷水平0.5 mmol/L处理;随着供磷水平的增加,叶片钙含量总体上呈下降的趋势(图3A)。当供磷水平在0.01~0.5 mmol/L时,叶片钙含量随供磷量的增加而明显下降,其钙含量从0.58 mg/g显著减少到0.32 mg/g;当供磷水平提高至2.5 mmol/L时,其钙含量却显著增加至0.51 mg/g,但与0.01 mmol/L与0.1 mmol/L的2个供磷处理间均无显著性差异;将供磷水平继续增加至10 mmol/L时,其钙含量则又显著下降至0.42 mg/g,但明显高于0.5 mmol/L供磷处理时的水平。
2.3.2 茎组织钙含量 茎的钙含量基本上随供磷水平的增加呈上升的趋势,但不同供磷水平处理间的钙含量差异均不显著(图3B)。
不同小写字母表示差异显著(P<0.05,n=5)。
2.3.3 根系钙含量 随着供磷水平的增加,根系的钙含量呈先下降后升高的趋势(图3C)。供磷水平在0~0.1 mmol/L时,根系的钙含量从0.58 mg/g 显著降低至0.41 mg/g;而当供磷水平在0.1~10 mmol/L时,其钙含量显著增加至0.62 mg/g,4个供磷水平处理间差异十分明显。
2.4不同供磷水平下澳洲坚果幼树的镁含量
2.4.1 叶片镁含量 随着供磷水平的增加,叶片的镁含量总体上呈不断下降的趋势(图4A)。供磷水平在0~0.5 mmol/L时,叶片镁含量从0.01 mmol/L供磷处理的最高值2.25 mg/g显著下降至供磷水平0.5 mmol/L时的1.67 mg/g,而供磷水平0~0.1 mmol/L间的3个处理无显著性差异;当供磷水平提高至2.5 mmol/L时,其镁含量却增加至2.11 mg/g,但与供磷水平0~0.5 mmol/L间的4个处理均无显著性差异;当供磷水平继续增加至10 mmol/L时,其镁含量又下降至1.35 mg/g,显著低于其他5个供磷处理。
不同小写字母表示差异显著(P<0.05,n=5)。
2.4.2 茎组织镁含量 茎组织的镁含量总体上随着供磷水平的增加而逐渐减少,但6个供磷水平处理间的镁含量无显著性差异(图4B)。
2.4.3 根系镁含量 随着供磷水平的增加,根系的镁含量呈先下降后升高的趋势(图4C)。供磷水平在0~0.1 mmol/L时,根系的镁含量从1.57 mg/g显著降低至1.26 mg/g;而当供磷水平提高至0.5 mmol/L时,其镁含量显著增加至1.62 mg/g ,但與供磷水平为0、0.01、2.5、10 mmol/L的4个处理间均无显著性差异。
2.5植株营养元素含量与不同供磷水平的相关性
表1显示了澳洲坚果幼树植株的叶片、茎及根系中钾、磷、钙与镁元素含量与不同供磷水平的相关性回归方程及相关系数。其中,叶片的磷、钾含量以及茎和根系的磷含量均与不同供磷水平呈极显著性的非线性一元二次回归关系,茎的钾含量则与供磷水平呈极显著正相关关系,而植株的钙、镁含量以及根系的钾含量随供磷水平的增加呈正相关或非线性一元二次回归关系,但其相关性均未达到显著性水平。
3 讨论
磷是构成植物体内许多大分子物质的重要组分,在碳水化合物的合成与运转、能量代谢、脂类代谢、光合作用和信号级联传导等过程中起着重要作用[5, 7]。供磷过多或过少都会影响植物对磷素的吸收,这在水稻[6, 25]、大豆[9-11]、脐橙[26]等多种作物上已有大量报道。研究表明,在生土基质中澳洲坚果幼苗叶片与根系的磷含量随施磷水平的增加而升高[18, 20]。本研究发现,经沙培的澳洲坚果幼树植株根系的磷含量也随营养液磷水平的逐步增加而显著升高,表明澳洲坚果根系对磷的响应度高,适量增施磷有利于根系对磷的吸收,与番茄[27]、大豆[28]、水稻[29-30]等作物上的研究结果一致。
植物主要通过根系吸收介质中的磷素营养,然后经木质部与韧皮部运输和分配至代谢部位[31]。就澳洲坚果植株不同器官的磷素积累而言,其根、茎、叶的磷含量均与不同供磷水平呈极显著性的非线性一元二次回归关系,各器官的磷含量在较低供磷水平(0~0.5 mmol/L)时增幅较小或者无明显变化,但在较高供磷水平(2.5~10 mmol/L)时增幅较大,说明在一定供磷量内各器官对磷的吸收具有协同作用[19],也表明澳洲坚果幼树植株在较高的供磷量下具有较强的磷素吸收效率,这可能与其根系磷动力学参数在供磷水平较高时发生改变有密切的关系[32-34]。本研究发现,在较高供磷水平时澳洲坚果幼树植株各器官的磷含量增幅表现为叶片>根系>茎,表明磷是向代谢活动强的器官(叶片与根系)再分配的元素[31],与磷素在器官间的高转运效率有关[25, 35-36]。然而,随着供磷水平的增加,澳洲坚果幼树植株地上部的磷含量占植株总磷量的比例变化与其根系相反,低磷使得磷素向地上部的转移分配增加,高磷则增加了磷素在根系中的积累,与吴一群等[27]在番茄上的报道类似。
植物各矿质元素之间存在紧密的相关关系。不同供磷水平不仅影响植物的磷素积累,也影响其对钾、钙、镁等矿质元素的吸收[26-27, 37-38]。研究结果显示,澳洲坚果幼树植株的钾含量变化与其磷含量基本一致,各器官的钾含量均随供磷水平的增加而显著提高,表明澳洲坚果植株对钾、磷元素的吸收具有协同效应,与前人在番茄[27]、水稻[29]、玉米[38]、烤烟[39]等作物上的研究结果相似。低磷条件下澳洲坚果植株钾含量较低的原因可能是其根系有机酸的分泌伴随K+的流出所致[20],适量增施磷可以提高植株对钾的吸收。
磷营养对植株不同部位钙、镁元素含量的影响与植物的种类与品种有关[27, 37-38]。本研究中,不同供磷水平对澳洲坚果幼树植株茎组织的钙、镁含量影响不明显,与吴一群等[27]在番茄上的研究结果一致。研究结果表明,澳洲坚果幼树叶片的钙、镁含量总体上随供磷水平的增加而显著降低,这与樊卫国等[26]在纽荷尔脐橙幼树叶片上的研究结果相反,但与郝小雨等[40]对油菜地上部的研究结论相似。然而,在较低供磷水平(0~0.1 mmol/L)下澳洲堅果幼树根系的钙、镁含量亦随供磷量的增加而明显下降,说明低磷环境有利于植株对钙、镁元素的吸收与利用;但在较高供磷水平(0.5~10 mmol/L)下其根系的钙、镁含量明显增加,表明高磷主要影响植株钙、镁元素向地上部运输,造成根系钙、镁积累量增加[27]。
参考文献
[1] Holford I C R. Soil phosphorus: its measurement, and its uptake by plants[J]. Australian Journal of Soil Research, 1997, 35: 227-239.
[2] Schachtman D P, Reid R J, Ayling S M. Phosphorus uptake by plants: from soil to cell[J]. Plant Physiology, 1998, 116: 447-453.
[3] 陈永亮, 李修岭, 周晓燕. 低磷胁迫对落叶松幼苗生长及根系酸性磷酸酶活性的影响[J]. 北京林业大学学报, 2006,28(6): 46-50.
[4] 林志豪, 冯健禹, 郭勇祥, 等. 供磷水平对黄瓜测序品种“中国龙”生长及磷吸收的影响[J]. 华南农业大学学报,2015, 36(3): 54-58.
[5] Plaxton W C, Tran H T. Metabolic adaptations of phosphatestarved plants[J]. Plant Physiology, 2011, 156: 1006-1015.
[6] Wissuwa M, Kondo K, Fukuda T, et al. Unmasking novelloci for internal phosphorus utilization efficiency in ricegermplasm through genome-wide association analysis[J].PLoS One, 2015, 10: e0124215.
[7] Plaxton W C, Carswell M C. Metabolic aspects of the phosphatestarvation response in plant[M]//Lerner H R. Plant responsesto environmental stress: from phytohormones to genomereorganization. New York: Marcel-Dekker, 1999:350-372.
[8] 谢钰容, 周志春, 金国庆, 等. 低磷胁迫对马尾松不同种源根系形态和干物质分配的影响[J]. 林业科学研究, 2004,4(3): 272-278.
[9] 丁玉川, 陈明昌, 程 滨, 等. 北方春大豆磷高效基因型的筛选[J]. 植物营养与肥料学报, 2006, 12(4): 597-600.
[10] 乔振江, 蔡昆争, 骆世明. 低磷和干旱胁迫对大豆植株干物质积累及磷效率的影响[J]. 生态学报, 2011, 31(19):5578-5587.
[11] 严小龙, 廖 红, 戈振扬, 等. 植物根构型特性与磷吸收效率[J]. 植物学通报, 2000, 171(6): 511-519.
[12] Lynch J P, Brown K M. Topsoil foraging: an architecturaladaptation of plants to low phosphorus[J]. Plant and Soil,2001, 237(2): 225-237.
[13] Raghothama K G, Karthikeyan A S. Phosphate acquisition[J].Plant and Soil, 2005, 274: 37-49.
[14] Baker A, Ceasar S A, Palmer A J, et al. Replace, reuse, recycle:improving the sustainable use of phosphorus by plants[J].Journal of Experimental Botany, 2015, 66(12): 3523-3540.
[15] Heuer S, Gaxiola R, Schilling R, et al. Improving phosphorususe efficiency: a complex trait with emerging opportunities[J]. The Plant Journal, 2017, 90: 868-885.
[16] 雷宏军, 朱端卫, 刘 鑫, 等. 酸性土壤在改良条件下磷的吸附-解吸特性[J]. 土壤学报, 2004, 41(4): 636-640.
[17] 蒋建国, 李晓林, 倪书邦, 等. 山龙眼状根对澳洲坚果生长的影响[J]. 中国南方果树, 2000, 29(6): 28-30.
[18] 岳 海, 熊朝阳, 潘育文, 等. 澳洲坚果幼苗耐磷强度初探[J]. 热带作物学报, 2010, 31(3): 355-362.
[19] 岳 海, 李国华, 陈丽兰, 等. 不同供磷水平下澳洲坚果幼苗排根发生及磷素利用[J]. 中国生态农业学报, 2010, 18(4): 753-757.
[20] 肖晓明, 刘军生, 周 程, 等. 不同磷水平下澳洲堅果幼苗根系分泌物的差异[J]. 热带作物学报, 2014, 35(2): 261-265.
[21] 习金根, 孙光明, 陆超忠, 等. 不同基因型澳洲坚果对磷胁迫反应的差异研究[J]. 广东农业科学, 2007, 7: 50-53.
[22] 刘建福. 磷胁迫对澳洲坚果幼苗叶片光合作用的影响[J]. 西南师范大学学报(自然科学版), 2007, 32(2): 45-48.
[23] 刘建福. 磷胁迫对澳洲坚果膜脂过氧化及保护酶活性的影响[J]. 热带作物学报, 2007, 28(1): 7-10.
[24] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
[25] 李 前, 侯云鹏, 高 军, 等. 不同供磷水平对水稻干物质累积、磷素吸收分配及产量的影响[J]. 吉林农业科学, 2015, 40(3): 37-41.
[26] 樊卫国, 王立新. 不同供磷水平对纽荷尔脐橙幼树生长及叶片营养元素含量的影响[J]. 中国农业科学, 2012, 45(4): 714-725.
[27] 吴一群, 林 琼, 颜明娟, 等. 不同磷素水平对番茄生长及养分吸收的影响[J]. 中国农学通报, 2017, 33(9): 74-77.
[28] 丁玉川, 陈明昌, 程 滨, 等. 磷营养对不同大豆品种生长和磷吸收利用效率的影响[J]. 华北农学报, 2006, 21(1): 121-124.
[29] 郭再华, 贺立源, 徐才國. 磷水平对不同耐低磷水稻苗根系生长及氮、磷、钾吸收的影响[J]. 应用与环境生物学报, 2006, 12(4): 449-452.
[30] 王 静, 章林平, 王利鹃, 等. 不同磷素水平对水稻根系生长及部分营养元素吸收的影响[J]. 西南大学学报(自然科学版), 2015, 37(7): 1-8.
[31] 黄建国. 植物营养学[M]. 北京: 中国林业出版社, 2004.
[32] Nielsen N E, Barber S A. Differences among genotypes of corn in the kinetics of P uptake[J]. Agronomy Journal, 1978, 70: 695-698.
[33] Fontes P C R, Barber S A, Wilcox G E. Prediction of phosphorus uptake by two tomato cultivars growing under insufficient and sufficient phosphorus soil conditions using a mechanistic mathematical model[J]. Plant and Soil, 1986, 94: 87-97.
[34] Ae N, Arihara J, Okada K,et al. Phosphorus uptake by pigeon pearole in cropping systems of the indian subcontinent[J]. Science, 1990, 248: 447-480.
[35] Smith F W, Jackson W A, Vandenberg P J. Internal phosphorus flows during development of phosphorus stresses in stylosanthes hamata[J]. Plant Physio1ogy, 1990, 17: 451-464.
[36] Schachtman D P, Reid R J, Ayling S M. Phosphorus uptake by plants: from soil to cell[J]. Plant Physio1ogy, 199, 116: 447-453.
[37] 吴照辉, 贺立源, 严 昶, 等. 低磷胁迫对水稻地上部钙、镁吸收和积累的影响[J]. 应用与环境生物学报, 2009, 15(3): 295-300.
[38] 章爱群, 贺立源, 门玉英, 等. 磷水平对不同耐低磷玉米基因型幼苗生长和养分吸收的影响[J]. 应用与环境生物学报, 2008, 14(3): 347-350.
[39] 王艳丽, 刘国顺, 丁松爽, 等. 磷用量对烤烟根系及其与地上部关系的影响[J]. 应用生态学报, 2015, 26 (5): 1440-1446.
[40] 郝小雨, 廖文华, 刘建玲, 等. 过量施磷对油菜吸收矿质养分的影响[J]. 河北农业大学学报, 2009, 32(3): 26-30.
