谷氨酰胺转氨酶改性核桃谷蛋白的结构表征分析
2019-12-13张爱琴齐凤敏赵爱萍马舒婕程怡媚孙王晓雯孔令明
张爱琴 齐凤敏 赵爱萍 马舒婕 程怡媚孙 乾 李 芳 王晓雯 孔令明
(新疆农业大学食品科学与药学学院1,乌鲁木齐 830052) (甘肃省陇东学院农林科技学院2,庆阳 745000) (新疆轻工职业技术学院3,乌鲁木齐 830021) (新疆正生营养研究院(有限公司)4,昌吉 831100)
谷氨酰胺转氨酶(E.C. 2.3.2 13)也被称作转谷氨酰胺转氨酶(Transglutaminase,TGase或TG酶)。是一种从微生物体中提取的,具有定向性催化转酰基化反应,并能够促进蛋白质分子内和分子间发生酰基化转移的生物性酶[1]。
TG酶可以使蛋白质中肽链上的谷氨酰胺残基与酰基发生酰基转移化,导致蛋白质分子内和分子间形成ε-(γ-谷氨酰基)赖氨酸共价键[2],对于植物性蛋白与动物性蛋白的蛋白分子都具有一定的催化交联作用,对蛋白功能特性和质构特性具有一定程度的改善。
TG酶还能有效地改善蛋白质的溶解性、持水性等功能特性,催化植物性蛋白(大豆、花生蛋白)的分子结构和功能性质发生变化,使食品外观化、风味化以及质构性具有相应的改变,赋予蛋白新的质构以及口感,在大豆分离蛋白的改性上也有较多的运用[3],能够使改性后的大豆蛋白在乳化稳定性、起泡性、凝胶性以及热稳定性上有较为显著的改变。Qin等[4]的研究表明,TG酶对于大豆分离蛋白和小麦面筋均有一定的交联化作用,且这种交联化作用使得其凝胶特性、凝胶化能力更为突出;TG酶在大豆改性中可以增强大豆蛋白的凝胶特性以及相应的热稳定性[5];而在大豆蛋白的相应产品中,TG酶常被用作一种凝胶乳化剂以提升产品的乳化能力和胶凝程度[6];Zhao等[7]发现,超声辅助TG酶处理,可改善胶体的界面特性,提高乳化性和发泡性,并针对疏水间以及二硫键作用进行了深入研究;Hu等[8]在研究中指出,TG酶可改善蛋白质的乳化活性,引起的交联化可以有效地提高蛋白的凝胶性状,但乳化性的改善并不显著,相应的乳化稳定性也有一定程度的下降;正是由于TG酶在自然界中较为常见,且天然性、可接受性、可降解性逐渐被认可,因此在食品中受到广泛的应用,是食品工业中较为常用的酶制剂之一[9]。
目前,对于大豆、大米、花生等植物性蛋白的研究较多,但对于核桃蛋白(谷蛋白)的研究可用性以及可行性资料都较少。不能满足实际生产的需要。核桃蛋白由谷蛋白、醇溶蛋白、清蛋白和球蛋白组成,其中谷蛋白与醇溶蛋白占总蛋白的70%[10],因此使得核桃蛋白的功能性较差,不被食品工业所广泛应用。实验利用TG酶对核桃谷蛋白进行改性,以溶解度、巯基与二硫键等指标为依据,以未改性的核桃谷蛋白作对照,并结合光谱图分析核桃谷蛋白改性前后功能特性以及蛋白分子结构表征的变化。为核桃蛋白的综合性利用、产业化生产、高质化精深加工提供理论性参考指导。
1 材料与方法
1.1 材料与设备
核桃谷蛋白(Walnut gluten,WG);谷氨酰胺转氨酶(100 U/g);磷酸氢二钠、磷酸二氢钠、NaOH、HCl:分析纯。
SENS-9003荧光光谱分析仪、TU-1810PC紫外可见分光光度计;FTIR-8400S傅里叶变换红外光谱仪、J-810圆二色谱仪。
1.2 试验方法
1.2.1 核桃谷蛋白的制备
工艺提取流程参照Sze-Tao的Osborne分级提取法[10]:核桃饼粕→脱脂核桃粕→加去离子水→离心→沉淀→加NaCl→离心→沉淀→加70%乙醇→离心→沉淀→加NaOH调pH值→离心→上清液→加HCl调pH至等电点→离心→沉淀→水洗至中性→真空冷冻干燥→核桃谷蛋白(Walnut gluten,WG)
1.2.2 改性蛋白的制备
WG→溶解→搅拌→加酶→混匀振荡反应→灭酶→冷却→水洗至中性→真空冷冻干燥→TG酶改性核桃蛋白。
称取核桃蛋白2.4 g,边搅拌边加入0.2 mol/L pH 7.0磷酸缓冲液溶解,配成蛋白浓度为6%~8%的悬浮液;添加TG酶,200次/min振荡反应,在反应温度为50 ℃、反应pH值为8.0的条件下充分反应2 h后置于水浴锅中90 ℃灭酶10 min;震荡水浴后取出,迅速置于冰箱冷冻结冰,真空冷冻干燥机干燥24 h,即得TG酶改性蛋白(TG enzyme modified protein,TGMP),密闭保藏。
1.2.3 溶解度的测定
根据Horax法稍作改动[11]。配制1%WG与TGMP样液各10 mL,室温下磁力搅拌0.5 h左右,溶液以4 500 r/min离心15 min,留取上清液待用;取空试管,加入5 mL考马斯G-250,加入50 μL去离子水,再加入50 μL上清液,剧烈振荡1 min左右以混匀;放置10 min,在波长595 nm处测量,对照组加入5 mL考马斯G-250,再加入100 μL去离子水。蛋白质的溶解度表示为上清液蛋白浓度占总蛋白浓度的百分比。溶解度计算如式(1)。

(1)
1.2.4 巯基与二硫键测定
游离巯基含量(SH)的测定:取30 mg蛋白样品分散于Ellman′s试剂中,使用离心机4 800 r/min离心15 min,在波长412 nm处测量。
总巯基含量(Total SH)的测定:称取30 mg蛋白溶于10.0 mL混合试剂中(精确称取20.84 g Tris、13.51 g甘氨酸、2.98 g EDTA二钠和960.96 g碳酰二胺,加去离子水定容至1 000 mL)中,在波长412 nm处测量。巯基含量计算如式(6-1)。
(2)
式中:73.53 μmol/L为消光转化系数;A412为吸光度;D为上清液稀释(倍数);C为上清液中蛋白含量。
二硫键的测定:取50 mg蛋白样品分散于100 μL Tris-base缓冲液中,再加入到NTSB溶液中,室温静置1 h,使用离心机10 000 r/min离心10 min,在波长412 nm处测量,对照组加入NTSB溶液。
1.2.5 荧光分光光度分析
使用荧光分光光度计对WG与改性蛋白的三级结构进行测定。将蛋白稀释于pH为7.0的磷酸盐缓冲液中,使其质量浓度为0.3 mg/mL。调整激发波长为310 nm,发射波长为450 nm,选择发射波长的测定范围是400~500(410~460)nm。激发和发射狭缝均为5 nm,扫描速率1 200 nm/min,扫描电压为450 mV。每个样品重复做3次扫描[12]。
1.2.6 紫外分光光度分析
使用紫外分光光度计对WG与改性蛋白的三级结构进行测定。将WG与TGMP样品稀释于pH为7.0的磷酸盐缓冲液中,使其质量浓度为0.1 mg/mL。取约5 ml样液置于置于1 cm的石英比色皿,用分光光度计测定样品的吸光度值,样品的扫描波长范围为200~400 nm[13]。
1.2.7 傅立叶红外光谱分析
使用傅里叶红外光谱对WG与改性蛋白的二级结构进行测定。分别称取2 mg的WG与TGMP样品,加入溴化钾至200 mg(将样品与干燥的溴化钾以1∶100混合),用研钵研磨成均匀粉末,压制成薄片,使用傅立叶红外分光光度仪在分辨率4 cm-1,波数精度0.01 cm-1上作(4 000~400 cm-1)全波段扫描,扫描32或128次,环境温度25 ℃[14]。
1.2.8 圆二色光谱分析
使用圆二色光谱对WG与改性蛋白的二级构象进行测定。精确称取WG样品溶解于pH为7.0的磷酸缓冲液中,调蛋白浓度为0.3 mg/mL。在25 ℃条件下放置3 h,采用圆二色光谱仪测定WG的圆二色性。取约5 ml样液置于2 mm石英比色皿中,选择扫描的波长为190~250 nm,扫描速率为100 nm/min,响应温度为25 ℃,灵敏度为100 mdeg/cm,分辨率为0.5 nm[15]。所测出的图谱需扣除缓冲液的空白差,每个样液重复扫描8次取平均值,蛋白的二级结构采用JASCO结构软件进行分析,圆二色性以残基摩尔椭圆率表示(℃·cm2/dmol)。
1.3 数据处理
每个试验做3次重复实验,试验结果以误差的形式标出。运用Excel 2003进行图形绘制,光谱图采用系统自带软件进行分析。
2 结果与分析
2.1 溶解度的测定分析
溶解度常被作为一种指标以此评价蛋白质的功能特性发生相对程度的改变。WG的溶解度为17.43%,而经过改性的TGMP的溶解度为:34.29%,溶解度提高了约96.75%。对于交联化酶解产物,其最先使得氢键发生断裂,其次可能作用于极性基团(—NH3+, —COO-)的数量增加,因此其溶解性会有相应的增加[16];其次,还有可能是由于TG酶对蛋白质中的谷氨酸以及赖氨酸残基产生交联化,使其蛋白质分子间以及蛋白分子内部都逐渐发生了交联化,因而所产生的蛋白质网络空间结构发生一定变化[17]。
2.2 巯基与二硫键分析
巯基与二硫键含量对于蛋白质二级和三级空间构象的稳定有着很重要的作用,巯基与二硫键之间的交换作用可使得蛋白分子间发生凝聚[18]。由图1可知,WG的游离巯基和二硫键含量分别为12.41 μmol/g和21.24 μmol/g,WG的大部分巯基都游离在蛋白质表面,且游离巯基的数量与总巯基的数量较为接近。TGMP的游离巯基仅有26%左右是游离在蛋白质表面,且TGMP的溶解度相比WG的溶解度有较高的提升,这可能是因为添加了TG酶,产生了TG酶的交联改性作用,一方面促使亲水性的基团逐渐分布于蛋白质表面,而疏水性的巯基基团被逐渐包埋于蛋白质内部,另一方面可能是由于其中部分的游离巯基产生断裂,转而与TG酶形成交联化,导致游离巯基的数量有一定的减少。在蛋白质的空间结构中,巯基和二硫键是维持蛋白分子空间结构稳定以及改变一定功能特性的重要化学键[19],这些化学键的断裂、结合、重组,都可以使得蛋白质的更高级结构产生一定的变化,而这些变化往往又与蛋白质的功能特性紧密结合。
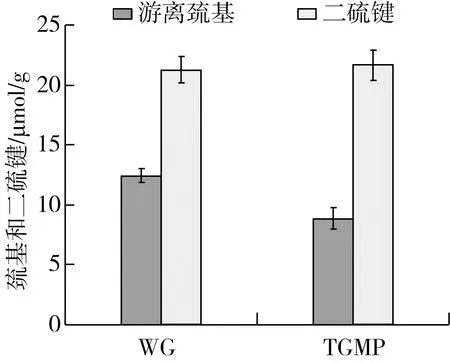
图1 核桃谷蛋白与改性蛋白的巯基与二硫键含量
2.3 荧光光谱分析
使用荧光分光光度计对WG与TGMP进行扫描测定。蛋白质本质是由氨基酸通过肽键的相互连接、相互组合等方式,形成具有加大空间、较大结构性的大分子类物质。因此这种构成方式使得蛋白质分子内具有大量的基团可以被解离,而这些基团在受到外界影响时会发生一定变化,诸如氨基、羧基、羟基等,这些变化也会改变蛋白质的构成,进而影响蛋白质功能特性上的改变[20]。由图2可以看出,在310 nm的激发波长处所产生的荧光光谱主要是由于谷蛋白中存在一定量的色氨酸所造成的,谱图上显示的荧光峰实质为色氨酸基团由于光激发产生的电子跃迁所导致,峰的位置在428~432 nm。
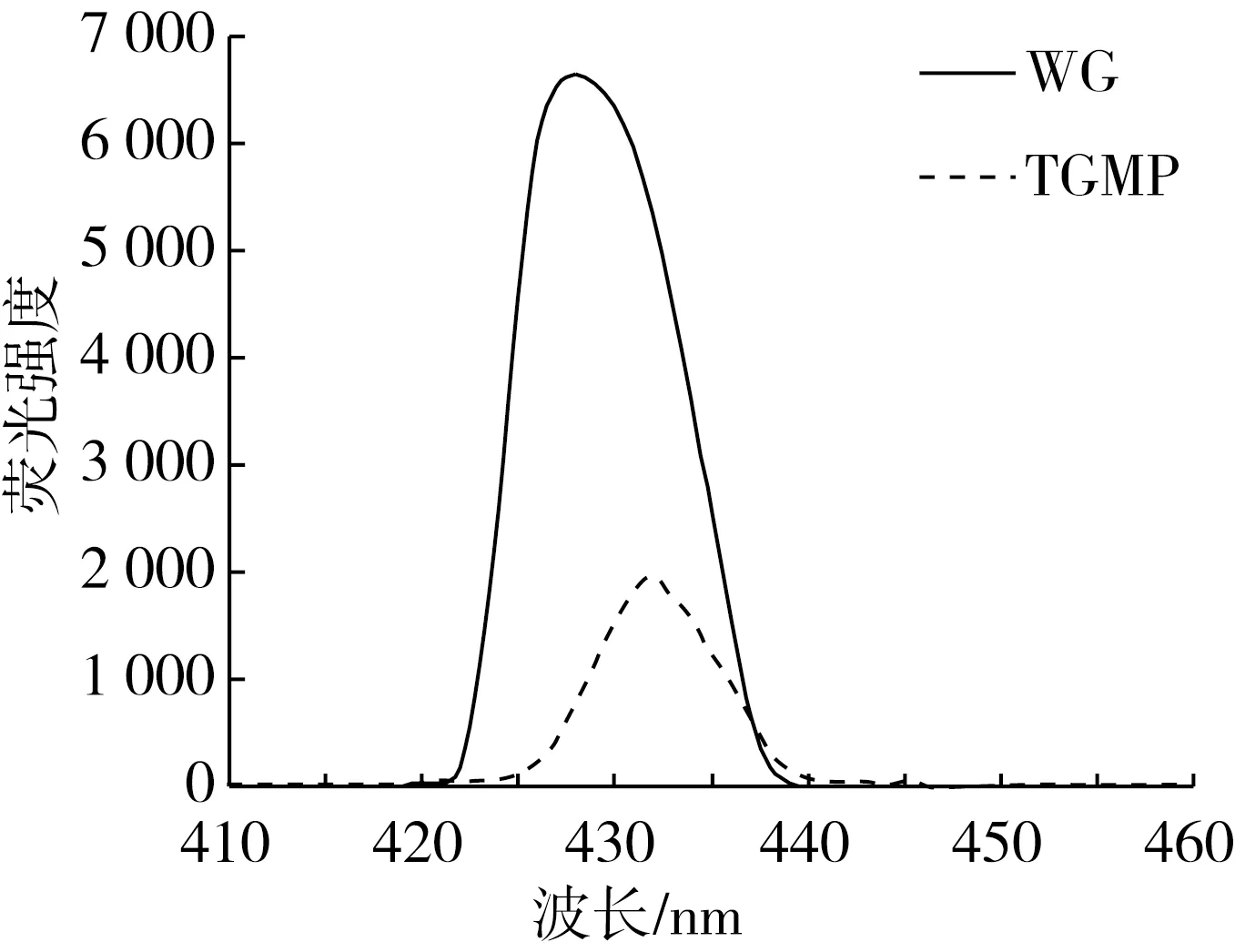
图2 WG与TGMP的荧光光谱
TGMP的酶法改性是由于适度的酶解蛋白,使蛋白分子水解成多肽以及肽链,打开了蛋白质卷曲的结构,蛋白质分子逐渐展开分子链,蛋白质侧链的改变影响着蛋白质三级结构的变化;由于外界环境的改变,使蛋白质由原本的折叠状态逐渐展开呈伸展状态,此时的蛋白质也从有序结构向无序结构转变,发生去折叠化现象。
改变蛋白质内部结构以及蛋白质所处的微环境,都可以使蛋白质中氨基酸发生相应变化,而蛋白质分子内与蛋白质分子表面的氨基酸残基会决定蛋白质的亲水性与疏水性,亲水性氨基酸会在蛋白质外部形成亲水性区域,而疏水性氨基酸会在蛋白质内部形成疏水性区域。一部分色氨酸从疏水性区域游离到亲水性区域,其氨基酸残基暴露在极性环境下,从而导致其荧光强度下降;另一部分色氨酸逐渐被“包埋”于分子内部,其所处的微环境极性降低,从而也导致了荧光强度下降[21]。亲水性基团的暴露,疏水基团的包埋,使得亲水性极大增强,溶解度极大提高。
2.4 紫外光谱分析
目前,紫外光谱分析已成为检测分子间相互作用以及分子结构变化的有效工具,蛋白的表面疏水性对蛋白质三级以及四级结构的变化有重要作用,蛋白的紫外吸收最为关键在于蛋白质侧链上的色氨酸、酪氨酸和苯丙氨酸残基,以及与一部分组氨酸和半胱氨酸基团有相关性。前三种氨基酸在蛋白中的存在以及存在的数量性直接决定了蛋白的紫外吸收强度水平,而组氨酸和半胱氨酸基团所产生的影响性以及相关性要弱于前三个氨基酸,而蛋白表面疏水性和紫外吸收的变化也反映了蛋白质构象的变化。
由图3可知,WG的最大紫外吸收波长为284 nm,这种显示反映了WG的紫外吸收主要是由于其蛋白内的色氨酸和酪氨酸残基所引起的。WG的最高紫外吸收峰出现在284 nm处的0.47,而TGMP的最高紫外吸收峰出现在277 nm处的0.57;吸收度表现出略有增加,且此时TGMP的紫外吸收峰也相应出现了蓝移,这都说明了色氨酸、酪氨酸等残基基团在数量上以及所处微环境的极性状态上均发生了改变。蛋白的紫外吸收可以反映出其内部空间构象的改变,吸光度的改变表明了蛋白结构受到了一定程度的破坏,内部的亲水区域逐步暴露于蛋白分子的外部,原本暴露在蛋白外的色氨酸、酪氨酸以及苯丙氨酸被逐渐包埋,取而代之的是更多亲水性的氨基酸显露并附在蛋白质外侧,因而会增加蛋白的亲水能力。
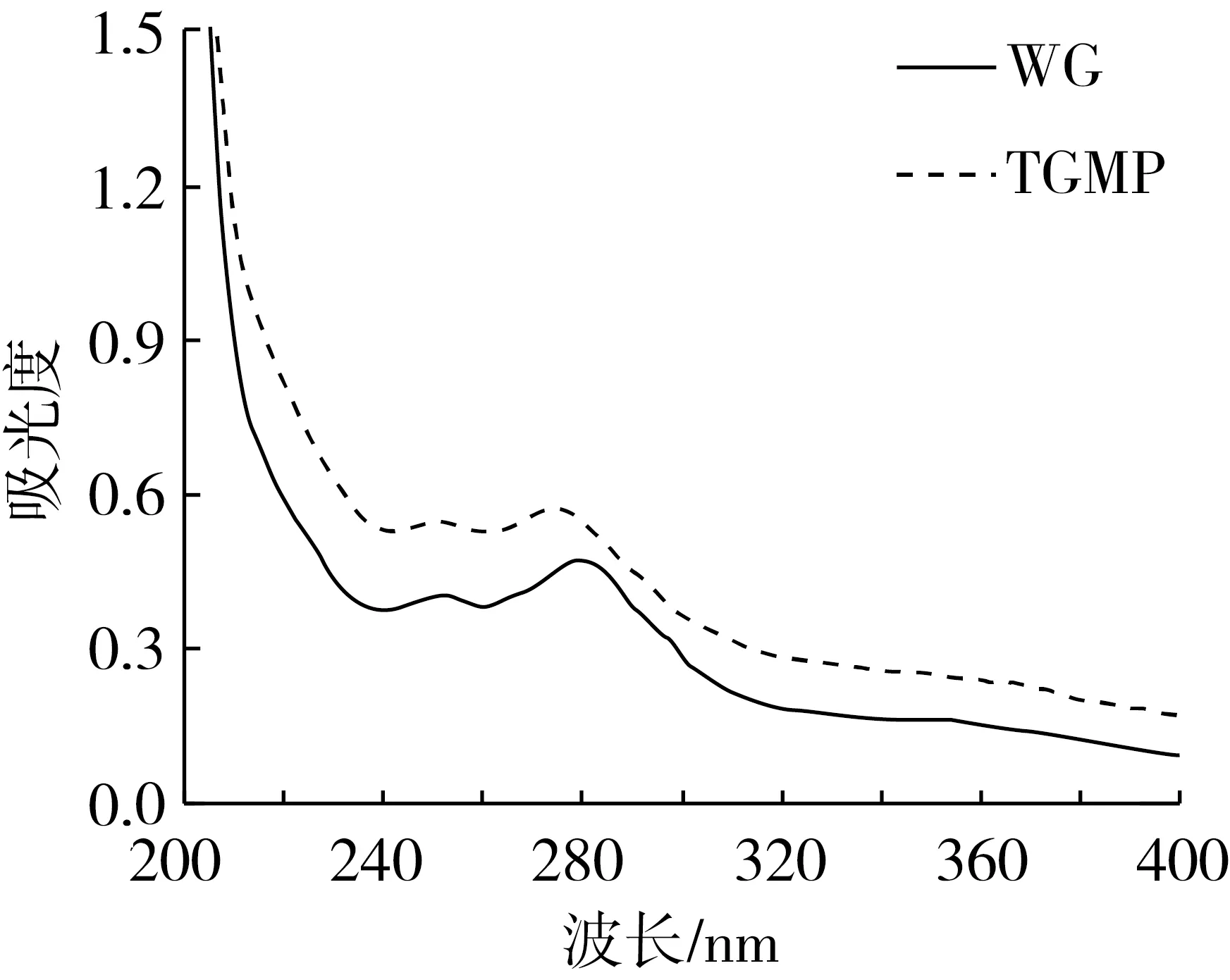
图3 WG与TGMP的紫外光谱
2.5 红外光谱分析
蛋白质中的二级结构通常包括:α-螺旋、β-转角、β-折叠和无规卷曲。在酰胺Ⅰ带上是蛋白不同二级结构信息的叠加,对谱图可以进行线性拟合以确定出结构与峰形之间的相对应关系。在1 700~1 600 cm-1的酰胺Ⅰ带一般是蛋白质所在的特征峰,也常用于蛋白质二级结构的分析,这主要是由于蛋白质中含有C—O键伸缩振动所形成的,也正是因为这样,此处的信号较强[22]。蛋白质作为两亲性结构的代表,疏水性和亲水性是决定了其乳化性的一个重要指标。
WG主要由其中的谷蛋白组成,这也使得WG对持水性的能力较差,因受到TG酶的改性作用后,改性蛋白在空间结构上受到一定程度的破坏,大量的亲水性基团暴露,这也使得WG的亲水性有很大的提高。对去酰胺Ⅰ带的谱带进行分析归类:在1 660~1 650 cm-1为α-螺旋;在1 690~1 670 cm-1和1 640~1 610 cm-1为β-折叠;在1 700~1 690 cm-1和1 670~1 660cm-1为β-转角;在1 650~1 640 cm-1为无规则卷曲结构[23]。




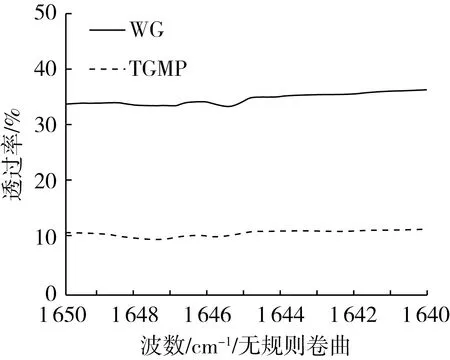
图4 WG与TGMP的红外光谱
2.6 圆二色光谱分析
圆二色谱常被用作定量分析植物性蛋白二级结构的组成,且可分为远紫外和近紫外两个区域,远紫外区是肽键所在的吸收范围,其能够较为直观的反映肽链的结构。在远紫外光区,210 nm处的负峰显示了具有α-螺旋结构,而α-螺旋结构过于稳定,在一定程度上会阻止蛋白的构象受到改变,蛋白质趋于稳定状态,不利于蛋白功能特性的改变;相比α-螺旋结构,β-折叠与无规则卷曲结构使得蛋白稳定性较差,从而促使蛋白的柔性以及功能特性有良好的改变。
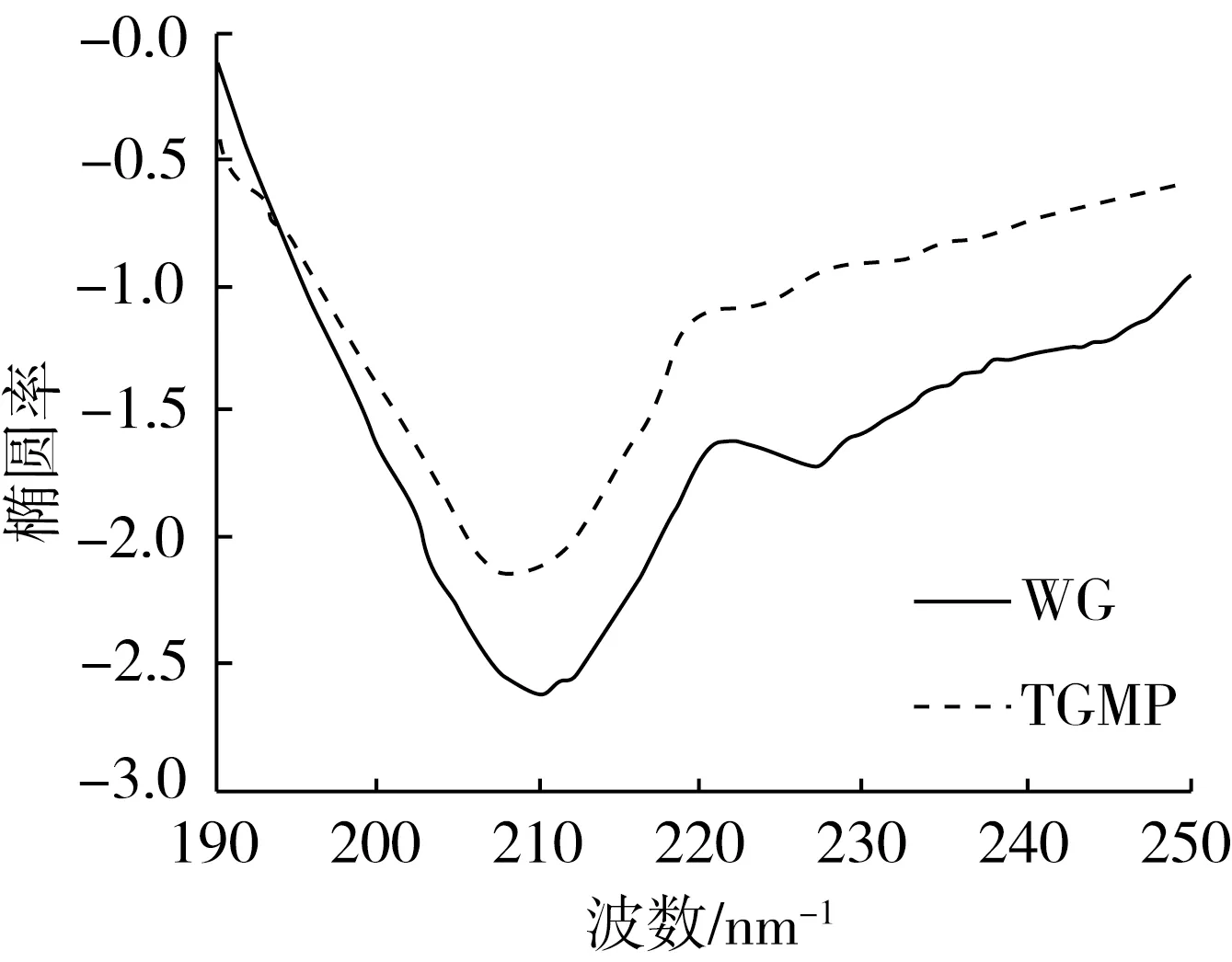
图5 WG与TGMP的圆二色光谱
表1 核桃谷蛋白与改性蛋白二级结构变化的对比分析
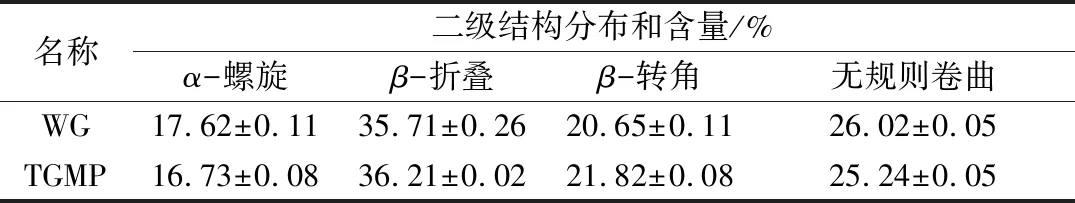
名称二级结构分布和含量/%α-螺旋β-折叠β-转角无规则卷曲WG17.62±0.1135.71±0.2620.65±0.1126.02±0.05TGMP16.73±0.0836.21±0.0221.82±0.0825.24±0.05
经实验数据分析表明,WG的二级结构主要为β-折叠,且α-螺旋结构占17.62%,平均是改性蛋白的1.05倍,β-转角与无规则卷曲结构含量基本一样。而TGMP的α-螺旋结构与无规则卷曲结构有一定下降,β-折叠结构与β-转角结构有一定上升,虽然这种变化趋势表现不明显,但从变化趋势以及α-螺旋结构与β-折叠结构的比值可以看出,蛋白的二级结构从一种稳定状态趋向于另一种稳定状态转变。Kato等在研究中发现,蛋白分子的柔性越好,相应表现出蛋白的乳化特性越好[25],而这种比例的改变结合溶解度的提升都表明了核桃蛋白分子柔性的转变,改变了原本蛋白的双亲性质。
3 结论
经过TG酶改性后的蛋白溶解度提高了96.75%,这可能与氢键的断裂、二硫键相对增多以及游离巯基相对减少有关;由总巯基与二硫键分析得出,蛋白的游离巯基是决定亲水性的主要原因,蛋白分子内部以及分子间化学键的变化,都可以引发蛋白相对高级结构的变化,而结表征性的变化又会影响到蛋白外在的功能特性。
由荧光光谱分析得出,吸收峰出现了蓝移现象,说明当内部的色氨酸与外部的环境(pH、温度等)发生改变时,蛋白质的高级结构也会发生相应的改变。通过荧光强度的被影响可知,蛋白的亲水性以及疏水性发生了一定的变化;由紫外光谱分析得出,蛋白的最大紫外吸收波长在284 nm处,说明了吸收主要来自分子内部的色氨酸和酪氨酸残基,且吸收峰出现了红移现象,这间接表明了氨基酸的极性状态发生了一定改变;由红外光谱分析得出,蛋白在受到改性后,其疏水性的基团逐渐减少,而亲水性的基团逐渐增多;由圆二色光谱分析得出,α-螺旋结构有较为明显的下降,β-折叠结构有一定的上升,α-螺旋与β-折叠的比例也表明了蛋白二级结构的变化;圆二色谱中蛋白二级结构的分布也证明了WG与TGMP在分子结构上的变化,WG更偏重于α-螺旋结构,而TGMP则更偏重于β-折叠与β-转角结构。
