子宫内膜息肉组织中FSHR和LHR的表达及意义
2019-12-12徐超逸王丹菡余丹扬程静段萍
徐超逸 王丹菡 余丹扬 程静 段萍


[摘要] 目的 探討卵泡刺激素受体(Follicule stimulating hormone receptor,FSHR)、黄体生成素受体(Luteinizing hormone receptor,LHR)与子宫内膜息肉发生的相关性。 方法 运用实时荧光定量PCR方法(Real-time Quantitative polymerase chain reaction,real-time PCR)以及免疫印迹方法(Southwestern blotting,WB)从基因水平以及蛋白水平测定2016年12月~2017年11月在我院行宫腔镜下子宫内膜息肉摘除术患者子宫内膜息肉及其旁正常子宫内膜中FSHR、LHR的表达差异。 结果 通过real-time PCR结果显示子宫内膜息肉组织中FSHR基因表达量0.0496(0.0431,0.0656),其旁正常子宫内膜组织中FSHR基因表达量0.0002(0.0001,0.0002),差异有统计学意义(P<0.05);子宫内膜息肉组织中LHR基因表达量(0.00012293±0.00004748),其旁正常子宫内膜组织中LHR基因表达量(0.00001931±0.00000380),差异有统计学意义(P<0.05);通过WB结果显示子宫内膜息肉组织中FSHR蛋白表达水平0.4093(0.3925,0.4789),其旁正常子宫内膜组织蛋白表达水平 0.2235(0.1093,0.3285),差异有统计学意义(P<0.05);子宫内膜息肉组织中LHR蛋白表达水平0.4379(0.4062,0.4503),其旁正常子宫内膜组织蛋白表达水平 0.2235(0.1093,0.3278),差异有统计学意义(P<0.05)。 结论 FSHR及LHR存在于人子宫内膜组织中,其在子宫内膜息肉组织中的表达高于其旁正常子宫内膜组织,得出子宫内膜息肉的发生不仅与雌激素受体及孕激素受体表达失调有关,与FSHR及LHR表达失衡亦有关。
[关键词] 子宫内膜息肉;卵泡刺激素受体;黄体生成素受体;实时荧光定量PCR;蛋白免疫印迹
[中图分类号] R711.74 [文献标识码] A [文章编号] 1673-9701(2019)27-0017-05
[Abstract] Objective To investigate the relationship between follic stimulating hormone receptor(FSHR), luteinizing hormone receptor(LHR) and the occurrence of endometrial polyps. Methods At the gene level and protein level, real-time quantitative polymerase chain reaction(real-time PCR) and Western blotting(WB) were used to determine the differences in the expression of FSHR and LHR between endometrial polyps and adjacent normal endometrium in the patients who received endometrial polypectomy under endoscopy in our hospital from December 2016 to November 2017.Results According to the results of real-time PCR, the gene expression quantity of FSHR in endometrial polyps was 0.0496(0.0431, 0.0656), and the gene expression quantity of FSHR in adjacent normal endometrium was 0.0002(0.0001, 0.0002). The differences were statistically significant(P<0.05); the gene expression quantity of LHR in endometrial polyps was(0.00012293±0.00004748), and the gene expression quantity of LHR in adjacent normal endometrium was(0.00001931±0.00000380). The differences were statistically significant(P<0.05); according to the WB results, the protein expression level of FSHR in endometrial polyps was 0.4093(0.3925, 0.4789), and the protein expression level in adjacent normal endometrium was 0.2235(0.1093, 0.3285). The difference was statistically significant(P<0.05); the protein expression level of LHR in endometrial polyps was 0.4379(0.4062, 0.4503), and the protein expression level in adjacent normal endometrium was 0.2235(0.1093, 0.3278). The differences were statistically significant(P<0.05). Conclusion FSHR and LHR are present in human endometrial tissues, and the expression in endometrial polyps is higher than that in adjacent normal endometrium. It is concluded that the occurrence of endometrial polyps is not only related to the expression imbalance of estrogen receptor and progesterone receptor, but also related to the imbalance of FSHR and LHR expression.
[Key words] Endometrial polyps; Follic stimulating hormone receptor(FSHR); Luteinizing hormone receptor(LHR); Real-time quantitative polymerase chain reaction(real-time PCR); Western blotting(WB)
子宫内膜息肉(Endometrial polyps,EP)为局部子宫内膜过度增生形成的赘生物,可有蒂或无蒂,是由纤维化内膜间质(含厚壁血管)以及子宫内膜腺体构成。目前研究发现EP的发生与局部激素环境紊乱、炎症、细胞增殖与凋亡失调、细胞因子及其受体紊乱以及染色体异常有关[1,2],宫腔镜为目前治疗EP的首选方案,但术后复发率高,现临床上使用雌激素抑制剂、孕激素、避孕药、小剂量米非司酮以及左炔诺孕酮宫内缓释系统[3]预防术后复发,但由于药物局限性,以及患者依从性不同目前尚无统一治疗方案。另随着辅助生殖技术开展广泛,现研究发现卵巢刺激与新发子宫内膜息肉相关,而子宫内膜息肉影响子宫内膜容受性,与妊娠成功率直接相关[4],因此研究EP发病机制可为临床治疗及预防提供一条新思路。
卵泡刺激素(Follicule stimulating hormone,FSH)和黄体生成素(Luteinizing hormone,LH)是垂体分泌的两种重要的促性腺激素,在正常表达水平下,上述两种激素通过结合卵巢组织中的FSHR 和LHR发挥其生理作用[5-7],且研究发现两者在体内多种器官中存在,在人子宫内膜组织中亦有表达。目前研究表明FSH可能参与血管生成[8],LH可能参与炎症及增加细胞侵袭性[9],与目前了解的子宫内膜息肉发生机制有相吻合之处,且有研究表明LHR在子宫内膜中有表达[10],因此本实验考虑子宫内膜息肉形成除与雌孕激素受体异常相关外,是否与促性腺激素受体异常有关,本实验通过WB及real-time PCR方法检测子宫内膜息肉组织和正常子宫内膜组织中FSHR及LHR表达差异研究子宫内膜息肉的发病机制。
1 材料与方法
1.1 材料来源
1.1.1 标本 选取2016年12月~2017年11月在我院就诊通过阴道超声提示“宫腔占位:子宫内膜息肉可能”,予行全麻下宫腔镜检查术患者30例,患者体重指数(BMI范围18.7~22.9 kg/m2),入组病例6个月内均未用过激素类药物、未放置宫内节育器或接受宫腔手术,无急慢性盆腔炎症,无多囊卵巢综合征、子宫肌瘤、子宫腺肌病、盆腔子宫内膜异位症、糖尿病、甲状腺功能异常等代谢性疾病及其他恶性疾病及严重并发症。30例患者手术时间选取经净后3~7 d,宫腔镜检查术发现均为单发子宫内膜息肉,且子宫内膜息肉最大径线小于2 cm,平均年龄为(31.55±6.77)岁(实际年龄21~45岁)。选取子宫内膜息肉组织(EP)为实验组,子宫内膜息肉旁组织(EN)为对照组,所有患者均签署知情同意书。
1.1.2 主要试剂 PCR引物(上海英骏生物技术有限公司)、TrizolRNA提取试剂(美国英骏公司)、逆转录试剂盒、SYBR Green Realtime PCR Master Mix-Plus(日本Toyobo公司)、琼脂糖(晶美生物工程有限公司)、TAQ酶(Fermentas公司)、二硫苏糖醇、丙烯酰胺、Tris碱、N,N-亚甲基丙烯酰胺(Sigma公司)、PVDF膜(美国BIO-RAD公司)、FSHR及LHR一抗(Santa Cruz公司)、HRP標记二抗(武汉博士德)。
1.2 方法
1.2.1 总RNA提取和cDNA合成 ①组织RNA提取:切取一小块-80℃保存的子宫内膜息肉及其旁正常子宫内膜样本组织,研磨震荡后,用Trizol溶解总RNA,异丙醇沉淀总RNA,75%乙醇洗涤RNA后用DEPC水溶解RNA。紫外分光光度计测定总RNA浓度。②cDNA合成:取1 μg的总RNA为模板,以Oligo(dT)引物和随机引物反转录合成cDNA第一链。反应条件:25℃ 10 min,42℃ 60 min,52℃ 15 min,70℃15 min,4℃永久。
1.2.2 实时荧光定量PCR 取上述反转录后的cDNA 1 μL,加入10 μL 25×SYBR GreenPremix配制成25 μL的反应体系。置于Step OnePlusTM qRT-PCR系统,反应条件:95℃ 90 s 预变性,95℃ 5 s、58℃ 1 min、58℃ 10 s循环68次、4℃永久。每个样本设置3个复孔,且以GAPDH作为内参,以2-△CT方法计算目的基因的相对表达水平。FSHR正向引物为5-AAAGCTGCCTACTCTGGAAAAG -3,反向引物为5-GACCCCTAGCCTGAGTCATATAA -3;LHR正向引物为5-ACTGGGACACTGAGAAGGG-3,反向引物为5-GGAAATGAGCATGACCTTTGGTG -3。
1.2.3 Western blot 常规方法提取子宫内膜息肉组织与其旁正常子宫内膜组织总蛋白进行SDS-PAGE凝胶电泳,将蛋白转移至硝酸纤维(NC)膜上,用质量分数为5%的BSA/脱脂牛奶封闭NC膜1 h,加入FSHR、LHR一抗或β-actin(抗体):V(TBS)=1:1000稀释于TBS中,4℃过夜;洗膜后加入HRP标记的二抗(1:2000稀释),室温下缓慢振荡2 h,最后用化学发光试剂盒显色、曝光,用图像分析软件对蛋白条带作灰度扫描分析,β-actin作为内参。
1.3 观察指标
1.3.1 Real-time PCR的观察指标 Real-time PCR的检测结果,CT值是在real-time PCR技术中一个非常重要的概念,C表示Cycel,T表示threshold,CT值表示每个反应管中荧光信号要达到设定的阈值所需要经历的循环数量。每个目的基因的表达量用2-ΔCT表示,ΔCT为实验的标本(EP组以及EN组)在PCR扩增过程中的平均CT值(每个标本做3个复孔)减去内参(GAPDH)的平均CT值(3个复孔),本实验将每个目的基因的表达量作为观察指标。
1.3.2 Western-blot的观察指标 用图像分析软件将WB实验获得的每个特异性条带灰度值进行数字化扫描分析,β-actin作为内参,本实验将实验组及对照组获得的灰度值与内参获得的灰度值的比值作为观察指标。
1.4统计学方法
所有数据均采用SPSS17.0软件进行统计分析。正态分布计量资料用(x±s)表示,组间比较采用独立样本t检验;非正态分布计量资料用M(P25,P75)表示, 组间比较用Mann-Whitney U 检验。P<0.05为差异有统计学意义。
2 结果
2.1 PCR实验结果
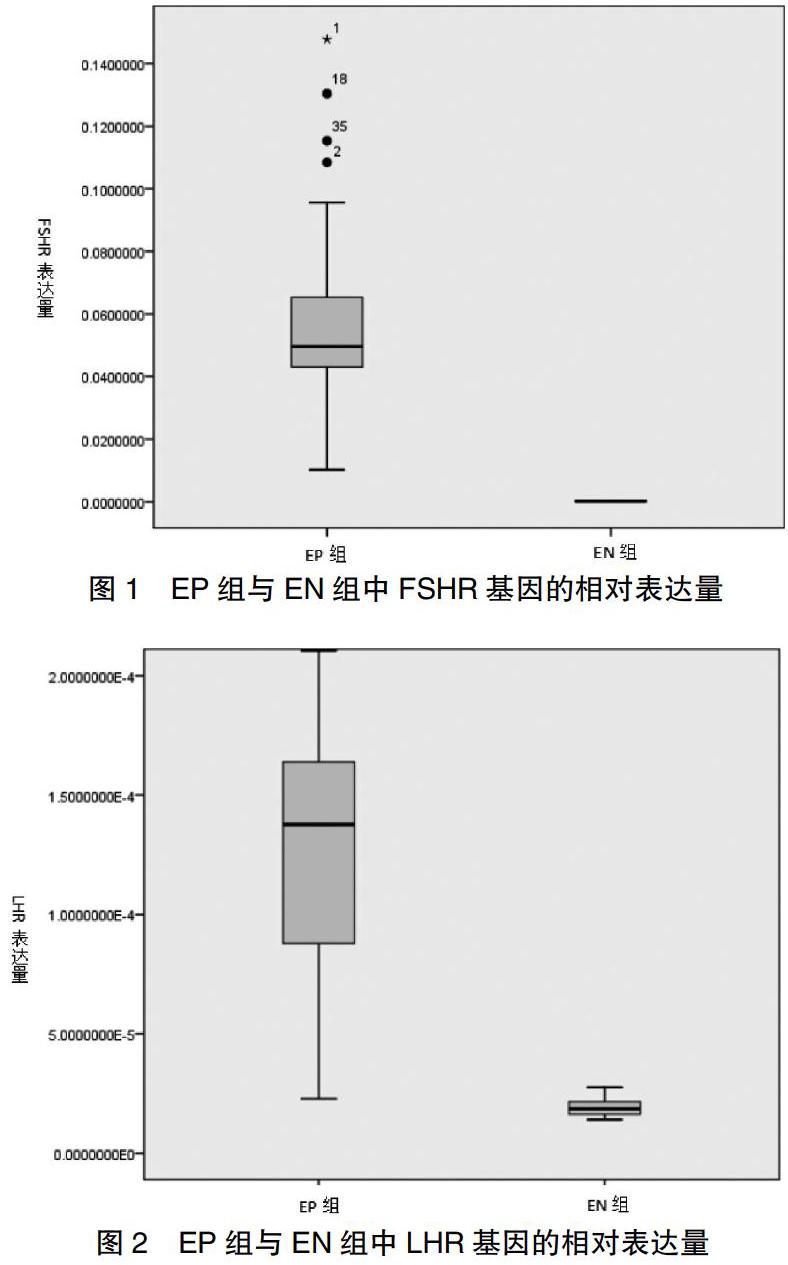
FSHR基因表达量数据不服从正态分布,用两个独立样本秩和检验,得到FSHR基因表达量在EP组及EN组中的表达差异,EP组中FSHR表达较EN组中增多,差异有统计学意义(P<0.05),见表1、图1。LHR基因表达量数据服从正态分布,用两个独立样本t检验,得到LHR基因表达量在EP组及EN组中的表达差异,EP组中LHR表达较EN组中增多,差异有统计学意义(P<0.05),见表2、图2。
2.2 Western-blot实验结果
2.2.1 在Western-blot中FSHR、LHR蛋白条带表达差异 a为子宫内膜息肉组织中FSHR蛋白条带,b为正常内膜组织中FSHR蛋白条带,c为β-actin蛋白的条带,d为子宫内膜息肉组织中LHR蛋白的条带,e为正常子宫内膜LHR蛋白的条带,f为β-actin蛋白的条带。从图片得知,在子宫内膜息肉组织中FSHR蛋白表达高于正常子宫内膜组织;在子宫内膜息肉组织中LHR蛋白表达高于正常子宫内膜组织(图3)。
2.2.2 数据分析 数据均不服从正态分布,用两个独立样本秩和检验,得到FSHR、LHR蛋白在EP组及EN组中的表达差异,EP组中FHSR、LHR的表达较EN组中增多,差异有统计学意义(P<0.05),见表3、4及图4、5。
3讨论
根据目前国内外关于子宫内膜息肉的研究,局部子宫内膜高雌激素是导致子宫内膜息肉的病因是可以下定论的,大量研究发现ER以及PR在子宫内膜息肉中呈现高表达趋势,推测子宫内膜息肉的发生可能与子宫局部激素受体表达失衡相关[11-17],根据子宫内膜息肉流行病学调查显示其发病率在围绝经期妇女达到高峰,此时期的妇女由于体内雌激素降低,FSH异常升高,用子宫内膜高雌激素理论难以解释该年龄妇女子宫内膜息肉的病因,因此推测子宫内膜息肉的发生是否与促性腺激素紊乱相关。另有学者考虑子宫内膜息肉的发生是由于子宫内膜持续受损,导致血管生成因子(VEGF)及致炎因子及其受体表达升高,促进炎细胞聚集、浸润及血管生成,导致子宫内膜炎症状态持续存在,宫腔镜下见部分EP的形成伴随着周围子宫内膜的增厚、周围充血、水肿等一系列变化,推测子宫内膜持续的炎症可能与子宫内膜息肉的发生、发展相关。Xiao Y等[12]发现在子宫内膜息肉组织较其周围正常子宫内膜组织中VEGF以及其受体的表达升高,考虑这些细胞活性因子可能在宫腔持续炎性刺激下产生,在子宫内膜息肉的形成过程中起到一定作用,促进子宫内膜组织中血管生成增加以及促进细胞生成导致子宫内膜息肉的发生。
另外Zhang Z等[13]研究发现FSH在肿瘤中通过影响VEGF、缺氧诱导因子等因子水平来促进血管生成, 从而促进肿瘤的形成与发展。Petersen SL等[18]发现不同性别人体内LH差异通过核因子-κB(nuclear factor-κB,NF-κB)通路介导, NF-κB是体内发生炎症的重要通路,吴允等[19]发现NF-κB在EP组织中较其周围内膜或正常子宫内膜中表达显著升高,考虑NF-κB介导子宫内膜持续炎症,促成EP的发生与发展。
在动物实验中,将卵巢组织进行体外培养过程中,持续将FSH作用于其中,实验结果表明其受体能持续表达,表明FSH能提高其受体表达水平,且呈现激素依赖性[20];研究发现单独在雌激素作用下FSH受体数量未见明显增减,但协助FSH共同作用下能够将每一个细胞上的FSHR数量有所提高。在雌激素与FSH共同诱导形成LHR,形成的LHR反过来又能够增强卵泡细胞上ER与雌激素结合的能力,促进雌激素的形成,由此形成特定的卵泡良性循环。有文献报道,在FSHR 和LHR表达阳性的子宫内膜癌患者体内注射GnRH类似物或拮抗剂取得了一定的疗效,因此考虑FSHR和LHR与子宫内膜癌的发生、发展存在一定的关联,但其在子宫内膜癌中的作用机制目前尚不明确,考虑可能和子宫内膜肿瘤的激素依赖性有关。考虑FSH与LH不仅通过作用于卵巢中的FSHR、LHR来引起雌孕激素紊乱,引起子宫内膜息肉的发生,还可能通过局部作用来调节子宫内膜的生理功能,引起子宫内膜增生与脱落失衡,参与了子宫内膜息肉的发生、发展。本研究结果显示FSHR、LHR存在于子宫内膜息肉组织及其旁正常子宫内膜组织中,且在子宫内膜息肉组织中呈高表达,综合上述观点,FSHR、LHR的表达异常可能与子宫内膜息肉的发生相关,根据FSHR、LHR的相关特性推测其可能通过局部炎症、血管增生、局部激素受体紊乱方面促进子宫内膜息肉的发生、发展,今后需做相关细胞功能试验进行进一步验证。
[参考文献]
[1] Kosei N,Zakharenko N,Herman D.Endometrial Polyps in women of reproductive age:Clinical and pathogenetic variations[J].Georgian Med News,2017,12(273):16-22.
[2] 李陽,顾江红.子宫内膜息肉的诊断和治疗研究进展[J].浙江临床医学杂志,2017,19(9):1758-1760.
[3] Chowdary DP,MaherPP,Ma DT,et al. The role of the Mirena Intrauterine Device(LNG-IUD)in the management of endometrial polyps-a Pilot Study[J]. J Minim Invasive Gynecol,2018,12(24):31429-31448.
[4] 王利群,李萌,卢美松.控制性超促排卵中新发子宫内膜息肉的研究进展[J].中国计划生育和妇产科,2017,9(8):5-8.
[5] Liu H,Xu X,Han T,et al. A novel homozygous mutation in the FSHR gene is causative for primary ovarian insufficiency[J].Fertil Steril,2017,108(6):1050-1055.
[6] Szymańska, Kamila,Ka?覥afut Joanna,et al.FSHR Trans-Activation and Oligomerization[J]. Front Endocrinol(Lausanne),2018,13(9):760.
[7] Patel R,Shah G. Evaluation of ovarian and metabolic effects of GnRH modulators in two rat models of polycystic ovary syndrome[J]. Mol Reprod Dev,2018,85(10):778-789.
[8] Trevisan,Camila,Martins,et al. Effects of a Polymorphism in the Promoter Region of the Follicle-Stimulating Hormone Subunit Beta(FSHB)Gene on Female Reproductive Outcomes[J]. Genet Test Mol Biomarkers,2019,23(1):39-44.
[9] 徐春琳,路晓琳,闫晓楠,等. PI3K/Akt/NF-κB信号通路在FSH促进卵巢癌细胞增殖与侵袭中的作用[J].中华妇产科杂志,2012,47(2):529-531.
[10] Sacchi S,Sena P,Degli Esposti C,et al.Evidence for expression and functionality of FSH and LH/hCG receptors in human endometrium[J]. J Assist Reprod Genet,2018, 35(9):1703-1712.
[11] Snezana A,Jelena D,Kasapovic,et al.Antioxidant enzymes in women with endometrial polyps:relation with sex hormones[J].European Journal of Obstetrics & Gynecology and Reproductive Biology,2013,170(31):241-246.
[12] Xiao Y,Peng X,Ma N,et al.The expression of cyclooxygenase-2 and vascular endothelial growth factor in the endometrium during the peri-implantation period in women with and without polyps[J].Hum Fetil,2014,17(1):67-71.
[13] Zhang Z,Wang Q,Ma J,et al.Reactive oxygen species regulate FSH-induced expression of vascular endothelial growth factor via Nrf2 and HIF1α signaling in human epithelial ovarian cancer[J].Oncology Reports,2013,29(4):1429-1434.
[14] Wei S,Lai L,Yang J,et al. Expression Levels of Follicle-Stimulating Hormone Receptor and Implication in Diagnostic and Therapeutic Strategy of Ovarian Cancer[J]. Oncol Res Treat,2018,41(10):651-654.
[15] Ghinea N. Vascular Endothelial FSH Receptor,a Target of Interest for Cancer Therapyp[J]. Endocrinology,2018, 159(9):3268-3274.
[16] Pawlikowski Lód■m M.Expression of follicle stimulating hormone receptors in intra-tumoral vasculature and in tumoral cells-the involvement in tumour progression and the perspectives of application in cancer diagnosis and therapy[J]. Endokrynol Pol,2018,69(2):192-198.
[17] Wei Suocheng,ShenXiaoyun,Lai Luju,et al. FSH receptor binding inhibitor impacts K-Ras and c-Myc of ovarian cancer and signal pathway[J]. Oncotarget,2018,9(32):22498-22508.
[18] Petersen SL,Krishnan S,Aggison LK,et al.Sexual differentiation of the gonadotropin surge release mechanism:a new role for the canonical NfκB signaling pathway[J].Front Neuroendocrinol,2012,33(1):36-44.
[19] 吳允,王宝金,申爱荣,等.NF-κB及MIF在育龄期妇女子宫内膜息肉中的表达[J].中国妇幼保健,2013,28(3):1001-1009.
[20] 沈亚,陈丽,谭小方,等.卵泡刺激素受体基因多态性与卵巢过度刺激综合征的相关性[J].实用医学杂志,2016, 32(12):1994-1996.
(收稿日期:2019-01-30)
