阿帕替尼联合TACE治疗中晚期肝癌患者临床分析
2019-12-11沈锐潮熊共鹏
沈锐潮 卢 浩 熊共鹏
北京中医药大学厦门医院,福建省厦门市 361009
肝癌为常见恶性肿瘤,病情隐匿,早期无特异性症状,多数患者确诊时已至中晚期,具有较高病死率[1]。肝动脉化疗栓塞术(TACE)为治疗中晚期肝癌常用姑息疗法,但单纯TACE治疗难以将肿瘤病灶完全根除,加之肝血窦丰富,复发、转移率较高[2]。阿帕替尼为血管内皮生长因子受体-2(VEGFR-2)抑制剂,具有高选择性,可对血管内皮细胞增殖、迁移进行阻断,抑制肿瘤生长[3]。本文选取我院中晚期肝癌患者89例,探究阿帕替尼联合TACE的治疗效果,现报道如下。
1 资料与方法
1.1 一般资料 经我院伦理委员会同意批准,选取2017年11月—2018年11月中晚期肝癌患者89例,根据治疗方案不同分为对照组(n=51)与观察组(n=38)。对照组女20例,男31例,年龄43~76岁,平均年龄(58.47±7.26)岁,Child-pugh分级:A级30例,B级21例,巴塞罗那肝癌分期(BCLC):B期42例,C期9例;观察组女15例,男23例,年龄42~78岁,平均年龄(59.13±7.49)岁,Child-pugh分级:A级22例,B级16例,BCLC:B期33例,C期5例。两组基线资料均衡可比(P>0.05)。
1.2 纳入与排除标准 (1)纳入标准:符合诊断标准[4];Child-pugh分级为A级、B级;BCLC分期为B期、C期;患者及家属知情并签署承诺书。(2)排除标准:凝血功能障碍;化疗禁忌证;大量腹腔积液;伴远处转移。
1.3 方法
1.3.1 对照组:给予TACE治疗。股动脉穿刺插管,造影,对肿瘤位置、供血动脉走行等进行明确,微导管(2.7F)超选至病灶供血血管,注入奥沙利铂100mg+表柔比星20mg+碘油5~20ml混合乳化剂,并以PVA明胶海绵栓塞颗粒对供血动脉进行栓塞,至供血动脉血流停滞。术后给予止吐、保肝等治疗。
1.3.2 观察组:于对照组基础上加用阿帕替尼(江苏恒瑞医药股份有限公司,国药准字H20140103),起始剂量500mg/d,口服,若患者可耐受,则维持原剂量;若发生明显不良反应,减量至250mg/d,不良反应减轻后逐渐恢复原剂量。停药时间≤30d,下1个周期TACE前4d停药,术后4d继续服用。1个月为1个疗程,两组均持续治疗3个疗程。
1.4 观察指标 (1)对比两组疗效。(2)对比两组治疗前后T淋巴细胞亚群水平。(3)对比两组不良反应情况。(4)对比两组治疗前后血清血管内皮生长因子(VEGF)及凋亡相关因子P53、Caspase-8水平。空腹抽取静脉血3ml,离心,取血清,VEGF以酶联免疫吸附法检测,P53、Caspase-8以流式细胞仪检测。
1.5 疗效标准 靶病灶动脉期增强均消失为完全缓解;靶病灶长径总和缩小≥30%为部分缓解;出现新病灶或靶病灶长径总和增加≥20%为进展;稳定介于部分缓解、进展之间。将完全缓解、部分缓解计入客观缓解。
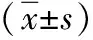
2 结果
2.1 疗效 与对照组相比,观察组客观缓解率较高(P<0.05)。见表1。

表1 两组疗效对比[n(%)]
注:两组客观缓解率比较,χ2=5.851,P=0.016。
2.2 T淋巴细胞亚群 治疗前两组CD3+、CD4+、CD4+/CD8+比较差异无统计学意义(P>0.05);治疗后观察组CD3+、CD4+、CD4+/CD8+较对照组高(P<0.05)。见表2。
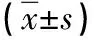
表2 两组T淋巴细胞亚群水平对比
注:与同组治疗前相比,aP<0.05。
2.3 不良反应 两组栓塞综合征(发热、腹痛、恶心呕吐)发生率的差异无统计学意义(P>0.05);观察组手足综合征、高血压、蛋白尿、腹泻发生率较对照组高(P<0.05)。观察组3例出现重度手足综合征,停药并对症处理,2周后恢复用药;2例出现严重蛋白尿,停药2周后恢复用药。见表3。两组其余患者不良反应经对症处理后均缓解。

表3 两组不良反应发生率对比[n(%)]
2.4 VEGF、P53、Caspase-8 治疗前两组血清VEGF、P53、Caspase-8水平的差异无统计学意义(P>0.05);治疗后观察组血清VEGF水平较对照组低,血清P53、Caspase-8水平较对照组高(P<0.05)。见表4。
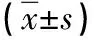
表4 两组血清VEGF、P53、Caspase-8水平对比
注:与同组治疗前相比,aP<0.05。
3 讨论
肝癌为最常见恶性肿瘤之一,发病、病死率均较高,据统计,全球癌症相关死亡原因中,原发性肝癌居于第2位[5]。肝癌发生、转移与新生血管形成具有密切关系,其中VEGF为最重要血管生成因子。TACE为治疗中晚期肝癌的首选姑息疗法,通过阻塞肝癌供血血管,阻断肝癌细胞供血,使其缺血、坏死,但TACE无法将肿瘤细胞彻底杀灭,且刺激残存肿瘤组织的VEGF表达,其转移、侵袭性更强,进而促使肿瘤血管重生。VEGFR-2与肝癌发生密切相关。阿帕替尼为VEGFR-2抑制剂,可抑制VEGFR-2与ATP结合,进而对VEGF介导的内皮细胞增殖、迁移起到抑制作用,发挥抗肿瘤作用[6]。故阿帕替尼、TACE联用,可起到协同作用,弥补TACE的不足,改善预后。陆阳等[7]研究显示,阿帕替尼联合TACE治疗中晚期肝细胞癌,肿瘤客观缓解率为68.2%,患者中位生存时间15个月,显著优于单纯TACE治疗。本文结果显示,观察组客观缓解率高于对照组,治疗后观察组CD3+、CD4+、CD4+/CD8+高于对照组(P<0.05)。表明阿帕替尼联合TACE治疗中晚期肝癌患者,可提高治疗效果,纠正机体免疫功能紊乱。
阿帕替尼相关不良反应为剂量依赖性,本文中,两组栓塞综合征(发热、腹痛、恶心呕吐)发生率的差异无统计学意义(P>0.05);观察组手足综合征、高血压、蛋白尿、腹泻发生率较对照组高(P<0.05),观察组3例出现重度手足综合征,停药并对症处理,2周后恢复用药;2例出现严重蛋白尿,停药2周后恢复用药;其余患者不良反应经对症处理后均缓解。提示阿帕替尼联合TACE治疗中晚期肝癌,安全性高。
有研究显示,VEGF及凋亡相关因子Caspase-8、P53的表达与肝癌发生、发展具有密切关系,且对疗效、预后评估具有重要意义[8]。Caspase-8、P53可继发级联反应,在HepG2肝癌细胞凋亡中发挥重要作用。阿帕替尼应用于肝癌患者,可作用于HepG2细胞,使Caspase-8、P53表达上调,进而对HepG2细胞迁移、生长起到抑制作用。本文结果显示,治疗后观察组血清VEGF水平较对照组低,血清P53、Caspase-8水平较对照组高(P<0.05)。表明阿帕替尼联合TACE治疗中晚期肝癌患者,可调节VEGF、P53、Caspase-8表达,改善预后。
综上可知,阿帕替尼联合TACE治疗中晚期肝癌患者,可调节VEGF、P53、Caspase-8表达,改善免疫功能,疗效显著,且安全性高。
