改良法体外分离培养炎症来源的人牙周膜干细胞
2019-12-11陈青宇赵晓霞高俊武王靖宇
刘 焱 陈青宇, 赵晓霞 高 翔 高俊武 王靖宇
1 内蒙古自治区包头医学院口腔学院,内蒙古包头市 014060; 2 内蒙古自治区包头医学院第一附属医院;3 内蒙古自治区呼和浩特市第一医院
牙周炎发病率高,是成人失牙最主要的原因。能否有效控制感染并争取病损部位最大限度地组织再生和重建是控制牙周炎病程进展的重要评价指标。随着组织工程材料和技术的日新月异及生物信号分子研究的快速进步,牙周组织再生进入了蓬勃发展的时代[1]。存在于牙周韧带组织的人牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)增殖能力旺盛且具有多向分化潜能,经诱导可形成牙骨质/牙周膜样结构[2]。hPDLSCs被认为是牙周组织工程中最理想的种子细胞,已成为牙周组织的再生、种植体周围缺损的修复以及正畸牙齿微环境改建过程中重要的细胞学基础[3]。hPDLSCs主要来源于健康的乳牙及年轻恒牙,然而成年人中约80%罹患慢性牙周炎,其中20%为重度牙周炎。对于这些患者,能否从炎症状态下的牙周韧带中成功分离得到自体健康的hPDLSCs;长期慢性炎症对hPDLSCs的细胞表型、增殖能力及干细胞生物学特性有无改变[4-6]都影响着i-hPDLSCs的临床应用。常规方法分离和纯化i-hPDLSCs的成功率较低。本实验采用改良酶消化组织块盖玻片培养法结合有限稀释克隆法分离和筛选i-hPDLSCs,获得单细胞克隆i-hPDLSCs,并在扩增后鉴定其生物学特性,以期为组织工程牙周再生治疗的种子细胞的筛选与培养提供理论基础和实验依据。
1 材料与方法
1.1 材料和仪器 30~45岁慢性牙周炎患者因重度牙周炎需拔除的患牙,由包头医学院第一附属医院口腔科提供;DMEM培养基、胎牛血清(Gibco,美国);青、链霉素(华北制药);Ⅰ型胶原酶(Sigma,美国)、0.25%胰蛋白酶-EDTA(Hyclon,美国);小鼠抗人角蛋白、小鼠抗人波形丝蛋白、小鼠抗人STRO-1单克隆抗体(Dako,美国)、羊抗小鼠IgG-FITC荧光二抗、羊抗小鼠IgG-TRITC荧光二抗(Sigma,美国)、荧光染料Hoechst33258(Sigma,美国);四甲基偶氮唑盐(MTT,Sigma,美国)、二甲基亚砜(DMSO,Amresco,美国)。倒置相差显微镜及照相系统(Olympas,日本);荧光显微镜(BX61+DP-71,Olympus,日本);酶联免疫监测仪(SpectraMax M2,Molecular Devices,美国)。
1.2 改良法分离培养i-hPDLSCs
1.2.1 标本纳入标准:30~45岁慢性牙周炎患者因严重的牙周炎需要拔除的患牙,无明显龋坏、牙髓和根尖周病变,无黏膜疾患,且所有纳入个体均无全身系统性疾病。严重慢性牙周炎的诊断标准(需拔牙的指征):X线片显示牙槽骨吸收达根长的2/3,牙齿Ⅲ度松动。患者知情同意,签署知情同意书。
1.2.2 通过酶消化组织块盖玻片法培养获得人牙周膜细胞:75%乙醇消毒牙齿周围组织,牙拔除后2h内取材。在超净台内以PBS冲洗牙根3~5次,刮除根中1/3部位的牙周韧带组织,剪碎成1mm3大小,用3mg/ml的Ⅰ型胶原酶37℃下振荡消化1h,离心吹匀后移入6孔板中。轻柔地覆盖上盖玻片,保持盖玻片和组织块之间有培养基充盈,补加2ml培养基,每3d换液。细胞融合达到80%时传代。
1.2.3 有限稀释法克隆化分离纯化i-hPDLSCs:将P1代对数生长期的牙周韧带细胞调整密度至10~15个细胞/ml,每孔100μl接种于96孔板。培养8~12h后,观察选取并标记单个细胞孔。每个孔中加入200μl含有10%FBS的DMEM培养基,隔天换液。待标记孔的细胞增殖达到孔底面积1/3~1/2 时,消化传代,取P4代细胞用于后续实验。
1.3 i-hPDLSCs的生物学性状鉴定
1.3.1 细胞来源鉴定:取P4代i-hPDLSCs制备细胞载玻片,通过免疫荧光染色鉴定角蛋白和波形丝蛋白。其中一抗为小鼠抗人角蛋白(PCK)和小鼠抗人波形丝蛋白(vimitin)。PBS漂洗细胞爬片,多聚甲醛固定,牛血清白蛋白封闭,加入一抗后于湿盒中过夜。次日,避光条件下加入山羊抗小鼠IgG-TRITC荧光二抗继续孵育1h,用Hoechst33258对细胞核复染,甘油封片,在荧光显微镜下观察。
1.3.2 早期间充质干细胞标志物(STRO-1)的免疫荧光检测:特异性一抗是小鼠抗人STRO-1单克隆抗体,二抗是山羊抗小鼠IgG-FITC荧光二抗,荧光染料Hoechst33258用于细胞核染色。具体方法同1.3.1。
1.4 克隆形成实验 将i-hPDLSCs调整密度为103个细胞/皿接种于直径为90mm的培养皿。十字方向轻摇、混匀细胞,连续培养14d后,通过倒置相差显微镜观察和计数超过50个细胞的克隆数,计算克隆形成率(Colony forming unit-fibroblastic,CFU-F)。克隆形成率(%)= 克隆数/接种细胞数×100%。
1.5 细胞增殖能力 取生长良好的P4代i-hPDLSCs,将密度调整为2×104/cm2,每孔100μl接种于96孔板中,分别培养1、3、5、7、9d,每组设3个重复孔。培养完成后,每孔加入20μl MTT溶液培养4h后,弃上清、向每孔加150μl DMSO,振荡10~15min。通过酶联免疫吸附测定490nm的波长下每孔OD值,以时间作为横坐标,OD值为纵坐标绘制生长曲线。
1.6 流式细胞仪分析细胞周期 取P4代i-hPDLSCs消化、计数并收集约3×106个吹散制成单细胞悬液,离心后加入70%乙醇吹打混匀,4℃过夜。离心弃去乙醇,避光加入50μg/ml的碘化丙锭1ml,4℃下染色30min,通过200目尼龙筛网,测定细胞周期。
2 结果
2.1 倒置相差显微镜观察i-hPDLSCs的形态 培养7~14d,可见长梭或多边形的成纤维细胞样细胞出现,贴壁生长,较分散(图1A)。21d后,细胞数量增多并逐渐融合,形态均一,呈长梭形,长满孔底面积60%~70%(图1B)。传代后,细胞形态与原代相同,细胞胞体丰满,胞浆均匀,束状排布(图1C)。
2.2 i-hPDLSCs的生物学性状的检测 i-hPDLSCs经免疫荧光染色检测显示:vimitin阳性表达,细胞浆呈红染,胞核呈蓝染(图2A);PCK阴性表达,胞浆未染色,仅见细胞核呈蓝染(图2B)。可知所培养细胞为间充质来源,未有上皮细胞污染。STRO-1阳性表达,细胞质和胞核都呈绿染,同时胞核也被Hoechest33258复染,故呈蓝绿色(图2C)。
2.3 克隆形成情况 将103个细胞接种在90mm培养皿中,次日观察到单个长梭形的细胞贴壁(图3A)。培养10d后出现细胞克隆,为30~50个细胞形成的较小的克隆,细胞排列中央紧密、周围松散;集落间细胞相距较远(图3B)。继续培养至第14天时,克隆状生长的细胞集落变多且细胞量明显增多,中央区域的细胞紧密接触且边界不清,呈放射状或旋涡状分布;外周区域细胞形态为长梭形或多边形,排列较紧密(图3C)。克隆形成率为31.87%,克隆形成能力较强。

图1 倒置显微镜下观察i-hPDLSCs

图2 免疫荧光染色鉴定i-hPDLSCs的生物学性状
2.4 细胞增殖情况 i-hPDLSCs的生长曲线呈“S”型:第1、2天时,OD值较小;细胞生长速度在第3天开始显著增快,随着培养时间的延长细胞数量和活性都逐渐增加;第7天时,OD值达峰值;在第9天,细胞增殖趋于平缓、进入平台期(图 4)。

图3 倒置显微镜下观察有限稀释克隆法分离纯化的i-hPDLSCs
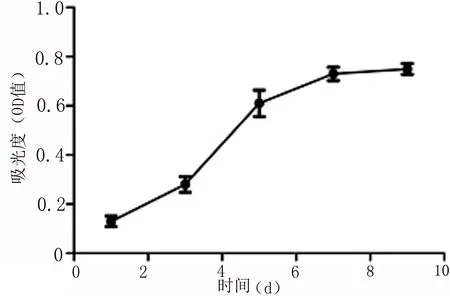
图4 MTT法分析i-hPDLSCs的增殖情况
2.5 流式细胞仪分析细胞周期 大多数细胞处于G0/G1期(87.89%),即静止期和DNA合成前期;G2期细胞占比为2.08%,S期细胞占比为10.03%。上述结果表明炎症来源的i-hPDLSCs具有慢周期性的特点(图5)。

图5 i-hPDLSCs的细胞周期检测结果
3 讨论
牙周炎症不可逆地侵袭和破坏牙周组织,引起附着丧失,最终导致牙齿松动、脱落。其治疗的目的不仅是控制炎症,更重要的是促进已受损牙周组织的再生、形成新附着,从而保存牙齿和恢复咀嚼。在再生医学中,组织工程理论和技术的广泛应用为牙周组织的修复和重建提供了新的思路。
hPDLSCs是从牙周韧带分离出的间充质干细胞,具有高增殖能力和多重分化潜能。然而牙周韧带中存在的干细胞数量较少且来源局限,自体获取困难,尚难以满足临床应用的需要。许多严重的慢性牙周炎患者,由于治疗效果差、预后不良,患牙不得不拔除。这些炎症来源的患牙是否可以分离出可供临床应用的i-hPDLSCs?如何使其体外培养、分离纯化的成功率更高?干细胞的特征和多重分化潜能是否会发生变化?这些问题的答案对于牙周组织再生的研究至关重要。
Park JC等[7]和谈珺等[8]分别从炎症的牙周膜及牙槽窝炎性肉芽组织中分离出了干细胞,并证实其具有高增殖和克隆形成能力以及成骨和成脂分化能力。通过构建大鼠实验性牙周炎的模型,Ohta S等[9]发现大鼠的牙周缺损部位可被由牙周韧带残余迁移而来的干细胞修复,并验证了这些炎症来源的干细胞具有成骨和成牙周膜的作用。牙周炎症发生的区域是组织修复和破坏共存并互相转化的复合环境,干细胞的培养、分离及纯化方式尚无统一标准。用于hPDLSCs的传统体外培养方法包括酶消化和组织块法,但两者都存在一些缺点。酶消化获得的hPDLSCs具有间充质干细胞的特征,但细胞数量少;低贴壁率又限制着组织块培养方法的成功率。一些研究结合组织块法和酶消化法用于培养hPDLSCs,虽然成功率有所提高,但组织块贴壁率低的问题尚未得到有效解决[10-11]。本实验在此基础上改良方法,用盖玻片覆盖酶消化的组织块,结果证实组织块不易游走、浮出,细胞贴壁率明显提高。同时,本实验采用有限稀释克隆法分离纯化得到的i-hPDLSCs,为单纯的间充质细胞样的梭形结构(经验证vimitin阳性表达,PCK阴性表达),显著减少了上皮细胞混杂的情况。
目前尚无明确的研究结论给出一种或几种特殊的hPDLSC标志物。2004年,Seo等最早成功分离获得hPDLSCs,并使用早期间充质干细胞的标志物STRO-1[12]、CD146/MICU8作为PDLSCs的标志物。本实验通过免疫荧光染色证实了i-hPDLSCs的STRO-1呈阳性表达。克隆形成能力反映了干细胞的自我更新能力,本实验中,i-hPDLSCs经有限稀释克隆法培养至第14天可见大量克隆状生长的细胞集落,克隆形成率为31.87%,这表明在非常低密度的培养条件下,i-hPDLSCs也可表现出较强的自我复制能力。i-hPDLSCs的生长曲线呈“S”型,随着培养时间延长至3~7d,细胞生长速度增快,细胞数和细胞活性也随之逐渐增加。细胞周期是衡量增殖动力学的重要指标,本研究细胞周期检测结果显示,炎症来源的i-hPDLSCs在G0/G1期居多,符合干细胞慢周期性的规律。
通过改良的酶消化组织块盖玻片培养法结合有限稀释克隆,可以从慢性牙周炎患者离体牙的牙周韧带中分离纯化得到i-hPDLSCs,且该细胞具有强克隆形成能力和高增殖能力、具备成体干细胞所具有的细胞周期及表型。本实验为研究i-hPDLSCs的临床应用奠定了基础,也充实和丰富了牙周组织工程种子细胞的培养和筛选方法。
