番茄根际多功能益生芽孢杆菌的筛选与鉴定
2019-12-11张翠绵贾楠马佳彭杰丽李书鸿胡栋魏晓燕王春燕王占武
张翠绵,贾楠,马佳,彭杰丽,李书鸿,胡栋,魏晓燕,王春燕,王占武*
(1.河北省农林科学院遗传生理研究所,河北省植物转基因中心重点实验室,河北 石家庄 050051;2.河北三农农用化工有限公司,河北 石家庄 050051)
随着农业产业结构的调整,蔬菜产业正朝着专业化、集约化方向发展。然而,连年种植导致蔬菜连作障碍问题日渐突出,尤其是在设施栽培中,蔬菜复种指数高,农药和化肥的使用频率和投入量增加现象普遍,加速了连作障碍的产生。连作障碍主要包括土壤次生盐渍化、病原菌增多、根际毒素积累等,这些问题往往同时存在,交互影响[1~3],因此采用单一防治方法效果往往不理想。
目前,国内外针对连作障碍的研究虽然较多[4~7],但由于其发生原因复杂和地域的差异,因此,截至目前仍然尚未发现防控效果稳定的方法。根际微生物是修复退化土壤最活跃的组分,但应用仅具有促生、防病或抗逆等1~2种功能的菌株进行修复效果较差且不稳定,因此,亟需筛选具有改善根际营养环境、拮抗病原菌、促进植物生长和提高植株抗性等多种功能的菌株。
芽孢杆菌(Bacillus spp.)广泛存在于植物根际土壤,有些菌株能够产生拮抗物质、促生物质,具有繁殖快、生长能力强、可产生休眠体、易产业化等特点[8,9],是微生物肥料等产品开发的重要微生物类群。以从番茄根际、根表筛选出有促生和抑菌效应的芽孢杆菌为目标,采用根际养分利用、促生、抗病等层级筛选方法,初步筛选同时具有上述功能的芽孢杆菌菌株,并通过盆栽番茄试验对优势菌株的促生效果进行评价,不仅可为克服番茄连作障碍植物根际促生菌(PGPR)接种剂的研制提供良好的菌种资源,还可为进一步探索PGPR对蔬菜的促长机制提供参考。
1 材料与方法
1.1 试验材料
1.1.1 根际土壤 从河北省农林科学院经济作物研究所蔬菜大棚以及石家庄市藁城区和无极县的番茄基地(常年连作),挖出整株带土的健康番茄幼苗,将根部土壤抖落后装入无菌纸袋,带回实验室备用。
1.1.2 培养基 菌株分离采用牛肉膏蛋白胨培养基(NA)[10];植物病原真菌的培养和对峙试验采用马铃薯葡萄糖培养基(PDA)[11];解(溶)磷功能的测定采用无机、有机磷培养基[12,13];菌株固氮能力的测定采用Ashby液体培养基[14];产铁载体能力的定性检测采用CAS培养基[15];产吲哚乙酸(IAA) 功能的定性检测采用IAA培养基[16]。菌种鉴定用培养基参照宋大新等[17]的方法配制。
1.1.3 番茄 供试番茄品种为冀番135,由河北省农林科学院经济作物研究所提供。
1.1.4 病原真菌指示菌 供试病原真菌指示菌有番茄灰霉菌(Botrytis cinerea)、茄子早疫病菌(Alternaria solan)i、番茄丝核菌 (Rhizoctonia solan)i、棉花枯萎病菌(Fusarium oxysporum)、辣椒腐霉菌(Pythium aphanidermatum) 和黄瓜镰刀菌 (Fusarium moniliforme),均由河北省农林科学院遗传生理研究所微生物室保存。
1.1.5 盆栽基质 盆栽试验土壤采自大田,用孔径为5 mm的筛子过筛后与蛭石按照体积比2∶1混合均匀,装入直径25 cm、高17 cm的塑料盆中备用,装入量约 2.0 kg/盆。
1.2 试验方法
1.2.1 番茄幼苗根际菌种的分离与纯化 将番茄幼苗根际土用无菌刷轻轻刷下,连同已用无菌水充分消毒的幼苗根一起放入无菌水中充分振摇,系列稀释,涂布于牛肉膏蛋白胨平板上。在30℃下培养2 d,选取产芽孢的菌落,纯化后得到斜面菌株,保存于4℃冰箱。
1.2.2 优势菌株的筛选 对经分离、纯化后得到的产芽孢细菌,进行解(溶)磷、固氮、产铁载体、产IAA能力的定性检测,据此筛选出综合能力较强的优势菌株。
1.2.2.1 解(溶) 磷能力的确定。将待测菌株点植于有机磷培养基及无机磷培养基中,点植数量6个/皿,3次重复,在30℃下培养48 h。测定溶磷圈直径(HD) 和菌落直径(CD)。根据各菌株的HD/CD,确定其溶磷能力的强弱。
1.2.2.2 固氮能力的确定。将待测菌株接入Ashby液体培养基中,在30℃、120 rpm条件下摇床培养3 d。然后,将能在Ashbg液体培养基中生长的菌株再次转接到Ashby液体培养基中,重复3次,选出最终生长的细菌即为有固氮能力的细菌。测定波长620 nm处的吸光度值(OD)。根据各菌株的OD620,确定其固氮能力的强弱。
1.2.2.3 产铁载体能力的确定。将待测菌株点植于CAS检测平板上,30℃恒温倒置培养,点植数量6个/皿,3次重复,在30℃下培养48 h。观测经过培养的CAS检测平板,分泌铁载体的细菌菌落周围会出现明显的橙色铁载体晕圈。通过比较平板上橙色透明圈的大小,来确定各菌株产铁载体能力的强弱。
1.2.2.4 产IAA能力的确定。试验样品为待测菌株发酵液;对照样品有3个,分别为含有100 mg/L色氨酸的KingB空白培养基、50 mg/L IAA溶液、含有50 mg/L IAA的KingB培养基。吸取0.5 mL待测样品于1.5 mL离心管中,加入等体积的Salkouski试剂,置于暗处反应15 min。根据测试样品溶液显色的深浅,判断其产IAA能力的强弱。
1.2.3 最优菌株抑菌能力的确定 以番茄灰霉病菌、茄子早疫病菌、番茄丝核病菌、棉花枯萎病菌、黄瓜镰刀菌、辣椒腐霉6种病原真菌为靶标,采用改良平板对峙法[11],对筛选出的优势菌株进行抑菌效果测定,以筛选出更优的菌株。将直径5 mm的指示病原真菌菌饼接于PDA平板中央,与之相距3 cm两侧接活化的待测菌株,每处理3次重复,以只接种病原真菌的培养基为对照,在30℃下培养3~5 d。待对照病原真菌长满平板时,测定菌株与各指示菌间拮抗带的宽度。
1.2.4 最优菌株促长效果的确定 将筛选出的最优菌株转接至NA无菌液体培养基中,在30℃下振荡培养48 h,4 000 rpm离心10 min,去除上清液,无菌水重悬菌体备用。
挑选饱满整齐一致的番茄种子,用温汤法灭菌,催芽后播种于56孔育苗钵(育苗基质由蛭石和草炭按体积比1∶2混合而成)中,温室培育,待番茄幼苗长至3叶1心时移栽定植。
选择长势基本一致的健壮番茄苗定植于塑料盆中,待定植苗生长5 d后,采用灌根法接种优势菌株,菌液浓度设稀释100倍 (G81-100)、稀释 200倍(G81-200) 和稀释300倍(G81-300) 3个处理,以无菌水灌根为对照(CK)。每处理10盆,等量(50mL)灌根后于温室中培育。
1.3 测定项目与方法
1.3.1 菌株特征 参照《微生物实验技术教程》[17]对菌株的形态和生理生化特征进行鉴定。
1.3.2 菌株分子学鉴定 将优势菌株用NA液体培养液培养至对数生长期,离心收集菌体。细菌总DNA提取采用SDS-CTAB法。用27F(AGAGTTTGATC CTGGCTCAG) 和 1492R (GGTTACCTTGTTACGACTT)为引物PCR扩增菌株的16S rDNA基因序列。PCR反应条件:94℃预变性5 min,94℃变性40 s,56℃退火40 s,72℃延伸90 s,30个循环;72℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测后送上海英潍捷基贸易有限公司测序,将测得的16SrDNA序列在NCBI核酸数据库上采用Blast程序进行同源性比较分析。
1.3.3 番茄生物学特征 待番茄幼苗长至4叶1心时,测定量试验组和对照组番茄植株的株高、鲜重、叶面积、主根长、毛细根数量。然后,于烘箱中105℃杀青15 min,75℃烘干至恒重,称量地上部干重和根系干重。
1.3.4 番茄叶片叶绿素含量 待番茄幼苗长至4叶1心时,每盆均选取顶部第2片叶子,采用浸提法[18]测定叶片的叶绿素含量。
1.4 数据处理
应用SPSS 13.0统计分析软件进行数据的差异显著性分析。
2 结果与分析
2.1 番茄幼苗根际细菌的分离
采用平板稀释法,经分离、纯化后共得到产芽孢细菌11株。进行解磷、固氮、产铁载体、产IAA能力的定性检测后,筛选出优势菌3株,编号为G81、G92和G99(表1)。
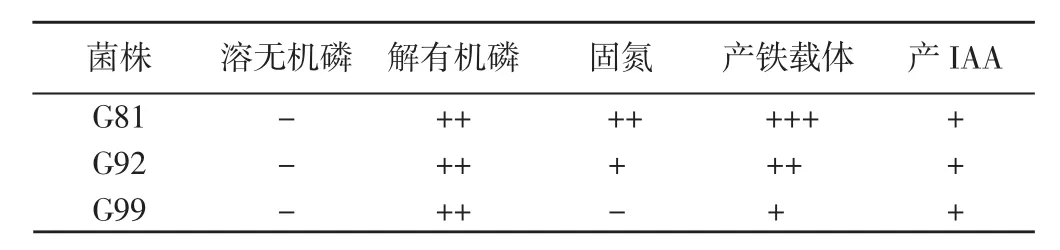
表1 优势菌株功能检测结果Table 1 Functional test results of dominant strains
2.2 优势菌株抑菌能力的比较
采用对峙试验对3株优势菌株的抑菌能力进行鉴定。结果(表2) 显示,G81、G92和G99菌株对供试的6种病原真菌都具有明显的抑制作用,抑菌带宽度为5.9~9.3 mm,其中G81菌株的整体抑菌效果最佳。G81菌株对茄子早疫病菌的抑制作用最强,抑菌带宽为9.3 mm,指标值>其他2个菌株,且与G99菌株差异达到了显著水平;对番茄灰霉病菌的抑制作用次之,抑菌带宽为8.6 mm,指标值与其他2个菌株差异不显著;对辣椒腐霉的抑制作用也较强,抑菌带宽为8.1 mm,指标值显著>其他2个菌株;对番茄丝核病菌、棉花枯萎病菌和黄瓜镰刀菌的抑菌带宽均为7.0 mm左右,除对番茄丝核病菌的抑菌带宽与G92菌株差异不显著外,其他指标值均显著>其他2个菌株。综上分析,筛选出G81为最优菌株。

表2 优势菌株对病原真菌的抑菌带宽Table 2 Antimicrobial bandwidth of dominant strains to pathogenic bacteria (mm)
2.3 最优菌株G81的鉴定
2.3.1 形态及生理生化特征 经平板划线观察G81的形态特征,结果(表3) 显示,G81菌落表面粗糙,中央隆起、有褶皱,灰白色,无光泽,不透明。生理生化测试结果显示,G81能利用葡萄糖、木糖醇、淀粉和明胶等多种碳源。根据以上特征,可初步确定G81为枯草芽孢杆菌(Bacillus subtilis)。

表3 G81菌株的形态和生理生化特征Table 3 Morphological,physiological and biochemical characteristics of strain G81
2.3.2 16S rDNA的序列比对与分析 为进一步确定G81菌株的分类学地位,以G81菌株的总DNA为模板,27F/1492R为引物,扩增出了长约1.5 kb的16S rDNA,测序结果通过NCBI-Blast比对分析,与枯草芽孢杆菌的16S rDNA序列同源性达到100%。同时结合其表型特征,最终确定G81菌株为枯草芽孢杆菌。
2.4 优势菌株G81的盆栽促长效果
2.4.1 对番茄幼苗生物量的影响 G81对番茄根系和茎叶具有协同促长作用,以稀释200倍处理促生效果最佳,各项指标值均较CK提高30%以上,毛细根数量增加2倍以上,差异均达到了极显著水平(表4)。即G81菌株稀释200倍处理可极显著促进番茄地下部和地上部的生长,改善根系结构,提高植株对养分的吸收能力,为植株系统抗性的提高奠定了基础。
2.4.2 对叶片叶绿素含量的影响 G81可显著提高番茄叶片的叶绿素含量,以稀释200倍处理效果最佳,各指标值均显著高于其他处理,其中叶绿素a、b含量分别较CK提高了2.68倍和2.43倍(表5)。稀释100倍与稀释300倍处理的番茄叶片叶绿素含量差异不显著,但均显著>CK,其中叶绿素a含量分别较CK提高了1.83倍和1.81倍,叶绿素b含量分别提高了1.09倍和1.36倍。番茄植株叶片叶绿素含量的提高可能与G81菌株的促生长作用有关。
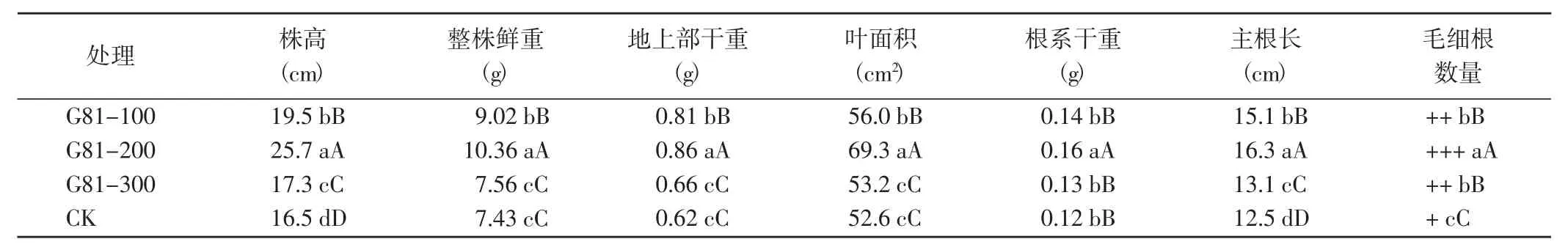
表4 不同处理对苗期番茄生物学特征的影响Table 4 Effects of different treatments on biological characteristics of tomato at seedling stage
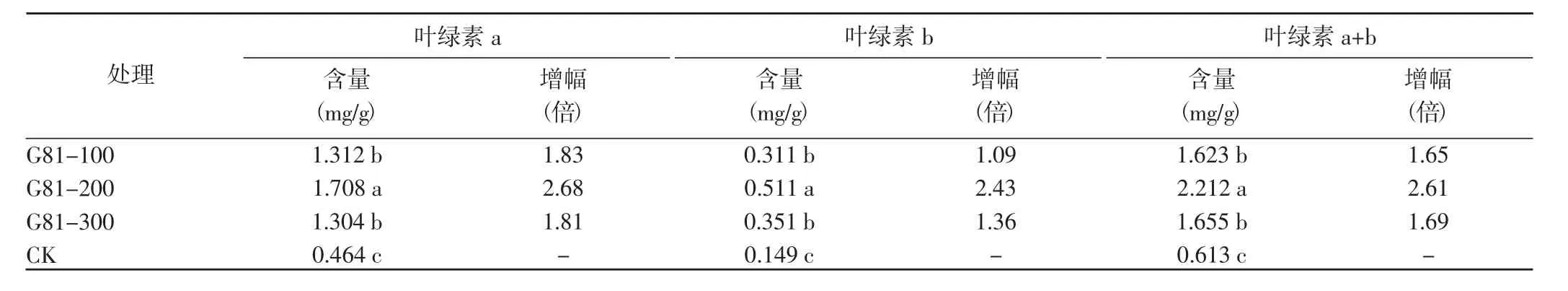
表5 不同处理对番茄叶绿素含量的影响Table 5 Effects of different treatments on chlorophyll content of tomato
3 结论与讨论
根际微生物在植物根际代谢旺盛,可分泌出促进植物生长的多种酶类等物质。根际微生物通过分泌铁载体,可为寄主植物提供铁元素,进而抑制有害微生物的生长和繁殖;通过分泌IAA,直接参与植物的生长,有利于植物地上部和根部的生长;通过改变植物根际微环境,活化土壤中的难溶性磷,改善植物的磷营养状况[19]。荣良燕等[20]分离出的产铁载体PGPR菌LHS11对黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerinum)抑制率达80%以上。李引等[21]分离筛选出的花生根际益生菌既产IAA又具有解磷能力。康贻军等[22]从小麦、油菜等根际土壤中分离的菌株RBP1,在培养基中利用钼锑抗比色法测定该菌的最高含磷量为106.75 mg/L。
PGPR的促生长效应一般是通过其产IAA、产嗜铁素、溶磷等多种功能共同作用实现的[23~26],尤其是在植物幼苗期。刘秀花等[25]对小麦根际促生菌进行了研究,结果发现接种促生菌株B5后,小麦幼苗的株高、鲜重、根长分别较CK增加了17.2%、21.0%和20.5%;段秀梅等[26]对玉米、树莓等的根际土壤促生菌进行了研究,结果发现在玉米上混接菌株P9和P28,玉米苗期的株高和干重分别较CK增加了35.5%和28.9%。
目前对生产实践具有重要作用的根际促生菌株,不仅要具有促生长作用,还要具有抑制病原菌的能力[27]。孙广正等[28]发现,根际促生菌不仅能够促进油菜生长,而且对菌核病菌和立枯丝核菌具有良好的抑制效果;王静等[29]发现,短小芽胞杆菌AR03菌株的菌悬液对烟草炭疽病的防治效果为83.03%,可显著抑制烟草炭疽病的发生。
本研究条件下,从番茄根际土壤中分离出了11株同时具有溶磷和产IAA等能力的功能菌,其中G81、G92和G99具有解磷、固氮、产铁、产IAA的功能;采用平板对峙法测定了3个菌株对番茄灰霉病菌、茄子早疫病菌、番茄丝核病菌、棉花枯萎病菌、黄瓜镰刀菌和辣椒腐霉的抑制效果,结果显示,3个菌株的抑菌作用均较为明显,抑菌带宽度为5.9~9.3 mm,其中G81对6种病原真菌的抑菌效果最佳。采用盆栽方法对筛选出的优势菌株G81进行番茄促生长效应测定,结果显示,接种G81的番茄幼苗各项生理指标均明显高于对照。可进一步对G81菌株进行研发,以制备促生菌剂。
植物根际细菌对植物的作用,与植物种类和菌种代谢产物的浓度有关[30]。G81稀释200倍处理的番茄幼苗株高、主根长、整株鲜重、地上部干重、根系干重和叶绿素a+b含量分别较CK增加了55.6%、30.4%、39.4%、38.7%、33.3%和2.61倍,效果显著优于稀释100倍和300倍处理,但其田间应用效果还有待进一步验证。此外,为了后期更好地应用和推广根际促生菌株,采用荧光显微镜定期观测优势菌株在土壤中的定殖能力及变化动态试验正在进行中。
