主动脉内球囊反搏联合体外膜肺氧合在急性心肌梗死合并心原性休克患者救治中的应用
2019-12-10田峰周珊珊张王晶都日娜田淬韦妍妍陈韵岱
田峰 周珊珊 张王晶 都日娜 田淬 韦妍妍 陈韵岱
心原性休克(cardiogenic shock,CS)是急性心肌梗死(acute myocardial infarction,AMI)患者最常见的死亡原因之一,尽管早期行血运重建和积极的药物治疗,AMI合并CS患者的死亡率仍然在50%以上[1]。机械循环支持(mechanical circulatory support, MCS)理论上可迅速纠正血流动力学紊乱状态、改善组织脏器灌注。目前国内临床上应用的MCS包括主动脉内球囊反搏(intra-aortic balloon pump, IABP)、Impella以及体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)等。IABP是临床最常应用的MCS器械,其改善血流动力学的效果已被多数医师认可。然而IABPSHOCKⅡ研究及6年随访结果显示IABP并未改善AMI合并CS患者的预后[2-3]。《急性ST段抬高型心肌梗死诊断和治疗指南(2019)》[4]对IABP的推荐等级也有下降。因此IABP在AMI合并CS治疗中的应用价值需要进一步探讨。ECMO可同时提供心肺支持,改善全身的组织灌注,增加AMI合并CS患者的生存率。《2019 AMI合并CS管理指南更新》[5]推荐ECMO可用于AMI合并CS的短期循环支持,但使用ECMO的时机并不明确。亦有研究表明IABP联合ECMO并未改善CS患者的生存率[6]。因此,对于MCS在AMI合并CS患者中的使用价值仍需进一步研究。本研究旨在探讨IABP联合ECMO救治AMI合并CS患者的器械支持时机和流程。
1 对象与方法
1.1 研究对象
连续纳入解放军总医院2015年1月到2019年8月诊断为AMI合并CS的患者164例,其中男性116例(70.7%),平均年龄(64.7±10.4)岁。入选标准:明确诊断为AMI患者、合并CS、年龄≤80岁。排除标准:(1)心肺复苏后患者;(2)合并恶性肿瘤患者;(3)合并消化道出血等出血性疾病;(4)严重肝肾功能不全患者;(5)股动脉重度狭窄(≥75%)或者支架置入史。CS的诊断参照IABP-SHOCKⅡ研究[2]中使用的3条标准,包括:(1)收缩压<90 mmHg(1 mmHg=0.133 kPa)持续30 min以上或使用儿茶酚胺维持收缩压在90 mmHg以上;(2)存在肺瘀血;(3)器官灌注受损,表现为神志异常、皮肤四肢湿冷、尿量<30 ml/h、乳酸>2.0 mmol/L中至少一项。所有患者均签署知情同意书。
1.2 治疗方案
所有患者依照以下治疗流程进行:首先使用多巴胺或去甲肾上腺素维持血流动力学稳定,并根据血压情况逐渐调整剂量,以收缩压≥90 mmHg及组织灌注改善为治疗目标,多巴胺剂量达到15 µg/(kg · min)、去甲肾上腺素剂量达到0.2 µg/(kg · min)仍不能维持收缩压≥90 mmHg时,即刻经股动脉入径置入IABP;无IABP置入条件的患者,继续增加多巴胺和去甲肾上腺素剂量。置入IABP的患者在10 min内收缩压及组织灌注仍不能改善者,拟经股动脉和股静脉入径置入静-动脉(veno-arterial,VA)-ECMO;无置入VA-ECMO条件的患者,继续加大多巴胺或者去甲肾上腺素剂量。治疗流程见图1。无IABP或VA-ECMO置入条件包括:器械置入的相对禁忌证、医疗费用问题或者患者家属不同意。儿茶酚胺类药物无反应定义为应用多巴胺剂量15 µg/(kg · min)、去甲肾上腺素剂量0.2 µg/(kg · min)仍不能维持收缩压≥90 mmHg、CS表现无改善的患者。所有患者由术者决定急诊冠状动脉造影的时机和策略,经股动脉入径置入IABP,股动、静脉切开或者Seldinger技术穿刺置入VA-ECMO的动静脉插管。
1.3 分组
根据患者接受的不同治疗策略进行分组,见图1。A组(45例):给予多巴胺[剂量<15 µg/(kg · min)]、去甲肾上腺素[剂量<0.2 µg/(kg · min)]治疗后收缩压≥90 mmHg、CS表现改善的患者;B组(119例):给予多巴胺[剂量达到15 µg/(kg · min)]、去甲肾上腺素[剂量达到0.2 µg/(kg · min)]治疗后血压和组织灌注无改善的患者。B组患者根据进一步治疗策略再分为两组:C组(37例)继续增加多巴胺、去甲肾上腺素剂量;D组(82例)为置入IABP治疗。D组患者再次根据进一步的治疗策略分为3组:E组(26例)为置入IABP后血压及组织灌注改善,收缩压维持在90 mmHg以上;F组(46例)为置入IABP后血压及组织灌注无改善,继续增加多巴胺、去甲肾上腺素剂量来维持治疗;G组(10例)为置入IABP后血压及组织灌注无改善,即刻经股动、静脉入径置入VA-ECMO。
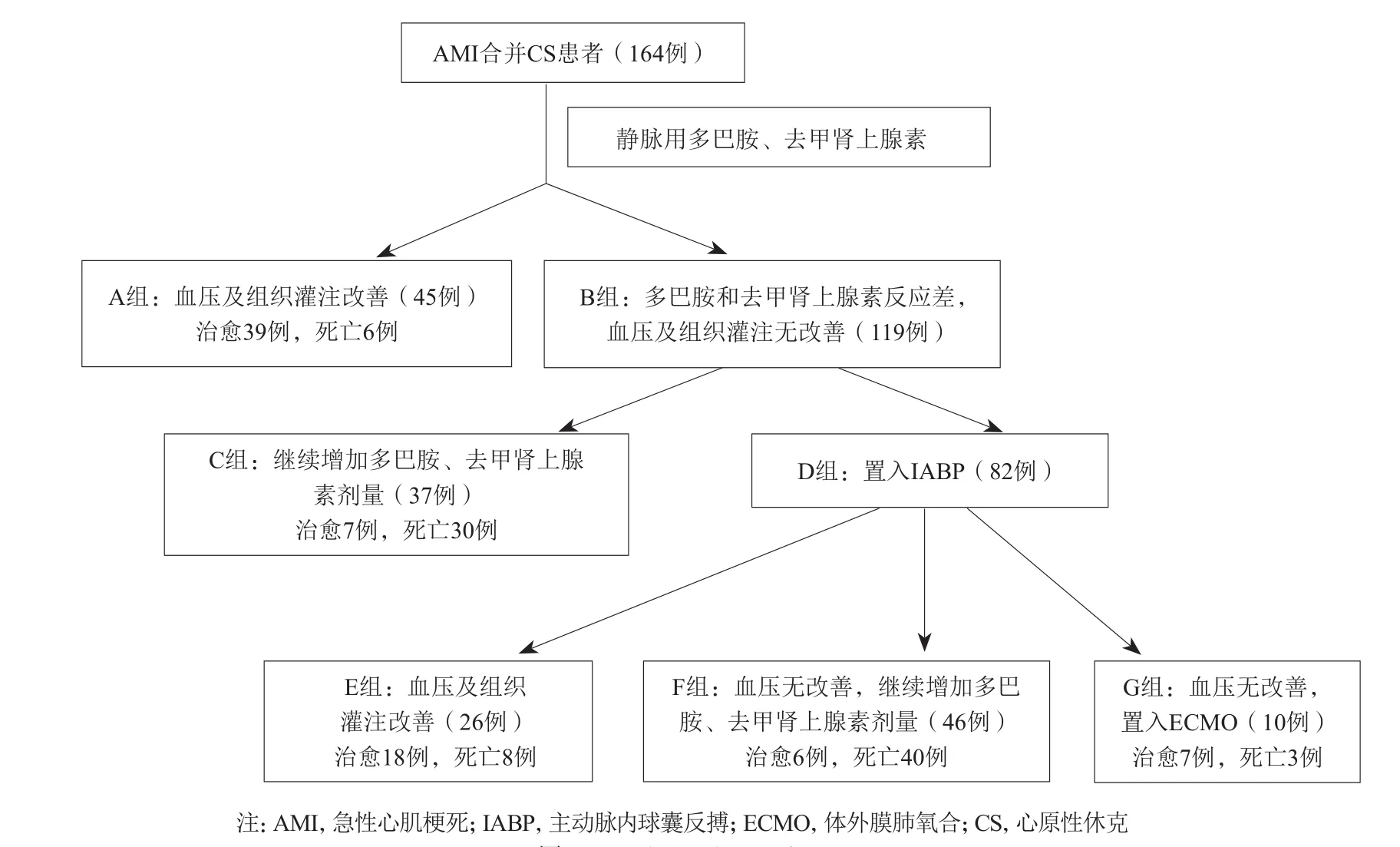
图1 AMI合并CS的治疗流程
1.4 观察终点
主要终点为药物治疗和器械辅助治疗的住院死亡率和出院后30 d死亡率。次要终点为组织灌注和酸中毒的变化情况,以及器械辅助的并发症发生情况。
1.5 统计学分析
所有数据采用SAS 9.4统计软件进行处理。正态分布计量资料采用(x-±s)表示,组间比较采用t检验;非正态分布的计量资料采用中位数(最小值,最大值)表示,组间比较采用Wilcoxon秩和(Wilcoxon Rank sum)检验。计数资料采用频数和构成比表示,组间比较采用卡方检验。采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料情况
应用多巴胺[剂量<15 µg/(kg · min)]、去甲肾上腺素[剂量<0.2 µg/(kg · min)]后血压和组织灌注改善的患者45例(27.4%,45/164,A组),血压无改善的患者为119例(72.6%,119/164,B组)。B组患者中有37例(31.1%,37/119,C组)采用继续增加多巴胺和去甲肾上腺素剂量的治疗方法,另82例(68.9%,82/119,D组)患者置入IABP。D组患者中有26例(31.7%,26/82,E组)血压和组织灌注改善,46例(56.1%,46/82,F组)因血压和组织灌注未改善而继续增加多巴胺和去甲肾上腺素剂量治疗,10例(12.2%,10/82,G组)因血压和组织灌注未改善经股动、静脉入径置入VA-ECMO。
2.2 不同治疗策略的院内死亡率及出院30 d死亡率
尽管给予了积极的救治,纳入研究的164例患者总死亡率仍然高达53.0% (87/164)。 A组患者的死亡率为13.3% (6/45),B组为68.1% (81/119),两组比较差异有统计学意义(P<0.001)。C组患者的死亡率为81.1%(30/37),F组为87.0% (40/46),两组比较差异无统计学意义(P=0.550)。E组的死亡率为30.8% (8/26),显著低于需要增加升压药物治疗的C组(30.8% 比81.1%, P<0.001)和F组(30.8% 比87.0%, P<0.001)。G组的死亡率为30.0% (3/10),显著低于置入IABP后无效、需要增加升压药物治疗的F组(30.0%比87.0%,P=0.001)。治愈患者出院30 d内无死亡发生。
2.3 10例患者行IABP联合ECMO的治疗情况
10例患者收缩压为76(70,86)mmHg,经股动脉入径置入15 F鞘管和经股静脉入径置入19 F静脉鞘管,连接管路后转机,平均血流量为(3.56±0.37)L/min。置入VA-ECMO 6 h后患者的血压和组织灌注明显改善,血乳酸水平由术前的(15.29±4.62)mmol/L下降到(4.51±1.85)mmol/L,差异有统计学意义(P<0.001),置入12 h后血乳酸降至正常,平均为(1.29±0.52)mmol/L。VA-ECMO的平均辅助时间为(96.8±12.4)h,VA-ECMO辅助期间有2例发生置管部位渗血和局部血肿,2例膜肺中有小块血栓形成,6例发生血小板减少,经相应处理后好转,无其他严重并发症发生。8例患者成功撤机,有7例患者治愈出院,3例患者死亡,其中1例死于多脏器功能衰竭,2例死于泵衰竭。
3 讨论
急诊经皮冠状动脉介入治疗显著降低了AMI患者的死亡率。但AMI合并CS患者尽管进行了积极的血运重建和药物治疗,其死亡率仍然居高不下,主要原因为持续的组织低灌注导致严重的酸中毒和多脏器功能衰竭。急诊经皮冠状动脉介入治疗开通梗死相关血管可改善心肌血供,但是心肌再灌注损伤、慢血流等可导致血流动力学的进一步恶化,尽早纠正组织低灌注、维持血流动力学稳定是治疗的关键,儿茶酚胺类药物可升高血压改善组织灌注,但仍有大部分患者即使用大剂量儿茶酚胺类药物仍不能改善循环状况。早期的MCS支持可迅速纠正血流动力学紊乱状态、改善组织脏器灌注,目前临床上应用的MCS包括IABP、Impella以及ECMO等[7]。无论是IABPSHOCK研究还是临床荟萃分析,IABP与单纯药物治疗相比均未降低死亡率,IABP在AMI的治疗指南中的推荐级别在降低,但IABP在改善血流动力学指标上仍有一定作用[2,4,8-9]。本研究中IABP是在应用大剂量血管活性药物仍然不能改善循环和组织灌注后置入的,尽管患者仍有较高的住院死亡率,但是有31.7%(26/82)患者在置入IABP后血流动力学改善(E组),死亡率较置入IABP后血流动力学无改善的F组有显著降低,表明选择合理适应证的患者能够从IABP治疗中获益。
ECMO是一种模仿心肺机的装置,不仅可以维持机体正常的氧合水平,还能改善全身的组织灌注、降低心肌氧耗,为CS的救治争取时间。本研究中AMI合并CS患者中采用的是VA-ECMO模式。多项研究表明,VA-ECMO可显著改善AMI合并CS患者的生存率,在进行再灌注治疗前置入VA-ECMO有较好的临床效果,显著改善患者30 d和远期预后[10-13]。本研究中采用VA-ECMO的患者为大剂量药物联合IABP治疗无效的患者。IABP治疗无效继续增加升压药物治疗患者(F组)的死亡率高达87.0%,置入VA-ECMO后患者(G组)的组织灌注改善,酸中毒很快得到纠正,死亡率降低到30.0%,提示IABP联合ECMO可以进一步降低急危重AMI合并CS患者的死亡率。AMI患者诊断为CS后是否即刻置入ECMO没有定论,但长时间的组织低灌注显著增加患者死亡率。本研究按照临床处置流程,在药物、IABP治疗效果评价10 min内启动ECMO团队置入VA-ECMO,尽可能缩短组织低灌注时间,为CS的救治争取时间。VA-ECMO置入后会增加心脏后负荷,而IABP可降低心脏后负荷,两者联用可以效用互补。然而有研究显示,IABP联合ECMO并未改善CS患者的生存率[6]。AMI合并CS患者进行急诊经皮冠状动脉介入治疗的治疗模式也在探讨中[14]。鉴于以往研究的样本量均偏小, AMI合并CS患者进行IABP联合VAECMO治疗的效果仍需要进一步研究。本研究中置入VA-ECMO的3例死亡患者中:1例置入时间较晚,在组织低灌注持续24 h后置入VA-ECMO;另外2例为大面积心肌梗死导致泵衰竭,心脏功能无恢复。有荟萃分析表明,尽管ECMO 可以提高CS的存活率,但是置入前需要慎重评估获益和风险[15]。因此,合理选择适应证和置入时机,是AMI合并CS患者进行机械循环辅助治疗的关键环节,从而达到降低这类极高危患者院内死亡率的目标。
