禽肾炎病毒与鸡细小病毒双重PCR 检测方法的建立
2019-12-06张艳芳谢芝勋邓显文谢志勤张民秀罗思思谢丽基曾婷婷黄娇玲刘加波
张艳芳,谢芝勋,邓显文,谢志勤,张民秀,罗思思,谢丽基,范 晴,曾婷婷,黄娇玲,刘加波
(广西壮族自治区兽医研究所,广西兽医生物技术重点实验室,广西南宁 530001)
禽肾炎病毒(avian nephritis virus,ANV)是引起鸡肠道疾病的重要病原体之一,感染各龄期的鸡,但以侵害雏鸡为主,也可感染火鸡、鸭子和鸽子[1]。该病毒主要引起一种典型的亚临诊症状,虽致病力不强,但感染性强,能在鸡群中迅速传播,广泛见于世界各地,严重的可导致肠炎、肾损伤及肾功能衰竭等,并与鸡矮小综合征有关[2-3]。鸡细小病毒(chicken parvovirus,ChPV)同属鸡肠道病毒,主要侵害雏鸡,可引起以腹泻、精神抑郁、体温调节障碍、生长迟缓、营养吸收障碍等为特征的急性或慢性肠道性疾病,与矮小综合症和营养不良综合症有关,在鸡群中普遍存在,给养鸡业造成较大的经济损失[4-6]。ANV 与ChPV 均可引起雏鸡营养吸收障碍,导致营养不良及矮小综合症的发生,严重危害养鸡业的发展,特别是混合感染时,危害程度尤为明显。多重PCR 可同时检测和鉴别多种病原体,不仅灵敏度高、检测快速、特异性好,且操作简易、能实现标准化[7],在临床多种病原混合感染的鉴别诊断上具有独特的优势[8-9]。本研究设计了2对ANV 和ChPV 扩增片段大小分别为511 bp和242 bp 的特异性引物,建立了能够同时检测这两种病毒的双重PCR 检测方法。
1 材料
1.1 主要病原体
禽肾炎病毒(ANV)、鸡细小病毒(ChPV)、禽流感病毒H9亚型(AIV-H9)、鸡传染性喉气管炎病毒(AILTV)、鸡传染性支气管炎病毒(IBV)、新城疫病毒(NDV)、禽呼肠孤病毒(ARV)、马立克病毒(MDV)和大肠杆菌(E.coli),由本实验室保存(表1)。
1.2 主要试剂
DNA/RNA 提取试剂盒、细菌DNA 抽提试剂盒、胶回收试剂盒、2×TaqPCR Mix 均购自北京全式金生物技术有限公司,反转录试剂、pMD 18T Vector、100 bp Marker Ladder 购自大连宝生物公司。
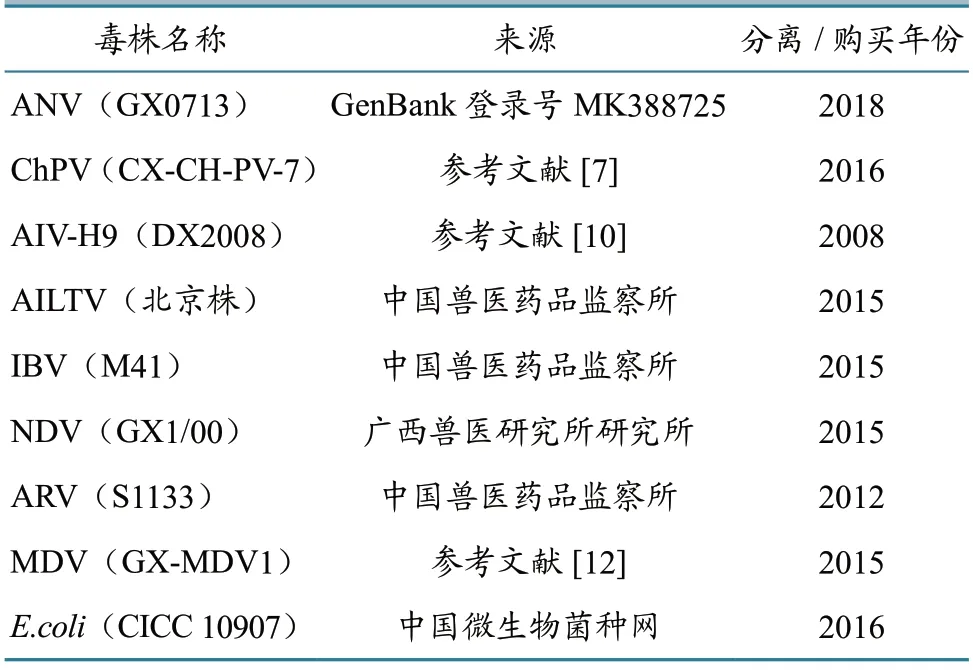
表1 毒株来源
1.3 主要仪器
移液枪,购自法国吉尔森公司;生物安全柜,购自美国Baker 公司;PCR 扩增仪、凝胶成像系统,购自美国Bio-Rad 公司;NanDrop ND-2000微量核酸检测仪,购自美国赛默飞公司;高速离心机,购自美国贝克曼公司;电泳仪,购自北京六一仪器公司等。
2 方法
2.1 引物的设计与合成
根据GenBank 中ANV 的ORF基因和ChPV的NS1基因的保守序列,采用Primer 5.0软件设计引物和DNAStar 软件进行比对筛选,通过NCBI的Blast 验证,设计筛选出了两对ANV 和ChPV特异性引物(表2)。引物由北京六合华大基因科技股份有限公司合成。

表2 两对特异性引物序列
2.2 DNA/RNA 抽提及反转录
参照DNA/RNA 提取试剂盒说明书,提取ChPV、MDV 和AILTV 的DNA;抽 提ANV、AIV-H9、IBV、NDV 和ARV 的RNA,使用反转录试剂按说明书将RNA 反转录成cDNA;使用细菌DNA 抽提试剂盒提取E.coliDNA。均保存于-30 ℃备用。
2.3 反应条件的优化
扩增体系为25 μL:2×PCR Mix 12.5 μL,ANV 的cDNA 和ChPV 的DNA 各1 μL 作为混合模板,2对引物不同比例共加入2 μL(浓度均为20 mol/L),最后用ddH2O 补足25 μL 反应体系。对双重PCR 各引物比例进行优化,选择最佳比例,再设置梯度PCR 选择最适退火温度。反应条件为:95 ℃预变性5 min;94 ℃ 45 s,退火温度50~60 ℃,72 ℃ 45 s,35个循环;72 ℃延 伸10 min,12℃保存。PCR 产物经浓度为1.2%琼脂糖凝胶进行电泳,观察结果,拍照保存。
2.4 特异性试验
利用已优化的双重PCR 方法,对AIV-H9、NDV、ARV、MDV、AILTV、IBV 和E.coli待 检核酸样品进行检测,同时设阴性对照,检验所建立方法的特异性。
2.5 敏感性试验
使用NanDrop ND-2000微量核酸检测仪,测定ANV 和ChPV 的核酸模板浓度,对已知浓度的模板按10倍梯度稀释后,逐一进行双重PCR 扩增,以评估本研究建立的双重PCR 方法的灵敏性。
2.6 临床样品检测试验
对2017年11月至2018年5月广西南宁地区规模化养鸡场采集的40份鸡泄殖腔拭子样品,采集后放入含有双抗的生理盐水中,置于用冰袋维持低温的泡沫箱中密封;当日带回实验室,进行核酸抽提和反转录;应用所建立的双重PCR 方法进行检测,试验重复两次;将目的条带回收、克隆,挑选阳性菌送至赛默飞广州分公司进行测序。
3 结果
3.1 反应条件优化
通过对ANV 和ChPV 引物比例、退火温度和反应时间等条件进行优化,确定了最佳引物组合比例:ANV 上下引物各0.4 μL,ChPV 上下引物各0.6 μL(图1);最佳退火温度为53.8℃;最佳ANV 和ChPV 的双重PCR 反应体系:2×PCR Mix 12.5 μL,ANV 和ChPV 上下引物共2μL,混合模板2μL,加ddH2O 补足25 μL;PCR 反应条件:95 ℃ 5 min;95 ℃ 45 s,53.8 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃10 min 延伸,12℃保存(图2)。ANV 和ChPV 均可以特异地扩增出相应的目的条带,ANV 为511 bp,ChPV 为242 bp,没有出现非特异性条带。

图1 双重PCR 引物优化试验结果
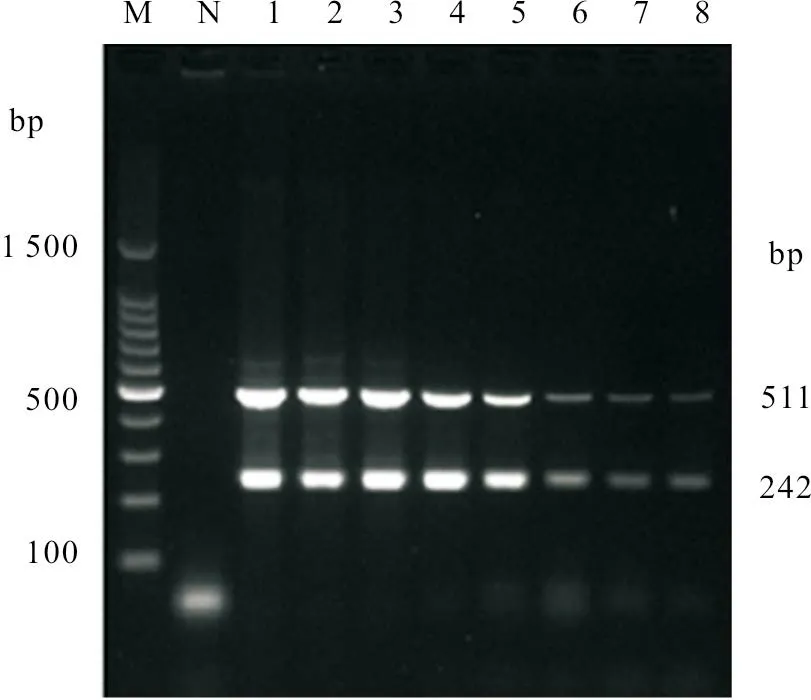
图2 双重PCR 温度优化试验结果
3.2 特异性试验
利用本研究建立的ANV 和ChPV 双重PCR方法对10份待检样品进行检测。结果显示:ANV扩增出511 bp 的特异性条带,ChPV 扩增出242 bp的特异性条带,AIV-H9、NDV、ARV、MDV、AILTV、IBV和E.coli均没有出现特异性条带(图3)。
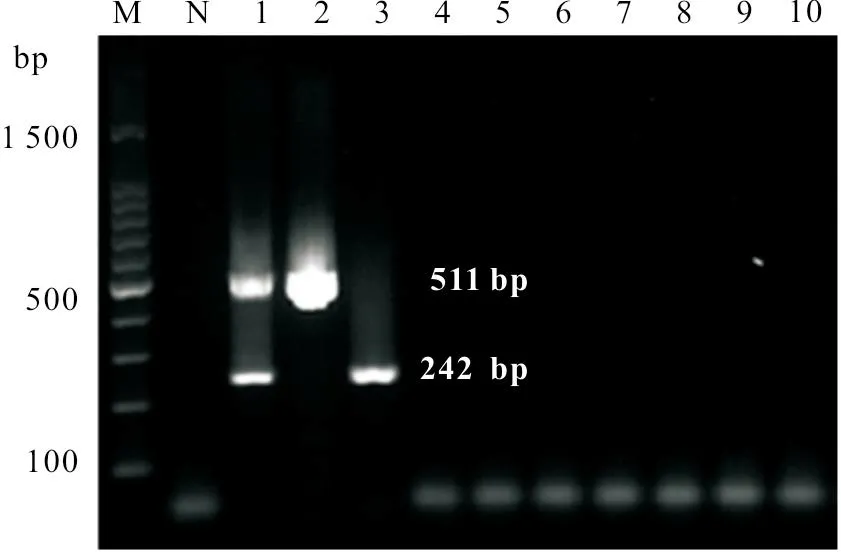
图3 双重PCR 特异性试验结果
3.3 敏感性试验
用NanDrop ND-2000微量核酸检测仪测得ANV 和ChPV 的核酸浓度分别为55 ng/μL 和58 ng/μL。将已知浓度的核酸进行10倍梯度稀释,应用优化的双重PCR 对各稀释梯度的模板进行检测。结果显示,本研究建立的双重PCR 最低能同时检测到55 fg 的ANV 和58 fg 的ChPV(图4)。
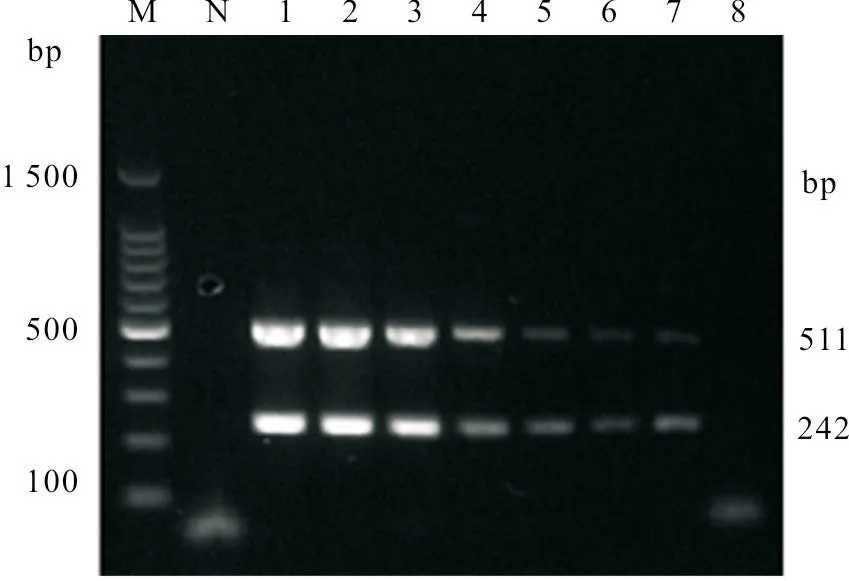
图4 双重PCR 敏感性试验结果
3.4 临床样品检测
用建立的双重PCR 对实验室采集的40份鸡棉拭子样品进行检测试验,结果检出2份ANV 和ChPV 的混合感染、1份ChPV 阳性、5份ANV 阳性,重复检测结果一致,并且与单重PCR 检测及测序方法得出的结果一致,部分临床样品检测结果见图5。扩增的目的片段与相应序列同源性高达96%~99%。
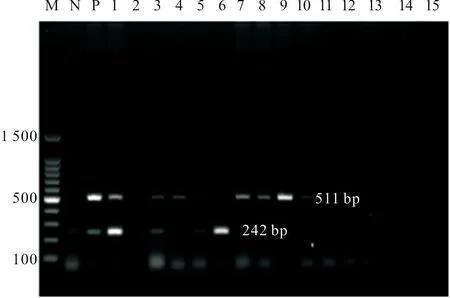
图5 双重PCR 临床样品检测结果
4 讨论
鸡的肠道类疾病严重危害世界各地养鸡业的发展,给家禽业造成了严重的经济损失。ANV 和ChPV 均属于肠道性疾病病原,鸡的肠炎、生长障碍以及营养不良症状都与这两种病毒有关[2]。虽然这两种鸡病毒的致病性不强,也没有相关大暴发的记录,但根据现有的文献[11]报道,在孵化雏鸡过程中发现ANV 和ChPV 能够垂直传播,并引起孵化率的下降。因此对这两种疾病的监测不容忽视。ANV 和ChPV 引起的临床症状较为相似,主要侵害雏鸡,在临床上容易导致混合感染,给临床诊断带来困难。目前对两种病毒尚没有进行有效的防控,严重地制约了现代养禽业的发展。
传统病毒鉴定方法耗时长,常规的检测方法费时费力,敏感性也不高,无法实现快速诊断。PCR 方法作为实验室常见的实用型分子生物学检测方法,具有操作简易、特异性强、敏感性高、稳定性好等优点。在单重PCR 方法日渐成熟的基础上,双重或多重PCR 方法的报道也较常见,即在一个体系中加入多种引物和模板[12],一次PCR就能检测多种病原体,当天就能出结果。建立双重PCR 检测方法关键在于引物的设计和筛选。首先,两种病毒检测的目的片段大小要有合适的梯度,确保产物量相对平衡,目的片段大小相差不宜超过300 bp,各引物退火温度尽可能相近。其次,应防止引物和模板之间的非特异性结合,尽量避免产生引物二聚体和防止出现非特性条带[13-14]。本研究根据ANV 和ChPV 的保守基因序列设计和筛选出两对特异性引物,通过优化反应条件和体系,确定最佳引物比例分别是ANV 0.4 μL(20 mol/L)和ChPV 0.6 μL(20 mol/L)。设置50.0~60.0 ℃的退火温度梯度,均能特异地扩增出目的片段,53.8 ℃为本研究建立的双重PCR 方法最佳退火温度。
通过对ANV 和ChPV 双重PCR 的特异性和敏感性试验,可知该方法能同步检测两种病毒,而对常见的鸡病病原包括AIV-H9、MDV、AILTV、IBV、NDV、ARV 和E.coli等进行检测,均没有出现特异性目的条带;灵敏度与单重PCR 一致,最低能检出55 fg ANV 和58 fg ChPV,具有很高的敏感性。此方法降低了成本,节约了时间,能够达到快速检测这两种鸡肠道性疾病的目的。
利用本研究建立的ANV 和ChPV 双重PCR检测方法,对2017年11月至2018年5月采集的40份鸡泄殖腔拭子进行检测,发现与单重PCR 结果一致。因此,本研究建立的双重PCR 检测方法可用于快速检测ANV 和ChPV 的混合感染,既可节约时间、降低成本,又能减少污染,为两种病毒的防控提供了技术支撑。
