受体介导的1-磷酸鞘氨醇信号通路在局灶性脑缺血损伤中作用
2019-12-06李洁琦闵连秋
李洁琦,李 萌,闵连秋
1-磷酸鞘氨醇(Sphingosine 1 phosphate,S1P)在不同器官中生物学行为和功能主要由其5个特异性g蛋白偶联受体(G Protein-Coupled Receptors,GPCRs)[1,2]介导产生。基于S1P受体开发的药物芬戈莫德(FTY720)就是一种基于在磷酸化后非选择性的与5个S1P受体亚型中的4个绑定后形成的一种药物[3]。目前该药物已经用于治疗多发性硬化症[4]。然而,到目前为止S1P的受体亚型在每种疾病类型中的具体作用机制尚不清楚。S1P1在脑缺血再灌注损伤中的致病作用表明,FTY720在该病中是通过作为S1P1功能拮抗剂的来实现治疗作用的[5]。此外,有研究发现在脑缺血再灌注损伤发作后S1P3的mRNA水平升高[6],这说明S1P3可能是脑缺血再灌注损伤的另一致病因素,FTY720对脑缺血再灌注损伤的疗效也有可能通过抑制S1P3来实现[7]。然而,目前还没有明确S1P3在局灶性脑缺血再灌注损伤中是否参与了脑损伤过程,以及S1P3的致病或神经保护作用的报道[8]。因此,本研究拟通过构建大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)小鼠模型,在小鼠脑缺血再灌注后给予S1P3拮抗剂CAY10444干预,评估各组动物脑损伤、脑梗死、神经功能缺损和神经细胞死亡等情况。
1 实验材料和方法
1.1 实验材料
1.1.1 实验动物 雄性成年昆明小鼠(32 g±3 g,6 w)购置于锦州医科大学实验动物中心。在昼夜照明07:00-19:00(光)、温度(22±2)℃、相对湿度(60±10)%环境条件下饲养适应环境1 w后,进行后续实验。
1.1.2 主要试剂 CAY10444(赛默飞世尔中国);Brdu、rabbit anti-NF-κB(p65)、rabbit anti-Iba1、Donkey anti-BrdU、Mouse anti β-actin、DAB购于北京博奥深生物技术有限公司;神经元蛋白提取试剂及嵌合绿色荧光PCR试剂购于上海基康生物技术有限公司。
1.2 实验方法
1.2.1 动物模型制备及分组 小鼠用异氟烷进行麻醉,3%浓度用来诱导,以1.5%浓度维持。通过腹侧颈部切口分离右颈总动脉。从颈动脉分叉处向颈内动脉引入一根硅胶包裹的6-0手术线,结扎阻断大脑中动脉。大脑中动脉闭塞30 min后,解开结扎的手术线,使大脑区域完全恢复血流处于再灌注状态。在手术期间,采用保温措施将动物的体温维持在(37.0±0.5)℃。手术后,将小鼠置于鼠笼子里饲养,自由进食,按期更换垫料,最后处死动物取脑标本。实验动物分为以下3组,每组10只:1.模型组(MCAO组):按照上述方法制备MCAO小鼠模型;2.药物干预组(MCAO+CAY组):制备MCAO模型动物,动物脑缺血再灌注时将CAY10444分别以0.1 mg/kg、0.2 mg/kg和0.5 mg/kg的浓度给小鼠腹腔注射;3.假手术组(正常对照组):小鼠除不进行大脑中动脉结扎闭塞外,其他手术操作与模型组相同。
1.2.2 神经功能评分和脑梗死评估 采用改良神经功能缺损评分(modified neurological severity score,mNSS)量表评估功能神经受损程度,以确定MCAO后的运动、感觉、平衡和反射障碍等[9]。在神经功能评分后,采用断颈法处死小鼠,迅速取出大脑,并在的小鼠大脑磨具刀组中切2 mm厚切片。大脑组织切片用含2%TTC的生理盐水在37 ℃下孵化20 min。拍摄TTC染色的脑切片图像,使用图像分析软件计算梗死体积。
1.2.3 组织学观察与分析 MCAO术后1 d和3 d取脑组织标本进行组织学分析。小鼠采用异氟烷进行麻醉,通过心脏灌注冷的PBS和4%多聚甲醛混合液对脑组织进行固定。分离大脑组织,并在含30%蔗糖的灌流固定液中孵育,4 ℃冰箱过夜。将脑组织切成20 μm厚切片。在MCAO后1 d进行TTC组织化学染色。脑切片依次在梯度乙醇中水化(100%浸泡3 min,70%浸泡1 min,30%浸泡1 min),去离子水冲洗,0.06% KMnO4氧化。切片在0.1%醋酸溶液中,用0.01%的 TTC染色30 min,去离子水漂洗,在载玻片烘片机中干燥,二甲苯浸泡透明处理,然后盖玻片。
1.2.4 Iba1免疫组织化学染色 在MCAO术后1 d和3 d行Iba1免疫组化染色。5 μm 厚切片,二甲苯脱蜡,酒精梯度入水,高压锅内枸橼酸盐进行抗原修复。切片在含1% H2O2的PBS中氧化15 min,含1%胎牛血清(FBS)的0.3% Triton-X100中阻断1 h,阻断非特异性蛋白结合。然后,脑切片与兔抗Iba1抗体(1∶500),在4℃ 孵育过夜。次日,切片与HRP标记的抗兔Ig-G二抗(1∶200)室温下孵育1h。DAB显色,镜下观察终止显色。用下行乙醇梯度浓度脱水,二甲苯透明,封片。
1.2.5 BrdU / Iba1免疫荧光双染 在MCAO后2 d和3 d,每隔12 h给予小鼠尾静脉BrdU(50 mg/kg溶于PBS中)注射。小鼠处死后,取MCAO后大脑组织切片,与Tris溶液在100℃下孵育30 min进行抗原修复,Triton X-100中封闭1 h。然后与BrdU(1∶200)抗体在4℃孵育过夜。切片用HRP标记的二抗(1∶200)进行孵育。DAB显色。染色的切片再次用PBS冲洗(3×5 min),再次进行阻断,与抗体Iba1(1∶500)在4℃孵育过夜。然后用与Cy3(1∶1000)标记的二抗孵育,用抗荧光猝灭试剂进行封片。
1.2.6 免疫阳性细胞定量分析 从每个区域的不同部分拍摄3张照片,使用Adobe Photoshop CS3软件进行图像分析。并计算免疫阳性细胞的数量。然后,以单位面积(mm2)的免疫阳性细胞的平均数量进行表示。
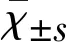
2 结 果
2.1 CAY10444对MCAO小鼠脑损伤和神经功能影响 在MCAO 24 h后,MCAO组小鼠在缺血的皮质和纹状体区出现严重的脑梗死。使用S1P3拮抗剂CAY10444的干预组小鼠脑梗死体积明显减少,且呈剂量依赖性(见表1)。给予最低剂量0.1 mg/kg的CAY10444干预组动物表现为无效,而给予0.2 mg/kg和0.5 mg/kg的CAY10444对减轻脑梗死有效,0.5 mg/kg组对减轻脑梗死和神经功能损伤疗效最佳。通过mNSS分析发现,药物干预组小鼠在运动、感觉、反射和平衡障碍等神经功能参数与MCAO组相比有显著改善(见表1、图1)。通过TTC染色分析缺血后24 h神经损伤程度,与MCAO组相比CAY10444药物干预组减轻了神经损伤的程度(见表1、图1)。
表1 各组动物脑梗死和mNSS评分表
注:MCAO 24 h后测定不同剂量CAY10444对梗死体积和神经功能的影响;与MCAO组比较**P<0.01,***P<0.001
注:MCAO 24 h后不同剂量CAY10444对梗死体积和神经功能的影响。与MCAO组比较**P<0.01,***P<0.001
图1 各组动物脑梗死组织学评估
2.2 CAY10444对MCAO脑内小胶质细胞活化和增殖的影响 MCAO后1 d和3 d通过Iba1免疫组化分析,发现MCAO组小胶质细胞的活化情况增强,表现为缺血半球的Iba1阳性细胞数量较假手术组增多。与MCAO组相比,CAY10444药物干预组在上述两个时间点上Iba1免疫阳性细胞的数量
显著减少,且呈时间和区域依赖性,表现为药物干预组小鼠大脑缺血周围和缺血核心区域活化的小胶质细胞数量均明显减少(见图2、图3)。此外,CAY10444药物干预组小鼠大脑缺血核心区阿米巴样形态的小胶质细胞数量显著减少,即阿米巴形态小胶质细胞/分枝样形态小胶质细胞比例降低(见图3)。

A:CAY干扰对MCAO后1 d小胶质细胞活化的Iba1免疫组织化学染色。P为缺血周围区,C为缺血核区域。标尺=200 μm。B:缺血核心区和周边区Iba1免疫阳性细胞数量的定量分析。与假手术组比***P<0.001。与MCAO组比##P<0.01,###P<0.001
图2 脑缺血后1 d,CAY10444降低小胶质细胞活化情况
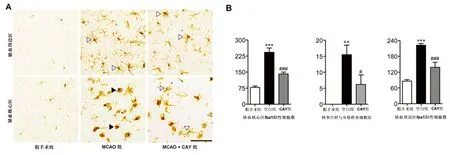
A:缺血周边(P)和缺血核心(C)区域Iba1免疫阳性细胞图。标尺=200 μm。B:缺血核心和周边区Iba1免疫阳性细胞数量、Iba1阳性细胞的形态学改变(阿米巴样/分支样小胶质细胞)。与假手术组比较**P<0.01,***P<0.001;与MCAO组比较#P<0.05,###P<0.001
图3 脑缺血后3 d小胶质细胞的活化情况
在MCAO 3 d 后对脑内BrdU和Iba1进行双重免疫荧光染色,发现MCAO组大脑缺血区小胶质细胞增殖明显,表现为BrdU/Iba1双免疫阳性细胞较假手术组增多。与MCAO组相比,CAY10444药物干预组BrdU/Iba1双免疫阳性细胞的数量明显减少(见图4)。

A:BrdU/Iba1双免疫荧光法测定脑缺血后3 d,边缘区BrdU/Iba1免疫双阳性细胞图。标尺=50 μm。B:BrdU/ Iba1免疫阳性细胞定量分析。与假手术组比较***P<0.001。与MCAO组比较##P<0.01
图4 CAY10444对MCAO后3 d的小胶质细胞增殖的影响
3 讨 论
在本研究中,我们探讨了S1P受体的亚型S1P3在局灶性脑缺血中的致病机制,尤其是对小胶质细胞生物学的影响。MCAO后,通过特异性拮抗剂抑制S1P3活性可减轻脑损伤。S1P3在缺血性脑中的致病作用与小胶质细胞的活化密切相关,包括活化的小胶质细胞数量增多、形态转化为阿米巴样和小胶质细胞增殖。
人们通过FTY720的作用发现受体介导的S1P信号通路是脑缺血损伤的一种可行的治疗方案,因为磷酸化后的FTY720是5个S1P受体亚型中的4个亚型的非选择性调控子,在啮齿动物中具有神经保护作用。尽管FTY720治疗缺血性脑损伤取得了一定的成功,但究竟哪个或哪几个S1P受体亚型是FTY720的实际介导的因子仍不确定。有研究者采用局灶性脑缺血大鼠模证明S1P1是局灶性脑缺血的致病因素[10]。本研究中,我们发现S1P3可能是介导脑缺血损伤的另一种S1P受体亚型。另外,最近有报道认为FTY720 的磷酸盐可作为S1P1的功能拮抗剂发挥神经保护作用[11],这启发我们猜测S1P3也可能对脑缺血损伤起作用。尽管到到目前没有直接证据能证明这个猜测,但是一些研究发现了FTY 720 磷酸盐可拮抗S1P3信号通路。考虑到FTY720磷酸盐对S1P1和S1P3的抑制作用以及既往研究结果,因此,我们猜测FTY720对脑缺血损伤的疗效可能是通过抑制S1P1和S1P3活性实现的。有研究证实S1P2不是FTY720-磷酸盐的靶点,但是S1P2可通过破坏缺血脑中的血管完整性介导脑缺血损伤。因此,目前为止,人们已经确定三种S1P受体亚型为脑缺血的致病因素。然而,目前尚不清楚S1P受体亚型对脑缺血损伤的介导作用是否存在差异,是否还有其他S1P受体亚型如S1P4或S1P5参与了脑缺血损伤机制[12]。
S1P3在大脑中有明确的致病作用,但它在缺血条件下的作用是具有组织选择性的。早期的关于S1P3在非神经缺血模型中的作用的研究报道存在着一些争议。如在心脏中,S1P2和S1P3的缺失均可加重小鼠心肌梗死,支持S1P3的心脏保护作用[13]。然而,在肾脏中S1P3又与缺血后的组织损伤有关[14]。骨髓组织S1P3的缺失可减轻肾缺血/再灌注后的组织损伤,其表达缺失可降低促炎细胞因子的表达水平,增加抗炎细胞因子的表达水平[15]。S1P受体的这些不同作用在S1P1中也存在。S1P1受体激动剂或内皮细胞S1P1缺失可减少或加重缺血后的肾损伤[16]。然而,在大脑中,S1P1的下调减轻了脑缺血后的脑损伤[17]。无论受体介导的S1P信号在非神经组织中的作用如何,S1P1、S1P2和S1P3均参与了脑缺血后的脑损伤发病过程。
在本研究中,由于CAY10444是广泛应用的S1P3特异性拮抗剂,因此我们使用CAY10444作为S1P3拮抗剂来研究其在脑缺血中的作用[18]。有报道证明S1P2是脑缺血再灌注损伤的致病因素之一,因此S1P2不太可能介导CAY10444在脑缺血中的神经保护作用[19]。最后,脑缺血中CAY10444的疗效有可能仅通过S1P3介导。
S1P3在脑缺血后的神经损伤作用似乎与脑内小胶质细胞的激活有关,因为脑卒中等几种中枢神经系统(CNS)疾病都会发生类似的致病作用[20]。此前,通过体外和体内的研究发现,受体介导的S1P信号通路参与小胶质细胞的激活[21]。最近发现S1P3介导的局灶性脑缺血脑损伤主要通过小胶质细胞激活介导[22]。在本研究中,我们发现S1P3也与小胶质细胞的激活有关:使用S1P3特异性拮抗剂抑制S1P3活性,脑中活化的小胶质细胞的数量以时间和区域依赖的方式减少。此外,抑制S1P3活性降低了小胶质细胞的增殖。脑缺血组织中S1P3除了造成活化小胶质细胞数量增加外,还与活化的小胶质细胞的形态学转化密切相关。在缺血再灌注后3 d时,缺血核心区域活化的小胶质细胞大多呈阿米巴样,并主要通过释放多种促炎介质导致缺血脑神经元损伤。我们的研究表明,抑制S1P3可显著降低活化小胶质细胞向阿米巴样形态转化。
