ARHGAP12在小鼠戊四氮癫痫模型中的表达
2019-12-06唐世容
刘 华,罗 忠,唐世容
癫痫是神经系统中的常见病,而其中30%为难治性癫痫[1~3]。癫痫因其所带来的对患者个人、家庭和社会不良后果,已越来越受到公众的关注[4]。然而,癫痫的具体发生机制仍未完全明确[5]。因此,在癫痫的防治中,探索其发病机制起着举足轻重的作用。既往研究已明确神经系统兴奋和抑制的失衡与癫痫的发生密切相关,其中突触结构和功能的改变尤为关键。Rho是GTP结合蛋白的亚家族,是细胞骨架肌动蛋白的关键调控因子,在突触发育和可塑性中起着关键作用[6]。Rho GTP酶激活蛋白12(Rho GTPase-activating protein 12,ARHGAP12)为Rho家族成员之一,为了解ARHGAP12是否参与了癫痫的形成,我们进行了本研究。
1 材料与方法
1.1 材料
1.1.1 本实验采用C57BL/6清洁级(SPF)雄性成年小鼠(体重20~24 g,周龄8~10 w)。所有实验小鼠均由重庆医科大学实验动物中心供给,随机分为实验组和对照组。所有动物实验程序严格遵循动物伦理学有关要求,并获得实验动物伦理委员会批准。动物在清洁级的标准化实验环境下分笼饲养(5只/笼):按自然昼夜节律给予光照循环,温度恒定(23±1)℃,可自由摄取标准饲料和饮水(SPF级)。
1.1.2 试剂 戊四氮 (pentylenetetrazol,PTZ) (Sigma 公司);Western blot相关试剂; 兔抗ARHGAP12、兔抗GAPDH、HRP标记的山羊抗兔IgG (Proteintech 公司);免疫组化试剂盒 (博士德生物工程有限公司); 豚鼠抗MAP2(SYSY公司);小鼠抗 GFAP(Proteintech 公司);山羊抗豚鼠 Dylight633(Abcam公司);山羊抗兔AlexaFluor488、山羊抗小鼠AlexaFluor594 (碧云天公司)。
1.2 方 法
1.2.1 动物分组及造模 将小鼠随机分为PTZ 组(n=15)和对照组(n=10)。PTZ组小鼠隔天腹腔注射PTZ(35mg/kg)共15次,对照组小鼠在同一时间腹腔注射同等剂量的0.9%氯化钠溶液。PTZ注射后观察行为学30 min,采用Racine评分[7]。记录发作级别,连续3次出现III级及其以上癫痫发作的小鼠被认为模型点燃成功。腹腔注射15次后小鼠在4%水合氯醛(10 ml/kg) 麻醉下进行断头取海马备用后续实验。
1.2.2 标本的制备 用于Western blot实验的小鼠海马标本参照总蛋白提取试剂盒说明书提取各组蛋白,成功提取的蛋白储存于-80℃备用。用于免疫荧光实验的小鼠标本制备冰冻切片后储存于-20 ℃备用(片厚10 μm)。用于免疫组织化学染色实验的小鼠标本制备石蜡切片后常温储存备用(片厚5 μm)。
1.2.3 Western blot检测ARHGAP12的表达 蛋白标本上样于SDS-PAGE凝胶电泳系统,采用BIORAD仪器进行电泳和电转,成功转至PVDF膜上后用8%的脱脂奶粉常温下封闭1 h。 用兔抗ARHGAP12 (1∶1000)和兔抗GAPDH(1∶3000)一抗4 ℃孵育过夜。用TBST洗膜3次,每次10 min。次日,用HRP标记的山羊抗兔二抗(1∶3000)4 ℃孵育1 h。TBST洗膜后运用化学增强发光显色,用Fusion软件分析吸光度值,通过Prism软件对ARHGAP12/GAPDH的比值进行统计。
1.2.4 免疫组织化学染色检测ARHGAP12的表达 按照免疫组织化学染色试剂盒说明书进行染色后,用全自动显微镜在400倍下拍照,通过 ImageProPlus6.0软件分析并计算出ARHGAP12积分及光度值与面积的比值(IA/Area)。
1.2.5 免疫荧光染色检测ARHGAP12的定位 从-20 ℃冰箱取出冰冻切片,用丙酮浸泡半小时。用PBS洗3次,每次3 min。滴加0.4%Triton 37 ℃恒温箱中破膜15 min。 PBS清洗3 min×3次后,切片浸泡于柠檬酸抗原修复液中,放入微波炉中(高火3 min,低火10 min)。室温自然冷却后PBS清洗3 min×3次。 滴加抗原修复液后放入37 ℃恒温箱中修复15 min。 PBS清洗3 min×3次后,滴加山羊血清封闭液37 ℃置于恒温箱中封闭2 h。 滴加兔抗ARHGAP12 (1∶50)、豚鼠抗MAP2 (1∶200)和小鼠抗 GFAP (1∶50),4 ℃过夜。次日,37 ℃复温1 h。PBS清洗5 min×5次后,避光滴加山羊抗兔AlexaFluor488、山羊抗豚鼠 Dylight633、山羊抗小鼠AlexaFluor594混合物,37 ℃孵育1 h。PBS清洗5 min×5次后1∶1甘油封片。共聚焦显微镜采集图像。
2 结 果
2.1 动物行为学实验结果 PTZ组小鼠(n=15)隔天腹腔注射PTZ(35 mg/kg)共15次,注射后观察行为学半小时,采用Racine评分[8]。记录发作级别,连续3次出现III级及其以上癫痫发作的小鼠被认为模型点燃成功,结果点燃10只纳入PTZ组断头取海马备用后续实验,死亡2只、未点燃3只,淘汰出组。对照组小鼠(n=10)在同一时间腹腔注射同等剂量的0.9%氯化钠溶液,腹腔注射15次均无癫痫发作,无死亡,纳入对照组断头取海马备用后续实验。
2.2 Western blot检测结果 ARHGAP12在PTZ癫痫小鼠的海马组织中的表达较正常对照组显著增高,具统计学差异(见图1)。
2.3 免疫组化检测结果 ARHGAP12在PTZ癫痫小鼠的海马组织中的表达较正常对照组显著增高,具统计学差异(见图2)。
2.4 ARHGAP12 在小鼠海马组织中的表达 ARHGAP12在小鼠海马中定位于神经元细胞的胞膜,在星型胶质细胞中未见表达(见图3)。
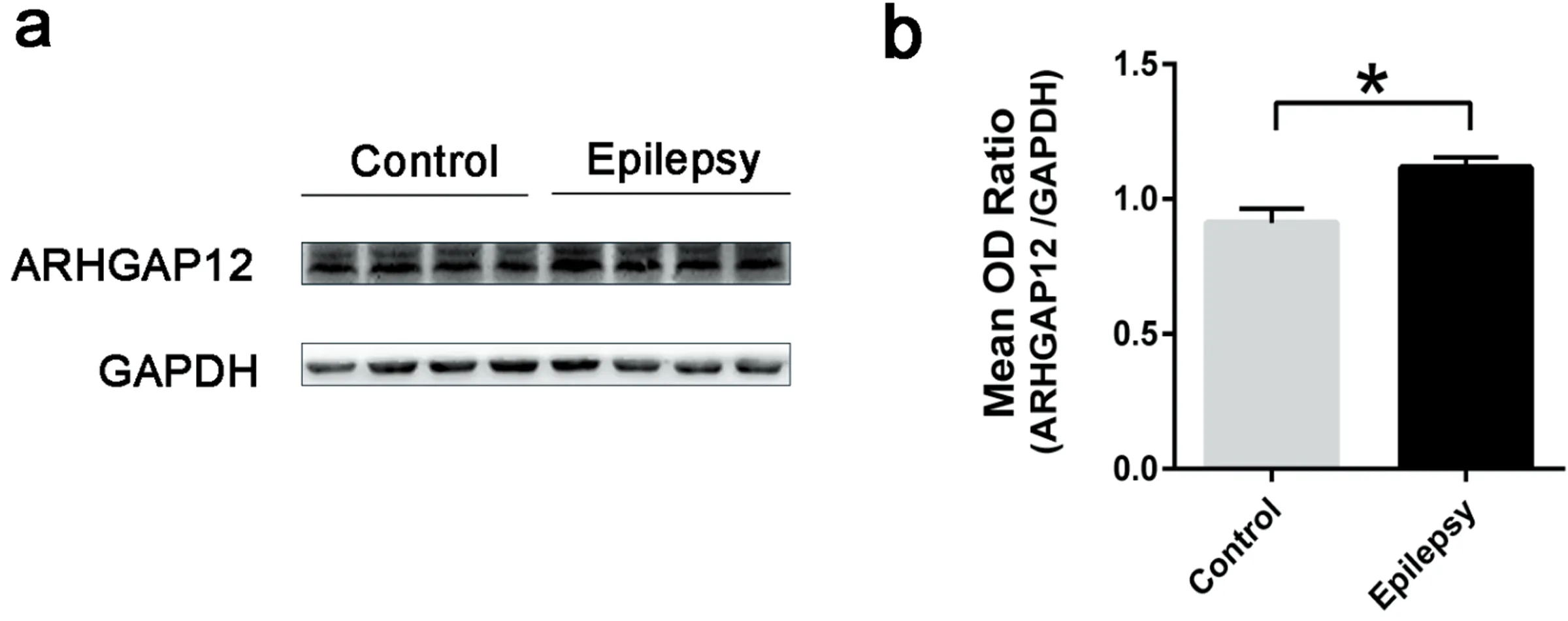
图1 ARHGAP12在小鼠海马中的表达情况。a:western blot检测在癫痫组和对照组海马中ARHGAP12的表达示意图。b:在癫痫组和对照组海马中ARHGAP12的表达统计图,ARHGAP12在癫痫小鼠的海马中较对照组显著增高(*P<0.05)
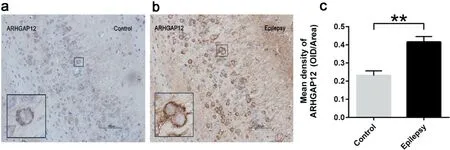
图2 ARHGAP12在小鼠海马中的表达情况。a:免疫组化检测在癫痫组和对照组海马中ARHGAP12的表达示意图。b:在癫痫组和对照组海马中ARHGAP12的表达统计图,ARHGAP12在癫痫小鼠的海马中较对照组显著增高(**P<0.01)
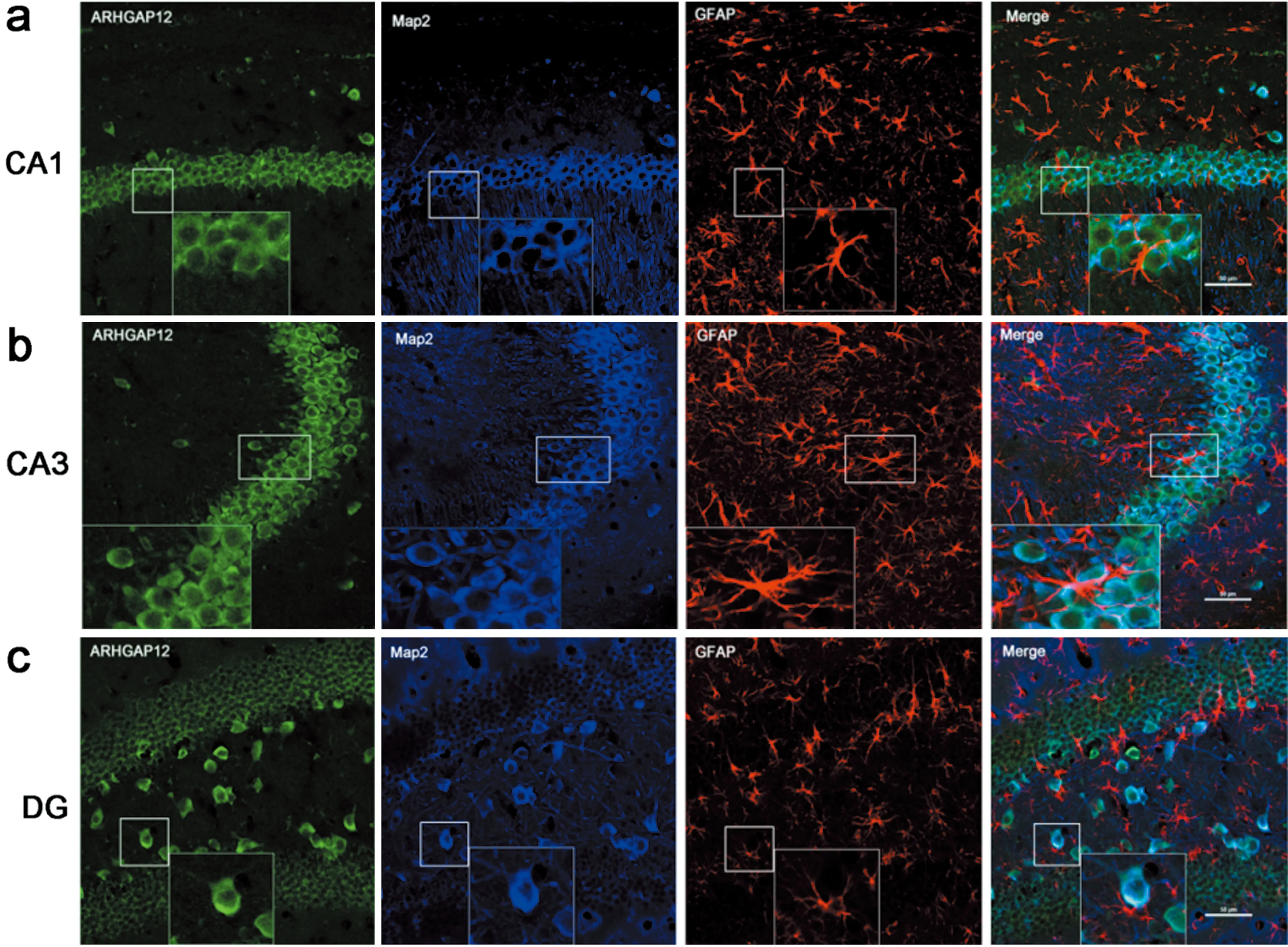
图3 ARHGAP12在小鼠海马中的定位情况。a:在小鼠海马CA1中ARHGAP12表达于神经元细胞的胞膜,在星型胶质细胞中未见表达。b:在小鼠海马CA3中ARHGAP12定位于神经元细胞的胞膜而非星型胶质细胞。c:在小鼠海马DG中ARHGAP12与神经元细胞的胞膜共表达,与星型胶质细胞中无共表达
3 讨 论
ARHGAP12是ARHGAP家族成员之一,ARHGAP家族基因编码具有Rho GAP结构域的Rho/Rac/Cdc42样GTP酶活化蛋白,其属于Ras超级小GTP酶家族,其功能是在活性GTP结合形式和无活性GDP结合形式之间循环的分子开关[9]。Rho样GTP酶参与细胞内反应,包括细胞骨架肌动蛋白的调节、细胞极性的控制、微管动力学、膜转运和转录调节[10]。作为细胞骨架肌动蛋白的关键调节剂,GTP结合蛋白的Rho亚家族在突触发育和可塑性中起关键作用,而调节突触效应的关键机制涉及树突棘的大小和数量的动态变化,以及突触膜上膜下AMPA型谷氨酸受体(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体,AMPAR)的动态变化[6]。
AMPAR是一种离子型谷氨酸受体,是包含GLUR1、GLUR2、GLUR3和GLUR4四种亚单位的四聚体[11]。AMPARs介导兴奋性信号在中枢神经系统中的快速传递,其机制主要为AMPARs与兴奋性突触后致密物PSD95结合,通过蛋白质相互作用连接其他信号分子,以及蛋白质翻译后修饰,从而增强突触后兴奋电流,介导兴奋性突触传递[12,13],在癫痫的发病机制和发展中起着重要作用[14]。AMPARs在突触膜上下移位是一个动态变化的过程,受体内吞后一部分被溶酶体吞噬降解,另一部分在内质网再组装后通过胞吐回到突触膜上,发挥其兴奋性突触传递的功能。AMPARs在突触膜上数量的改变可引起中枢神经系统兴奋性的改变[15]。
Ba等人发现ARHGAP12特异性表达于海马体CA1区,定位于突触后兴奋性突触区[16]。本研究验证了ARHGAP12定位于小鼠海马中神经元细胞的胞膜,在星型胶质细胞中未见表达。既往学者发现,ARHGAP12能够通过调节树突棘形态和AMPAR在突触膜上下的数量水平,从而协调突触效应。ARHGAP12的过度表达降低了树突棘密度和体积,而敲除ARHGAP12导致树突棘体积增加而不影响树突棘密度。在功能上,ARHGAP12水平升高显著抑制了CA3-CA1兴奋性突触,并且ARHGAP12能够主动调节兴奋性AMPAR内吞作用。一方面,ARHGAP12可调节其靶标Rac1 GTP酶的活性,并随后调节树突棘的形态。另一方面,通过与F-BAR蛋白CIP4 (Cdc42-interacting protein 4)相互作用,ARHGAP12参与内吞机制并进一步调节AMPAR内吞作用[6]。因此,ARHGAP12通过限制发育中的海马体内沉默的突触转化为功能性突触来限制突触的成熟[16]。本研究通过Western blot 和免疫组化检测均发现ARHGAP12在PTZ癫痫小鼠海马组织中较正常对照组的表达显著增高,具统计学差异。这些结果显示癫痫发病中ARHGAP12可能存在自我保护性的代偿增高,降低树突棘密度和体积,主动调节兴奋性AMPAR内吞,从而控制癫痫的发展。这可能为癫痫的发生发展机制提供了新的思路,但其具体的详细机制仍需进一步研究。
