利用浓差电池镀铜的实验探究
2019-12-05李桂林李国兴陆艳
李桂林 李国兴 陆艳

摘要: 若电池中总的过程仅仅是一种物质(包括单质或离子)从高浓度状态向低浓度状态转移,这类电池称为浓差电池。本实验利用铜与硝酸铜制作的浓差电池来镀铜,并自制教具利用DIS探头测量该浓差电池的电流与电压,探究不同的浓度比与电流和电压的关系。
关键词: 浓差电池; 镀铜; DIS探头实验; 实验探究
文章编号: 1005-6629(2019)11-0061-03 中图分类号: G633.8 文献标识码: B
化学电源是将化学能转变为电能的装置,是高等学校本科生《物理化学》课程电化学的重要内容之一。化学电源已经进入人们的日常生活,因此学生能够亲身体会到化学电源的重要性。化学电源主要包括一次电池和二次电池。一次电池是指电池中的电化学反应只能进行一次放电反应,而不能进行充电。二次电池即蓄电池,指的是电池中的电化学反应能够进行可逆的充放电反应,而且充放电过程可以进行多次,即电池具有较长的寿命[1]。
若电池中总的过程仅仅是一种物质(包括单质或离子)从高浓度状态向低浓度状态转移,这类电池我们称之为浓差电池。简而言之,浓差电池之所以能够对外输出电能是由于电池体系中存在物质的浓度梯度。浓差电池可以分为两类,即电极浓差电池和电解质浓差电池。电极浓差电池指的是由于电极本身活性物质浓度的差别而引起的电势差,这种浓差电池中只包含一种电解质溶液;电解质浓差电池指的是由于电池中电解质浓度的差异所引起的电极电势的差异,这种浓差电池中包含至少两种不同浓度的电解质溶液,而且电极电势的大小与电解质溶液的浓度有关[2, 3]。
1 硝酸铜的浓差电池镀铜
1.1 实验用品
铜棒、硝酸铜(AR)、试管、橡皮塞、烧杯、玻璃棒、容量瓶、电子天平、长颈漏斗、滴管、容量瓶
1.2 制作硝酸铜的浓差电池的步骤
(1) 先配制两种不同浓度的硝酸铜溶液。一种是浓度较大,为1mol/L的硝酸铜溶液;另一种浓度较稀,为0.25mol/L的硝酸铜溶液。注意,在配制硝酸铜溶液时再加入2~3滴浓硝酸防止水解。
(2) 取一支试管(容积为70~80毫升),配上一个橡皮塞或软木塞,塞子的中央钻一个细孔,再在孔内插入一根粗铜丝(可用刮掉漆膜的铜质漆包线代替)。铜丝要稍粗一点,太细了在溶液中立不起来。
(3) 在试管中先装入20毫升0.25mol/L硝酸铜溶液,然后,用长颈漏斗往溶液底部加入20毫升1mol/L硝酸铜溶液。实验成败关键: 切勿使这两种浓度不同的溶液混合起来。浓的硝酸銅溶液密度大,下沉在试管的下半部;稀的硝酸铜溶液密度小,在试管的上半部,我们应该能够清楚地看到它们之间有明显的分界面。
(4) 把带有塞子的粗铜丝小心地插到试管中。注意动作要轻而慢,不要把两种浓度不同的硝酸铜溶液搅混起来。
(5) 片刻后观察两层溶液中的铜丝表面的颜色变化。
1.3 实验原理
该浓差电池因电解质硝酸铜溶液浓度不同而形成,属于电解质浓差电池,两极硝酸铜浓度的差异所引起的电极电势的差异,负极和正极都是由同一种金属(铜丝)做成的,而且铜丝还代替导线,起着传导电流的作用。总的电极方程式为:
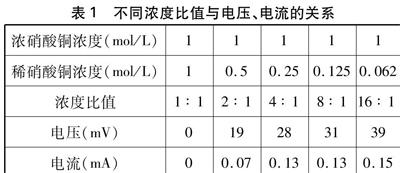
(-)Cu|CuSO4(c1)||CuSO4(c2)|Cu(+), c1 Cu2+浓度较大端则该电极的电极电势高,在电池中做正极,Cu2+浓度较小端则该电极的电极电势低,在电池中做负极。即上面的铜丝是负极,电子从它流出,负极上的金属铜失去电子,变成铜离子溶解在溶液中: CuCu2++2e。电子经过铜丝流入下面的正极(它也是铜丝),附近溶液中的铜离子得到电子,并在正极上沉积为金属铜: Cu2++2eCu。从正极和负极的半反应看来,负极的铜在减少,正极有铜析出。 1.4 实验结果 实验结束,把铜丝从溶液中取出,用水冲洗后,现象更为清晰可见了: 有一段铜丝在原来铜的表面镀上了一层新铜。在整个实验过程中,根据两极的方程式,从结果来看,只是上面的铜转移到下面了。硝酸铜的质量不发生任何改变。所以,我们可以制作一个铜和硝酸铜的浓差电池,并且可以利用这个浓差电池“零能耗”镀铜。浓差电池之所以能够对外输出电能是由于电池体系中存在物质的浓度梯度[4]。 2 利用DIS实验测铜-硝酸铜浓差电池的电流和电压 2.1 实验用品 带盖塑料试管一支、热熔胶棒、打火机、铜棒、硫酸铜(AR)、试管、橡皮塞、烧杯、玻璃棒、容量瓶、电子天平、长颈漏斗、滴管 2.2 利用微电流传感器和电压传感器测量电流和电压 为了证明前面我们制作的是浓差电池,最好的办法是测量该电池的电流或者电压。电池的浓溶液端的铜为正极,电池稀溶液端的铜为负极。笔者自制了一个仪器: 在一个塑料试管的下端钻一个洞,把铜棒穿过洞口并用棒胶密封好。再在塑料试管的盖子上打一个洞。试管下面加入较浓的硝酸铜溶液,上面加入较稀的硝酸铜溶液。按图1所示连接好微电流传感器,调零,测量该浓 图1 自制的浓差电池测定电流 图2 自制的浓差电池测定电压 差电池的电流。若把微电流传感器改为电压传感器(如图2所示),可以测量该浓差电池的电压。 2.3 不同浓度比的电流与电压 按2.2实验装置连接好,改变浓硝酸铜或稀硝酸铜溶液的浓度,从而改变其浓度比值,测量不同浓度比值时的电流与电压。如表1所示,得出不同浓度比值与电池电压及电流的关系。 表1 不同浓度比值与电压、电流的关系 浓硝酸铜浓度(mol/L)11111 稀硝酸铜浓度(mol/L)10.50.250.1250.062 浓度比值1∶12∶14∶18∶116∶1 电压(mV)019283139 电流(mA)00.070.130.130.15 3 探讨几个问题 如果把硝酸铜溶液换成硫酸铜溶液或氯化铜溶液会有什么现象呢?按同样的步骤和方法进行上述实验。铜放在浓、稀不同的硫酸铜溶液中进行实验,溶液无变化,铜丝上无法镀上新铜。铜放在浓、稀不同的氯化铜溶液中进行实验,铜会和浓的氯化铜反应生成氯化亚铜,铜丝上也无法镀上新铜。其中的原因有待今后进一步的探究。 4 展望 通过浓差电池镀铜的小实验,对浓差电池的应用进行了探索,可在中学生化学实验课上进行展示,有利于激发学生对浓差电池的研究兴趣。 能源是关系到人类社会發展的最主要问题之一。目前全球大部分的能量需求来源于化石燃料。由于化石燃料具有不可再生性,最终必将导致其枯竭。而且化石燃料的大量使用也将会导致严重的环境污染。因此,有关新型化学电源的研究越来越受到人们的重视。浓差电池这一古老的原型器件也被推向了研究前沿。普遍的观点认 为,自然界中存在大量的浓度梯度。如在黄河、长江及其他河流的入海口就存在海水与淡水之间的盐(如氯化钠等)的浓度梯度。如果能够将这些储存在浓度梯度里的化学能转换为电能,就能够为人类社会提供大量的能源。美国和以色列等国家非常重视浓差电池的研究。中国、瑞典和日本等也开展了一些研究。总体上,有关浓差电池的研究仍还处于实验阶段,离大规模应用还有漫长的路程[5,6]。 参考文献: [1]傅献彩, 沈文霞, 姚天扬, 侯文华. 物理化学(下册)(第五版)[M]. 北京: 高等教育出版社, 2006. [2][4]刘兆阅. 化学中浓差电池的概念及器件化[J]. 教育教学论坛, 2016, 4(15): 164~166. [3][5]徐卫, 赵琦. 微型氧浓差电池的制作与分析[J]. 化学教学, 2013, (12): 54~55. [6]诸佳丹, 丁伟. 原电池法探究金属铝在浓硝酸中的钝化行为[J]. 化学教学, 2017, (9): 59~60.
