猪源生物被膜乳酸菌的筛选、鉴定与体外益生特性评价
2019-12-05靳胜男舒慧萍张冬星康元环单晓枫钱爱东
靳胜男,舒慧萍,张冬星,康元环,单晓枫,钱爱东
(吉林农业大学 动物科学技术学院,吉林 长春 130118)
随着我国养猪业集约化、规模化的空前发展,细菌性疾病的频繁发生使抗生素得到了广泛使用,长期使用或滥用抗生素会增强动物机体内细菌的耐药性,并造成畜产品中药物的残留,影响养猪业的生产发展和人类健康。益生菌通常被定义为活性微生物,具有抑制病原体生长和防止定植、抑制毒力因子表达、增强上皮细胞功能、调节宿主免疫应答等益生特性[1-2]。益生菌替代抗生素应用于猪生产中,可提高猪的生长性能,降低猪的腹泻率和死亡率[3-4]。乳酸菌(Lactic acid bacteria,LAB)是最常见的用于猪的益生菌,包括乳酸杆菌、肠球菌、芽孢杆菌等[5]。乳酸菌产生的过氧化氢、抗菌因子和细菌素,对调节宿主肠道中微生物种群和预防传染性疾病具有一定的作用[6]。因此,乳酸菌作为益生菌替代抗生素的研究成为当下研究的重点。
大多数的乳酸菌抗菌试验研究是在其处于浮游状态下进行的。然而,有研究表明,与浮游态乳酸菌相比,生物被膜态乳酸菌具有较强的抗菌特性和耐热、耐酸能力[7]。细菌生物被膜是嵌在胞外聚合物中的附着在菌体表面的微生物群落,生物被膜的形成有利于细菌在恶劣环境中生存,增强细菌对各种不利因素的抵抗力,使机体具有较强的免疫力[8]。因此,筛选生物被膜型的益生性乳酸菌受到越来越多的关注。但是,当前猪用乳酸菌部分来源于体外环境,由于菌株生存的环境条件发生变化,环境之间的差异导致其应用效果不佳,无法充分发挥其益生作用。有学者认为,理想的动物用乳酸菌最好从同源动物自身消化道中分离筛选[9-10]。鉴于此,通过形态学观察和分子生物学鉴定,从猪新鲜粪便中筛选抑菌效果较好且生物被膜形成能力强的乳酸菌,并对其产酸能力、耐酸碱性、耐胰蛋白酶性、细胞黏附性、生长活性以及安全性等益生特性进行评价,以筛选出具有良好生物学特性的乳酸菌分离菌株,为猪用益生菌替代抗生素提供参考。
1 材料和方法
1.1 供试菌株
鼠李糖乳杆菌(Lactobacillusrhamnosus,53103);指示菌:猪源大肠杆菌(Escherichiacoli,K88、233、236)、鼠伤寒沙门氏菌(Salmonellatyphimurium,79102、503、3383、3780、3775)和金黄色葡萄球菌(Staphylococcusaureus,519)均由吉林农业大学动物科学技术学院预防兽医实验室保存。
1.2 试验试剂
MRS琼脂、MRS肉汤培养基、胰蛋白酶均购自北京索莱宝科技有限公司,细菌基因组DNA提取试剂盒购自康为试剂股份有限公司,细胞裂解液购自上海远慕生物科技有限公司,其他常用试剂均为分析纯。
1.3 供试动物和细胞
20只体质量约为(18.0±1.0)g的4周龄健康雌性昆明鼠,购自长春市实验动物中心。猪小肠上皮细胞(IPEC-J2)由吉林农业大学动物科学技术学院预防兽医学实验室保存。
1.4 样品采集和菌株的分离纯化
健康猪新鲜粪便样品采自吉林长春某养猪场。参照《伯杰细菌鉴定手册》中的方法进行分离纯化,将0.5 g样品用PBS缓冲液进行倍比稀释,取100 μL适当梯度的样品在MRS固体培养基上均匀涂布,37 ℃下厌氧培养48 h。挑取单菌落划线于MRS平板,获得纯化的菌株,并于甘油中-80 ℃保存。
1.5 革兰氏染色及触酶试验
取少量的纯化培养的菌液涂匀至干净的载玻片上,待干燥、固定后进行革兰氏染色。在载玻片上,滴加50 μL筛选得到的革兰氏阳性菌菌液,并加入少量的过氧化氢溶液,获得无气泡产生的过氧化氢酶阴性菌。
1.6 抑菌试验
采用牛津杯法进行抑菌试验[11]。先取200 μL 107cfu/mL指示菌,分别均匀涂布于固体琼脂平板表面,在培养基上的牛津杯中放入200 μL过滤的待测菌株上清液,培养12 h,测量抑菌圈直径。试验重复3次。
1.7 生物被膜形成能力测定
将上述抑菌效果较好的分离菌株参考并适当改进STEPANOVIC等[12]的96孔板法进行生物被膜检测。按照1%比例将待测菌液接入MRS液体培养基, 37 ℃培养36 h,并将菌液浓度调整至108cfu/mL;将菌液与MRS液体培养基按体积比2∶18以每孔200 μL的量加入96孔细胞培养板中,阴性对照组接入同体积的PBS缓冲液,培养24 h后弃去孔中培养液,用200 μL无菌PBS缓冲液洗涤2次,去除浮游菌,而后加入200 μL 99%的甲醇室温固定20 min,弃去甲醇,室温干燥10 min;加入200 μL 0.1%的结晶紫染液染色10 min,再用同体积无菌PBS洗涤3次,室温干燥20 min,用33%的乙酸溶液室温脱色5 min,全自动酶标仪检测595 nm波长处的吸光值,试验重复3次。
1.8 分离菌株分子生物学鉴定
将筛选出的生物被膜形成能力强的菌株按照细菌DNA提取试剂盒操作说明提取基因组DNA,以基因组DNA为模版,用16S rDNA通用引物(表1)进行PCR扩增。琼脂糖凝胶电泳检测PCR产物,并将PCR产物送至吉林省库美生物科技有限公司进行测序。获得的测序序列与GenBank数据库中的相关序列进行多重比对,采用Mega 7.0 软件中的邻接法构建系统进化树[13]。
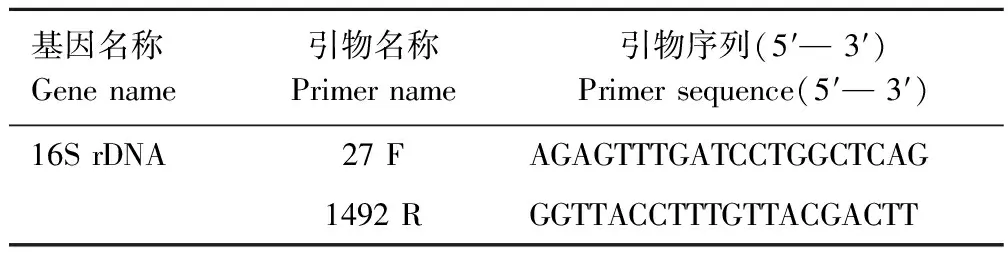
表1 16S rDNA引物序列
1.9 分离菌株产酸能力测定
将分离菌株按1%比例接入MRS液体培养基,37 ℃培养48 h后,取2 mL菌液于EP管中,5 000 r/min离心10 min,吸取上清液,用pH计测量乳酸菌上清液的pH值并记录,以MRS液体培养基的初始pH值(6.8)作为对照值,试验重复3次。
1.10 分离菌株耐酸、碱性能测定
将分离菌株接种于MRS液体培养基中培养48 h,取1 mL菌液6 000 r/min离心10 min,弃上清,用PBS重悬菌体,并将悬液接入10 mL pH值分别为2.0、4.0、6.0、6.8(阴性对照)、8.0、10.0的MRS肉汤培养基中,培养0、1、2、3、4 h,进行菌落平板计数,重复3次。
1.11 分离菌株耐胰蛋白酶性能测定
将新培养的分离菌株接种至含1%胰蛋白酶的MRS肉汤培养基中,阴性对照组接种同体积的不含胰蛋白酶的MRS肉汤培养基,培养4 h,每间隔1 h进行菌落平板计数,重复3次。
1.12 乳酸菌生长曲线测定
按1%的接种比例将分离菌株菌液接入100 mL MRS肉汤培养基中,培养24 h,每间隔2 h测定OD600,重复3次,绘制该分离菌株的生长曲线。
1.13 细胞黏附性测定
参照文献[14]对分离菌株进行细胞黏附性检测。取1 mL密度为1×105个/mL的IPEC-J2细胞于细胞6孔板中,放置5% CO2、37 ℃细胞培养箱中培养24 h,弃掉培养基,用RPMI-1640细胞培养基轻轻清洗细胞2次,再加入1 mL细胞培养基,同时加入1 mL 1×107cfu/mL分离菌株和鼠李糖乳杆菌(阳性对照),相同条件下培养1 h,再用细胞培养基轻轻洗涤3次,加入1 mL 1%的Triton X-100细胞裂解液于室温下裂解30 min,10倍倍比稀释,进行菌落平板计数,计算黏附率:黏附率=(终菌落数/初始感染细菌数)×100%。
1.14 小鼠致病性试验
将分离菌株菌液含量调整为1×107、1×108和1×109cfu/mL,并分别取200 μL梯度菌液浓度,腹腔注射试验组小鼠(200 μL/只),每组5只小鼠,同时设置对照组,即腹腔注射等量PBS缓冲液,连续观察14 d,记录小鼠死亡数量。
1.15 数据分析
试验数据采用SPSS 20.0软件进行分析处理,利用Graph Prism 5.0软件绘制图片。
2 结果与分析
2.1 分离菌株的分离纯化及革兰氏染色
分离纯化出2株疑似乳酸菌菌株,在MRS固体培养基上形成表面光滑、圆形、边缘整齐的乳白色菌落(图1 A)。革兰氏染色镜检可见,菌体形态多呈杆状或短杆状,无芽孢,无荚膜(图1B)。
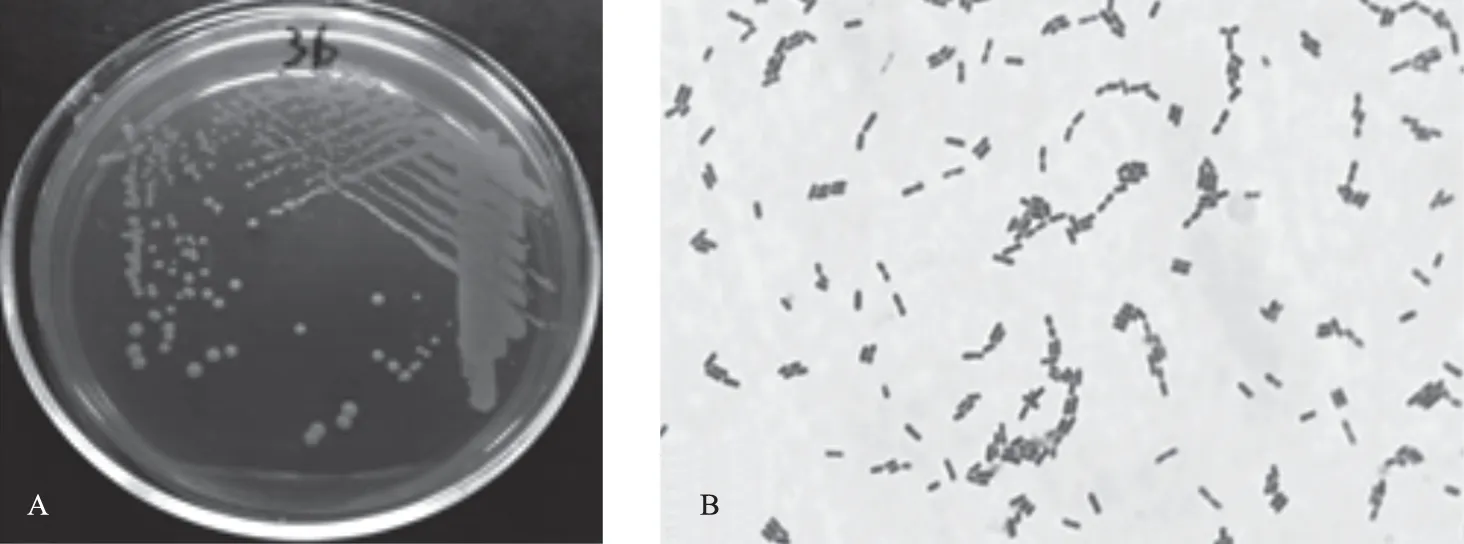
图1 分离菌株菌落形态(A)及革兰染色结果(B)
2.2 分离菌株的触酶试验
过氧化氢酶试验结果显示,2株疑似乳酸菌菌株中均没有气泡产生。表明这2株分离菌株均为革兰氏阳性、过氧化氢酶阴性菌,分别命名为L-3、L-8。
2.3 分离菌株的抑菌试验
如表2所示,分离菌株L-3、L-8对金黄色葡萄球菌、大肠杆菌和沙门氏菌的生长抑制效果较好,表明分离菌株L-3、L-8均具有良好的抑菌作用。
注:抑菌圈直径(包含牛津杯直径7.80 mm)+:8.00~12.00 mm;++:12.00~16.00 mm;+++:16.00~20.00 mm;++++:20.00~24.00 mm。
Note:Inhibition zone diameter (including Oxford Cup diameter 7.80 mm)+: 8.00—12.00 mm; ++: 12.00—16.00 mm; +++: 16.00—20.00 mm; ++++: 20.00—4.00 mm.
2.4 分离菌株的生物被膜形成能力
如图2所示,分离菌株L-8的OD595极显著大于阴性对照组(P<0.01),而分离菌株L-3在595 nm下的吸光值与对照组相比差异不显著。可见,与分离菌株L-3相比,L-8的生物被膜形成能力较强。
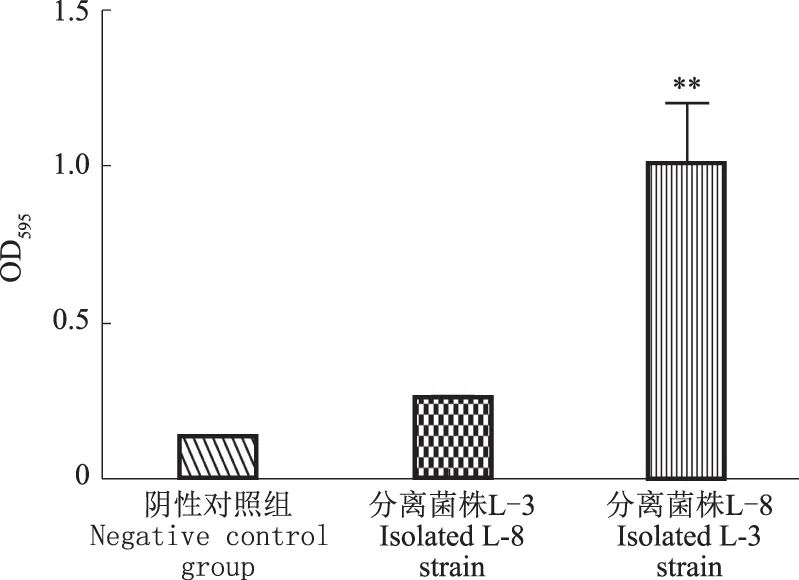
**表示与对照组相比差异极显著(P<0.01),下同
2.5 分离菌株L-8的分子生物学鉴定
如图 3所示,分离菌株L-8的16S rDNA 经PCR扩增后获得与预期大小相同的片段(1 500 bp),将获得的序列进行BLAST比对发现,分离菌株L-8与约氏乳杆菌(Lactobacillusjohnsonii)的同源性达到99.93%。从系统发育树可以看出,分离菌株L-8与约氏乳杆菌处于同一分支(图4),进一步确定该分离菌株为约氏乳杆菌。
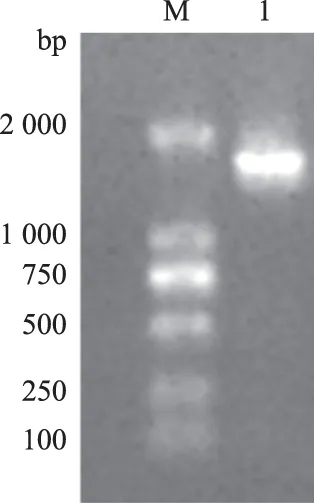
M:DL2000 DNA Marker;1:分离菌株L-8
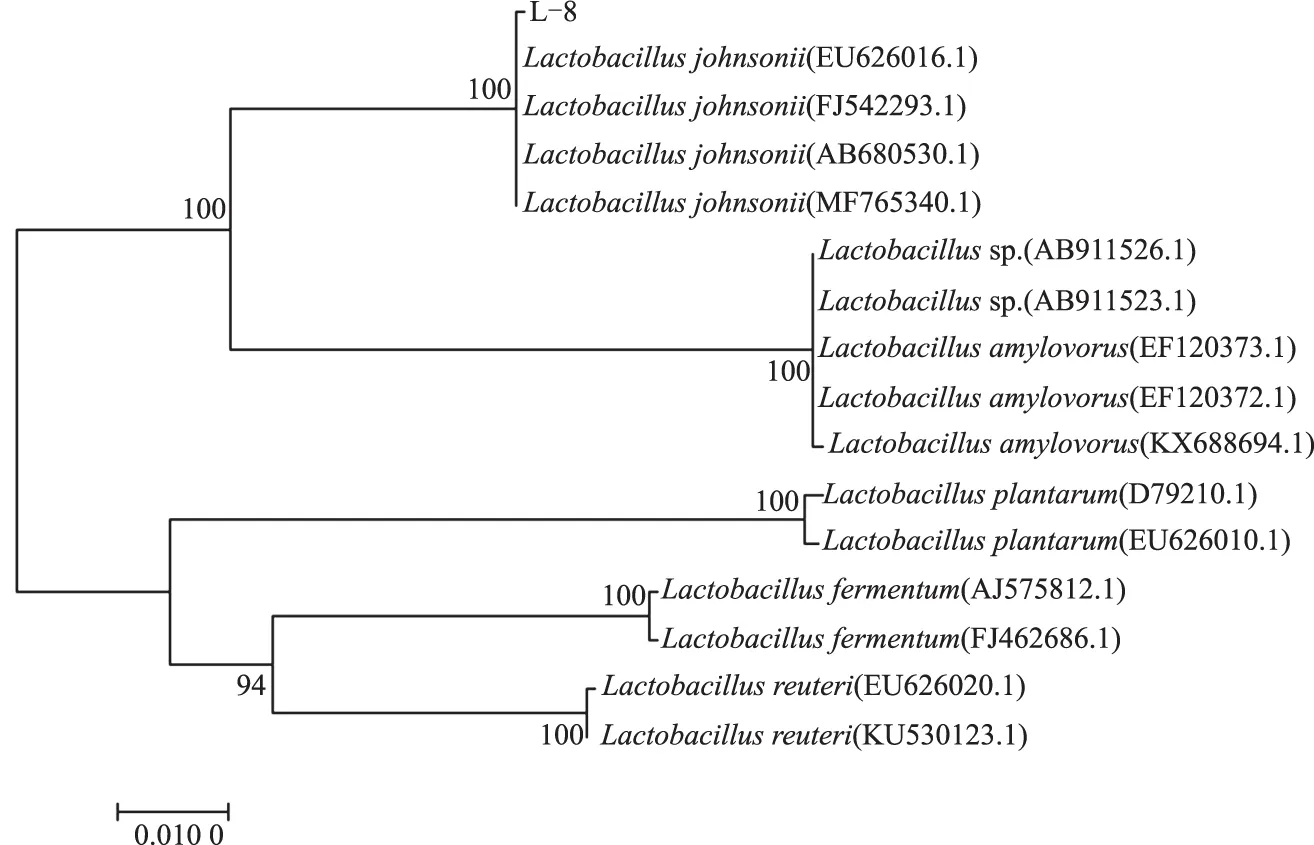
图4 分离菌株L-8系统发育树
2.6 分离菌株L-8产酸能力
如图5所示,分离菌株L-8在MRS液体培养基中培养48 h后其上清液的pH值为(4.21±0.02),与对照组相比差异极显著(P<0.01)。表明分离菌株L-8具有一定的产酸能力。

图5 分离菌株L-8产酸试验结果
2.7 分离菌株L-8酸、碱耐受性分析
如图6所示,分离菌株L-8在pH 值2.0条件下,随着培养时间的延长,其活菌数有所降低,可见分离菌株L-8不能长时间耐受pH 2.0酸性环境,但在pH值为4.0、6.0、8.0、10.0作用下,随着培养时间的延长,分离菌株L-8菌液中活菌数均无下降趋势,表明分离菌株L-8能够耐受pH值4.0~10.0的环境。
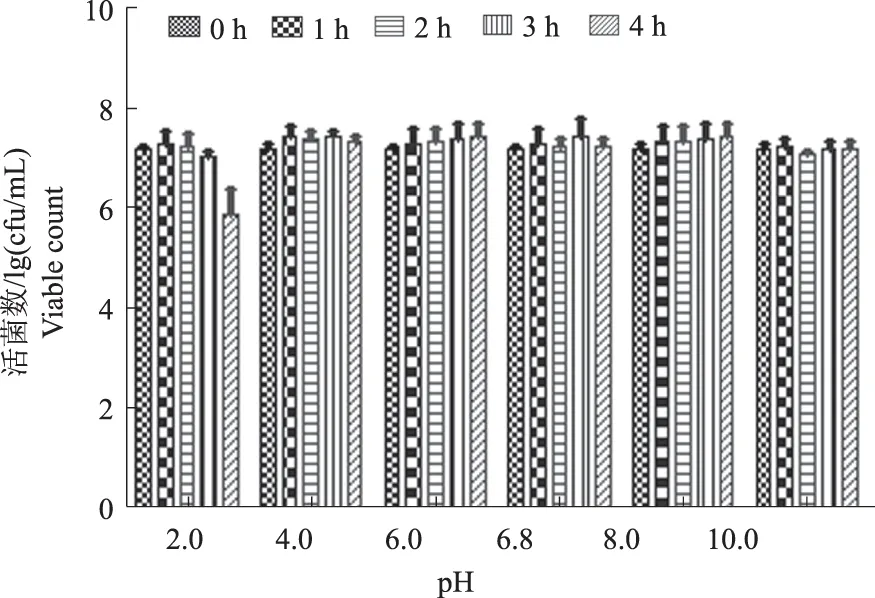
图6 分离菌株L-8酸、碱耐受性试验结果
2.8 分离菌株L-8胰蛋白酶耐受性分析
如图7所示,分离菌株L-8在含1%胰蛋白酶的MRS培养基中作用0~4 h后,其活菌数与对照组相比无明显下降趋势,表明分离菌株L-8菌株对1%胰蛋白酶环境具有耐受性。
2.9 分离菌株L-8生长曲线
如图8所示,分离菌株L-8在接种6 h后快速生长进入对数生长期,直到14 h后其生长速度基本稳定。
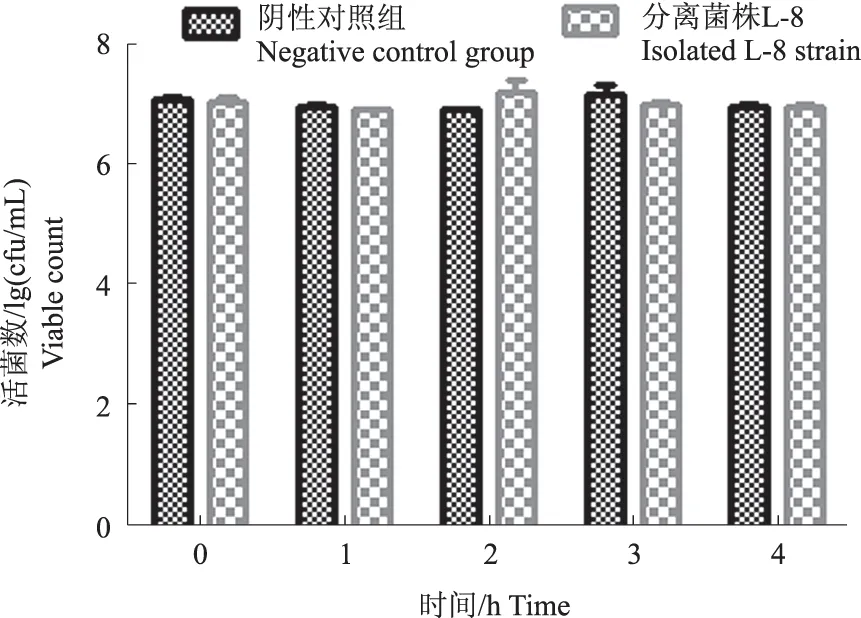
图7 分离菌株L-8胰蛋白酶耐受性试验结果
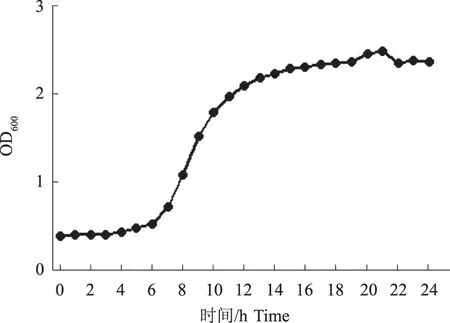
图8 分离菌株 L-8的生长曲线
2.10 分离菌株L-8细胞黏附性分析
如图9所示,分离菌株L-8对IPEC-J2细胞的黏附率为78.86%,显著高于阳性对照组(P<0.05),表明分离菌株L-8对猪小肠上皮IPEC-J2细胞具有一定的黏附能力。
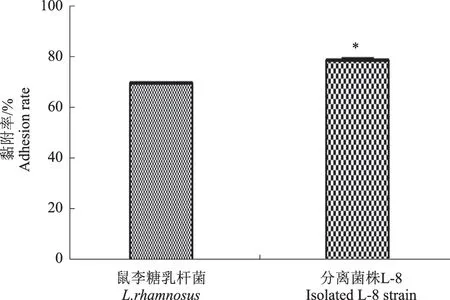
*表示与对照组相比差异显著(P<0.05)*indicates significant differences compared with the control(P<0.05)
2.11 分离菌株L-8小鼠致病性试验
小鼠致病性试验结果显示,在3个梯度攻毒的试验组和PBS 对照组中均未发现小鼠死亡,表明分离菌株L-8对小鼠没有致病性。
3 结论与讨论
近年来,微生态制剂作为抗生素的代替品应用于畜牧生产养殖过程中,取得了显著的益生作用。乳酸菌作为重要的益生菌,又是动物机体中的优势菌,被广泛应用于饲料添加剂的生产中。乳酸菌制剂经饲喂进入动物体内,需耐受胃酸、消化酶的作用,具有一定黏附性、良好的生长活性以及对宿主安全无毒性,才能够定植于动物机体中,从而更好地发挥益生作用。此外,研究表明,益生菌的候选细菌菌株应来源于目标物种,宿主胃肠道微生物菌群中的异种菌株几乎不可能永久存在[15]。因此,本试验以健康猪的粪便为样本,筛选出了L-3和L-8共2株乳酸菌分离菌株。胃肠道感染是造成养猪场重大经济损失的原因之一,乳酸菌的抑菌效果是其发挥对疾病的预防和治疗作用的关键。L-3、L-8分离菌株的抑菌试验结果显示,这2个菌株可抑制金黄色葡萄球菌、猪源大肠杆菌等的生长,具有较好抑菌效果。刘文华等[16]研究表明,乳酸菌对大肠杆菌和金黄色葡萄球菌具有抑制作用且抑菌圈直径分别为 16 mm和14mm,与本试验结果类似。史国萃等[17]报道称,相比于浮游态的菌株,被膜态乳酸菌具有较强的抗逆能力。故本试验进一步对分离菌株L-3和L-8的生物被膜进行了检测,成功筛选得到具有生物被膜形成能力较强的分离菌株L-8,而后经分子生物学鉴定为约氏乳杆菌。
乳酸菌是来自猪肠道样本中最主要的菌属之一[18]。乳酸菌在生长过程中会分泌有机酸,降低了肠道pH值,有益于在肠道的酸性环境中存活[19]。可见,乳酸菌的产酸能力是耐酸和发挥抑菌作用的重要前提。MISSOTTEN等[20]筛选出的3株乳酸菌的发酵液pH值在4.2~4.4,与本试验结果pH 值4.21~4.23相似,且与初始培养基pH值相比差异显著。表明本试验筛选的乳酸菌分离菌株L-8的产酸性能相对良好。酸碱度是影响细菌生长的重要因素,作为益生菌,乳酸菌要对胃内的强酸性环境具有一定耐受性。本试验中,分离菌株L-8能够耐受pH 值4.0~10.0的酸碱环境,并经人工胃液pH值2.0处理4 h后,分离菌株的活菌数虽然降低但依然维持在105cfu/mL;由于动物的消化特性,任何食物均不会在胃中停留较长时间[21],故该分离菌株也可以顺利通过胃部到达肠道,在猪肠道中发挥其益生作用。由于初生仔猪的胰腺和肠腺发育完全且能够分泌胰蛋白酶等消化酶,乳酸菌要顺利进入动物肠道定植和存活,也需具有对胰蛋白酶的耐受能力。分离菌株L-8在1%胰蛋白酶作用下,细菌存活数均无变化,表明该分离菌株有抵抗胰蛋白酶的能力,可在肠道中定植生存。
作为益生菌候选菌株,其生长速度也应是筛选条件之一。王蔚森等[22]报道,乳酸菌最早可在培养8 h后达到对数期。本试验结果显示,分离菌株L-8在培养6 h后达到对数期,并持续约8 h,表明该菌株生长能力良好。乳酸菌黏附和定植于动物肠道是其发挥益生作用的首要条件[6],分离菌株L-8对猪小肠上皮细胞的黏附试验结果显示,分离菌株L-8的黏附性能较好。刘蕾等[23]研究发现,形成生物膜的植物乳杆菌L-ZS9的黏附率较浮游态细菌高1.5倍,该研究结果与本试验结果类似。饲用微生态制剂的菌种除具备良好的潜在的益生作用外,还需对动物机体安全、无毒性。本试验对小鼠致病性结果显示,约氏乳杆菌L-8对小鼠无致病、致死现象,具有一定安全性,表明分离菌株L-8可作为用于猪生产中的优良益生菌。
