狗枣猕猴桃AkSAP蛋白的生物信息学分析
2019-12-05李然红王立凤
刘 丹,李然红,陈 鑫,王立凤
(牡丹江师范学院,黑龙江 牡丹江 157012)
狗枣猕猴桃[Actinidiakolomikta(Maxim.et Rupr.)Maxim.],别名狗枣子,大型落叶藤本植物,主要分布于我国东北、四川、河北、云南等地。狗枣猕猴桃是最为耐寒的猕猴桃品种之一,作为抗寒育种资源,在生长发育过程中叶片颜色会发生动态变化,形成白、粉、浅红和浅绿的斑状彩叶,其果实柔软多汁、酸甜可口、富含维生素C,是一种药食观赏兼用植物[1-3]。胁迫相关蛋白(Stress associated proteins,SAP)是锌指蛋白中参与植物胁迫调控的一类蛋白,是植物体在非生物胁迫应答中大量表达的一种重要蛋白,在植物免疫及胁迫应答中起重要作用[4-5]。SAP是锌指结构蛋白中的一员,含有典型的CCCH型结构。SAP首次在水稻中被发现,随后在高粱、拟南芥、番茄、毛果杨、玉米等高等植物中被发现并研究。研究表明,水稻中的SAP基因受非生物胁迫诱导,超表达时能显著提高转基因植株对低温、高温及干旱的抗性[6]。AtSAP5在拟南芥中超表达能够提高植株对高盐和渗透胁迫的抗性[7],同时AtSAP10表达量的增加对重金属胁迫的抗性影响明显[8]。对小麦SAP基因启动子的分析发现,其具有组织特异性及多种诱导表达特性,在胁迫早期发挥作用[9]。此外,过表达SAP基因烟草植株对病原菌侵染的抵抗能力也有所提高[10]。以狗枣猕猴桃转录组数据为参考,筛选到锌指蛋白(AkSAP)的cDNA序列,利用生物信息学方法对其编码蛋白的理化性质、疏水性/亲水性、蛋白结构功能域、二级结构、三级结构、蛋白质修饰位点及同源性等方面进行预测和分析,以期为狗枣猕猴桃AkSAP功能研究提供参考。
1 材料和方法
1.1 材料来源
狗枣猕猴桃AkSAP基因cDNA序列从牡丹江师范学院植物遗传育种实验室转录组数据中获得,中华猕猴桃变种(PSS30759.1Actinidiachinensisvar.chinensis)、茶树(XP_028055510.1Camelliasinensis)、葡萄(XP_010646914.1Vitisvinifera)、麻疯树(XP_012079197.1Jatrophacurcas)、欧洲栓皮栎(XP_023921012.1Quercussuber)、欧洲橄榄(XP_022858348.1Oleaeuropaeavar.sylvestris)、毛桃(XP_007204485.2Prunuspersica)、蓖麻(XP_002522314.2Ricinuscommunis)、橡胶树(XP_021669412.1Heveabrasiliensis)、木薯(XP_021631338.1Manihotesculenta)、野李变种(PQQ18171.1Prunusyedoensisvar.nudiflora)、梅花(XP_016651631.1Prunusmume)、樱桃(XP_021825074.1Prunusavium)、牵牛花(XP_019195606.1Ipomoeanil)、菟丝子(RAL40770.1Cuscutaaustralis)、白梨(XP_009366811.1Pyrus×bretschneideri)、马铃薯(XP_006338214.1Solanumtuberosum)等17种植物氨基酸序列在NCBI数据库中下载。
1.2 方法
狗枣猕猴桃AkSAP的理化性质用ProtParam(https://web.expasy.org/cgi-bin/protparam/protparam)进行分析;采用NCBI-CDD预测保守结构域及蛋白家族(https://www.ncbi.nlm.nih.gov/Structure/cdd/);采用Inter-ProtScan(http://www.ebi.ac.uk/interpro/search/sequence-search)及SMART(http://smart.embl-heidelberg.de/)预测功能位点;采用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白磷酸化位点;采用NetNGlyc 1.1 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)预测N-糖基化位点;采用NetOGlyc 4.0 server(http://www.cbs.dtu.dk/services/NetOGlyc/)预测O-糖基化位点;采用 SOPMA及PredictProtein 数据库(https://www.predictprotein.org/)预测二级结构及蛋白质修饰位点;采用SWISS-MODEL(http://swissmodel.Expasy.org/)在线软件预测蛋白质三级结构。从NCBI(https://www.ncbi.nlm.nih.gov/)数据库中获得17条不同植物的SAP氨基酸序列信息,利用MEGA5.1软件的Neighbor-joining法构建蛋白质系统进化树。
2 结果与分析
2.1 AkSAP蛋白理化性质预测
利用ProtParam软件对AkSAP氨基酸序列进行分析,结果表明,AkSAP基因cDNA全长2 089 bp,编码区(CDS)为cDNA上第283—1 731个碱基,共编码477个氨基酸,分子质量为53 919.46 u,理论等电点为9.36,负电荷残基总数(Asp+Glu)为57,正电荷残基总数(Arg+Lys)为74,分子式为C2 337H3 697N709O726S18,总原子数为7 487,不稳定指数(Instability index,Ⅱ)为60.98,脂肪系数(Aliphatic index)为55.64,亲水性(GRAVY)的平均水平为-1.035。该蛋白中含量最多的为丝氨酸,占9.4%,其次为赖氨酸和脯氨酸,分别占8.8%和7.5%,含量最少的为色氨酸,为0.6%,吡咯赖氨酸及硒半胱氨酸含量均为0(图1)。通过ProtScale软件分析预测,该蛋白的整个肽链中均含有亲水性和疏水性氨基酸,得分最大值为2.167,在205个氨基酸处,最小值为-3.200,在第59—62个氨基酸处,从整体分布看(图2),氨基酸的负值多且分值大,亲水性明显。结合理化性质分析得到该AkSAP为非稳定亲水蛋白。
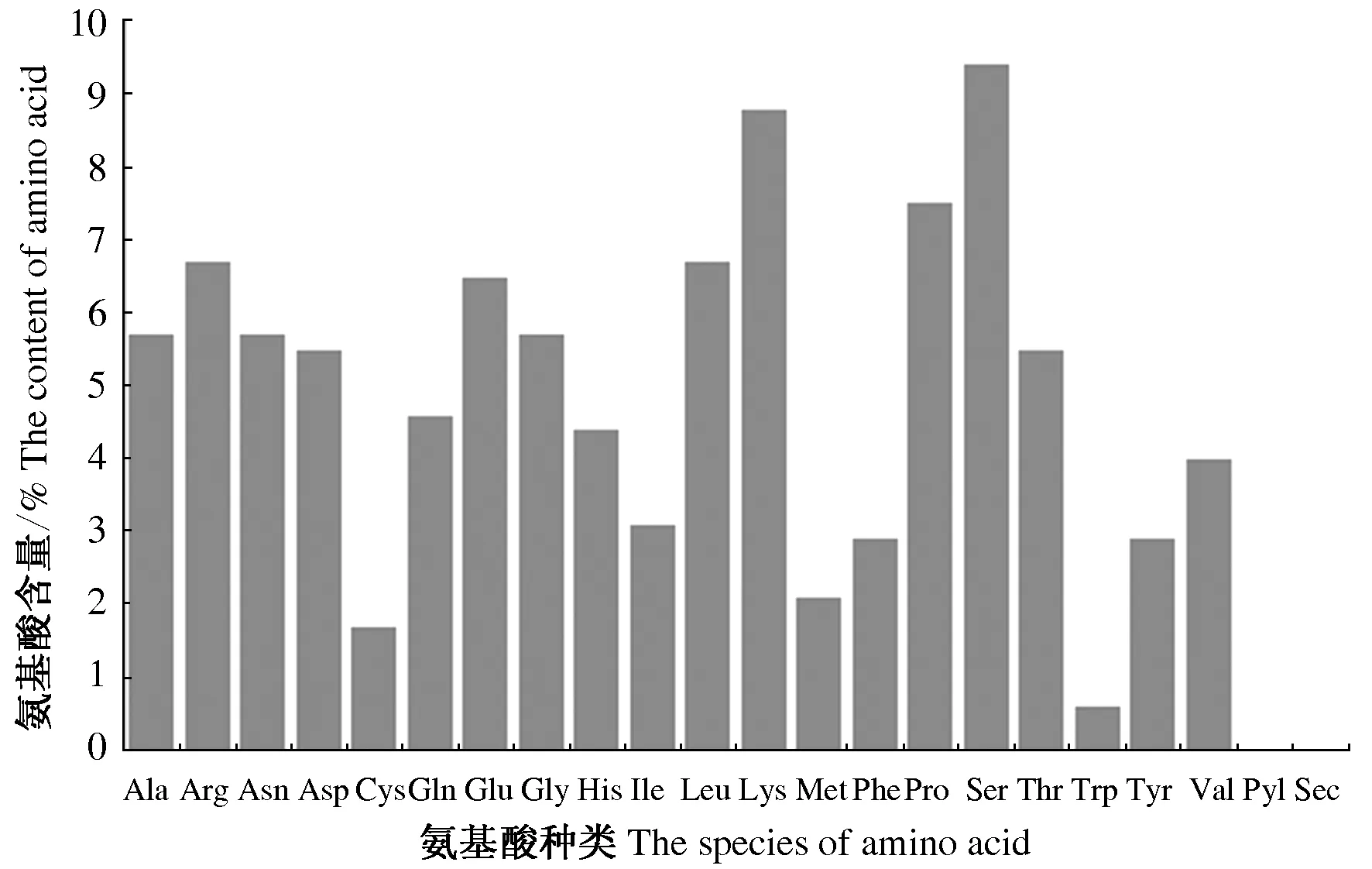
Ala:丙氨酸;Arg:精氨酸;Asn:天冬酰胺;Asp:天冬氨酸;Cys:半胱氨酸;Gln:谷氨酰胺;Glu:谷氨酸;Gly:甘氨酸;His:组氨酸;Ile:异亮氨酸;Leu:亮氨酸;Lys:赖氨酸;Met:蛋氨酸;Phe:苯丙氨酸;Pro:脯氨酸;Ser:丝氨酸;Thr:苏氨酸;Trp:色氨酸;Tyr:酪氨酸;Val:缬氨酸;Pyl:吡咯赖氨酸;Sec:硒半胱氨酸

图2 SAP亲水/疏水性分析
2.2 AkSAP信号肽和跨膜结构
信号肽常指多肽链中用于指导蛋白质跨膜转移的特殊氨基酸序列,长度大约5~30个氨基酸,其主要任务为引导蛋白质在细胞含膜的亚细胞间转移,包含信号肽的C端、N端和疏水核心区。SignalP-4.0预测AkSAP蛋白不含信号肽(图3),同时不存在跨膜结构,D值为0.103(<0.5)。

C值:原始剪切位点的分值;S值:信号肽的分值;Y值:综合剪切位点的分值
2.3 AkSAP结构域预测
通过NCBI-CDD氨基酸序列的比对,对AkSAP保守序列及蛋白家族进行预测,结果表明,AkSAP是SAP基因家族的成员(ID:10488483)(图4),其第86—116个氨基酸之间的序列区域为SAP家族的保守结构域。使用Inter-ProtScan及SMART对氨基酸序列进一步分析得出AkSAP含有SAP保守结构(图5)。

图4 蛋白保守序列分析
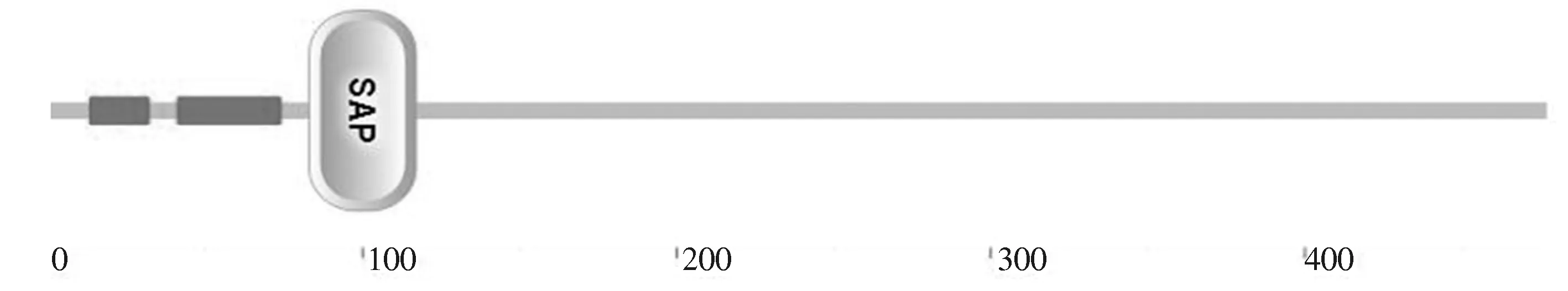
图5 AkSAP蛋白结构分析
2.4 AkSAP二级、三级结构预测
蛋白质二级结构是指肽链由氢键构成的有规则的卷曲折叠具有周期性的空间结构,使用PredictProtein对AkSAP的二级结构进行分析预测(图6),该蛋白26.21%可能会形成螺旋(Helix),9.85%可能形成延伸链(Strand),4.40%为转角(Turn),59.54%为无规卷曲(Random coil),无二硫键的形成,没有特殊的二级结构。用SWISS-MODEL对AkSAP蛋白进行三级结构的预测,结果如图7所示。
2.5 蛋白修饰位点的预测
AkSAP蛋白质磷酸化是调节和控制蛋白质活力和功能的最基本、最普遍,也是最重要的机制。通过NetPhos 3.1 Server对蛋白磷酸化位点进行预测,该蛋白存在56个磷酸化位点(图8)。蛋白质的N-糖基化修饰是生物体调控蛋白质在组织和细胞中的定位、功能、活性、寿命和多样性的一种普遍的翻译后修饰。利用NetNGlyc 1.1 Server对N-糖基化位点进行预测,该蛋白含有3个N-糖基化位点,分别在第136、396、423个氨基酸。O-糖基化是另一种重要的蛋白质翻译后修饰,O-糖链能维持所连接蛋白质部分的空间构象,采用NetOGlyc 4.0 Server对O-糖基化位点进行预测,预测分数均大于0.5的认为是阳性,故推测该蛋白含有31个O-糖基化位点。PredictProtein预测分析结果见表1。
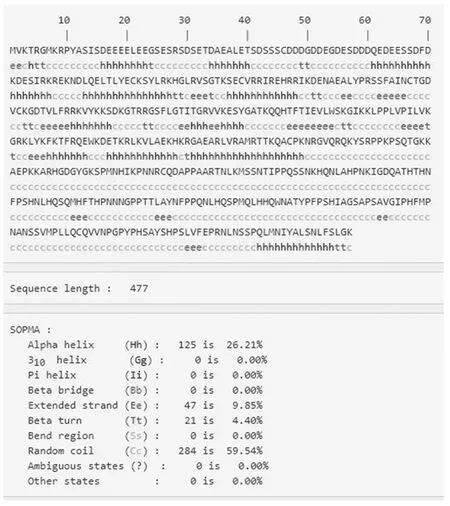
图6 AkSAP蛋白的二级结构预测
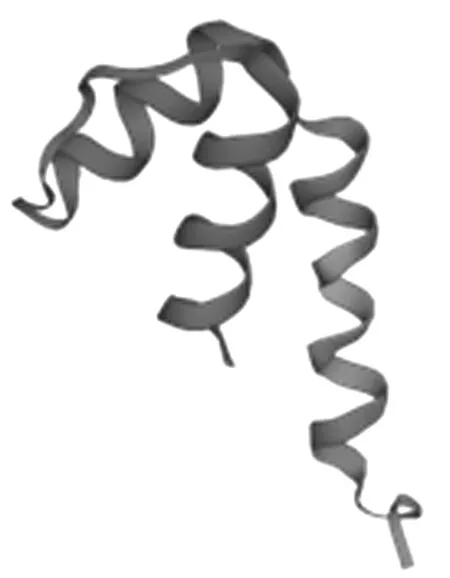
图7 AkSAP蛋白的三级结构预测
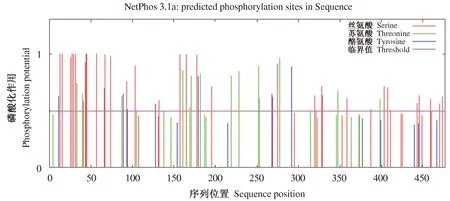
图8 AkSAP蛋白的磷酸化位点预测
表1 AkSAP蛋白修饰位点的预测
Tab.1 Prediction of AkSAP modification sites

项目ItemcAMP和cGMP依赖的蛋白激酶磷酸化位点cAMP- and cGMP-dependent protein kinase phosphorylation site蛋白激酶磷酸化位点Protein kinase C phosphorylation site酪蛋白磷酸激酶Ⅱ磷酸化位点Casein kinaseⅡphosphorylation site十四烷酰化位点N-myristoylation site酰胺化位点Amidation site位置 Site162 RRGS74 SIR157 SDK161 TRR171 TGR219 TFR228 TKR252 TTK277 TGK329 SNK13 SISD27 SRSD31 SETD44 SSCD57 SDDD67 SDFD87 TLYE105 TKSE99 GLRVSG160 GTRRGS168 GTITGR407 GSAPSA210 KGRK277 TGKK
2.6 氨基酸序列同源性对比
在NCBI数据库中分别下载中华猕猴桃变种、茶树、葡萄、麻疯树、欧洲栓皮栎、欧洲橄榄、毛桃、蓖麻、橡胶树、木薯、野李变种、梅花、樱桃、牵牛花、菟丝子、白梨、马铃薯等17种植物的SAP序列,与狗枣猕猴桃AkSAP氨基酸序列进行同源性分析,结果表明,狗枣猕猴桃AkSAP与中华猕猴桃变种亲缘关系较近(图9)。
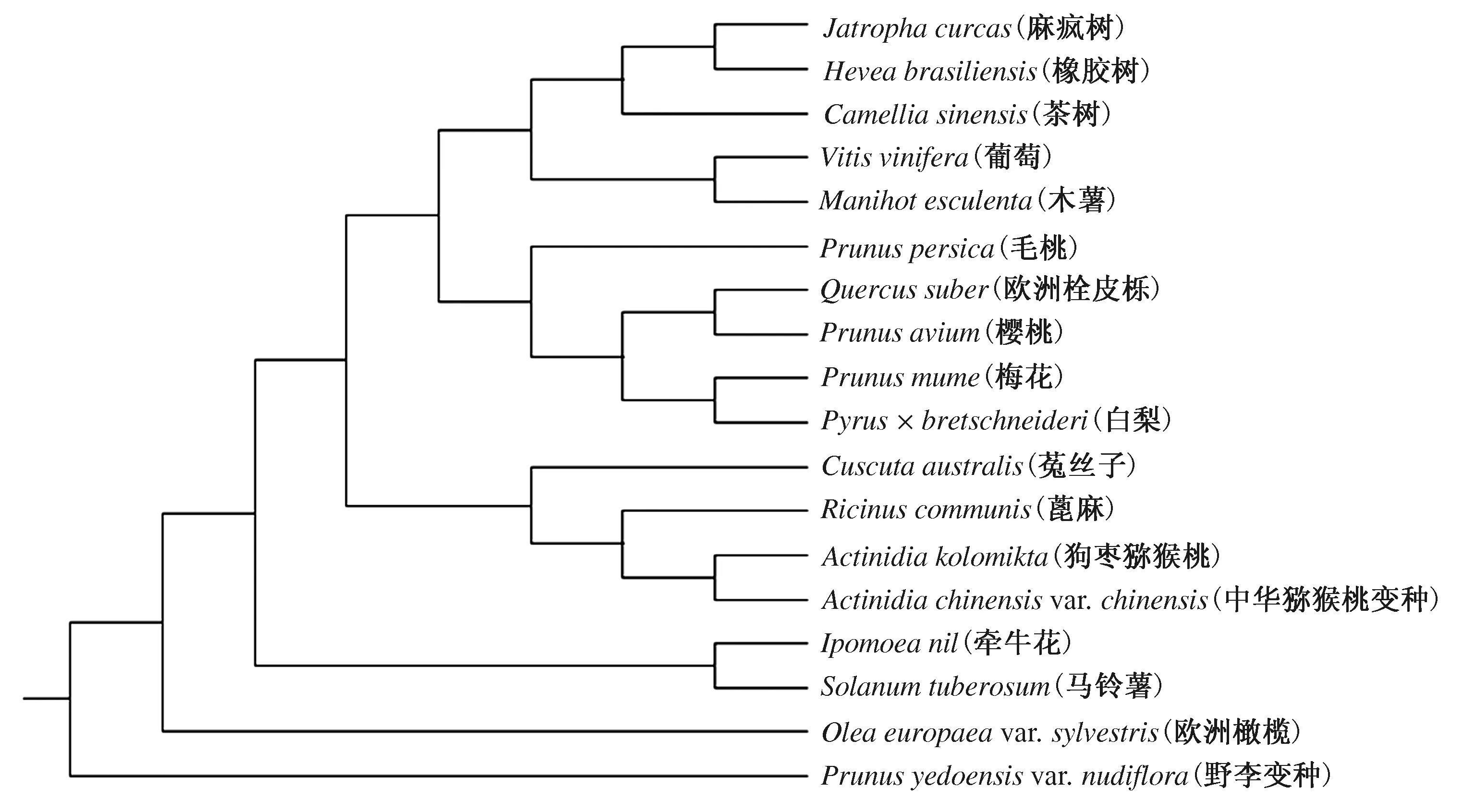
图9 SAP系统进化树分析结果
3 结论与讨论
锌指蛋白直接或间接参与植物的生长发育、根系建成、逆境响应及信号调节等生理生化过程。目前,已经从多种植物中克隆到锌指蛋白基因,如拟南芥、大豆、小麦、水稻、矮牵牛等。根据半胱氨酸和组氨酸残基的数目和位置,锌指蛋白被分为C2H2、C4、C6、C4HC3、C3HC4、C2HC、CCCH等多种类型,在植物中具有高度保守基因序列。研究发现,番茄中的13个SAP基因在冷、热、盐、干旱等非生物胁迫环境下均产生应答反应[11]。此外,水稻中的OsiSAP1在烟草中超表达,其植株在发芽率、鲜质量、叶绿素含量方面均优于野生型,同时在非生物胁迫环境下抗逆性显著[1]。本研究利用已测的狗枣猕猴桃转录组数据,筛选出狗枣猕猴桃锌指蛋白cDNA序列信息,并对其进行了生物信息学分析。AkSAP的cDNA全长为2 089 bp,CDS为1 431 bp,编码蛋白为非稳定亲水蛋白,由477个氨基酸构成,属于SAP蛋白家族成员(ID:10488483),主要构件为α-螺旋和不规则卷曲,包含锌指结构特有的SAP结构域,蛋白中丝氨酸、赖氨酸和脯氨酸含量较高,没有跨膜结构。选取17条氨基酸序列与AkSAP蛋白进行比对,经MAGA 5.1分析,AkSAP蛋白与中华猕猴桃变种亲缘关系较近。以上结果为进一步研究狗枣猕猴桃AkSAP功能提供了一定的理论基础。
