新型化合物FK106诱导白血病细胞凋亡的作用研究
2019-12-04李杰江娟丁锐邹远军郑一敏
李杰,江娟,丁锐,邹远军,郑一敏
(1.西南药业股份有限公司,重庆 400038;2.成都与康科技有限公司,四川 成都 610017;3.重庆理工大学药学与生物工程学院,重庆 400054)
急性髓系白血病(AML)是一种造血干细胞的恶性克隆性高病死率的异质性疾病[1]。AML干细胞具有自我更新能力和无限再殖潜力,对化疗药物有一定的耐药性[2-3]。因此,寻求安全、有效、稳定、可控的抗AML药物具有非常重要的现实意义。FK106为通过化学合成法制得,经紫外分光光度法(UV)、红外光谱(IR)、质谱(MS)、氢核磁共振谱(1H-NMR)和碳13核磁共振谱(13C-NMR)结构确证,确定其化学结构见图1,为一全新结构的化合物。课题组前期对其化学合成工艺及质量控制进行了相关研究,本文进一步对FK106抗白血病细胞增殖的抑制作用及其可能的机制进行了研究,现将结果报告如下。

图1 FK106化学结构
1 材料
1.1 仪器 超净工作台(苏净安泰空气技术有限公司);恒温CO2细胞培养箱(美国赛默飞公司);倒置生物显微镜(上海精密仪器仪表有限公司);酶标仪(美国赛默飞公司);高压灭菌锅(上海申安医疗器械厂);电热恒温水浴锅(国华电器有限公司);离心机(湖南凯达科学仪器有限公司);移液枪 (Eppendorf公司);流式细胞仪(美国Beckton Dickinson公司)。
1.2 试剂 胎牛血清(Merck公司);蛋白酶和青链霉素混合液(HyClone公司);台盼蓝染色液(HyClone公司);RPMI-1640 培养基(HyClone公司);DMEM 培养基(HyClone公司);生物纯二甲基亚砜(Sigma-Aldrich公司);Bcl-2(26 kDa,Abcam公司,批号:ab692);Bax(20 Da,Abcam公司,批号:ab7977);Fas(abcam公司,批号:ab82419);Capase-3(Abcam公司,批号:ab32351)
1.3 试药 FK106(含量98%以上,批号:20170303,实验室自制)。
1.4 细胞株 急性髓系白血病细胞株MV4-11(ATCC)。
2 方法
2.1 细胞培养 MV4-11细胞培养采用RPMI 1640 培养基,37 ℃、5%CO2饱和湿度下常规培养,每2~3天传代一次。
2.2 CCK-8法检测细胞活力 调整MV4-11细胞浓度为2×108个/L,细胞悬液每孔90 μL,接种至96孔板,每孔100 μL。设立对照组、药物组,每组设3个复孔,实验重复3次。加入不同浓度FK106,使最终浓度为0.1、0.2、0.4、0.8、1.0 μmol·L-1。放入37 ℃,5%CO2,湿度100%的培养箱中培养24、48、72 h。测量前每孔加入10 μL CCK-8试剂,振荡混匀,MV4-11细胞孵育1 h,巨噬细胞孵育3 h。使用酶标仪在450 nm波长检测各孔的吸光度值,结合剂量效应关系计算细胞抑制率。
2.3 流式细胞术检测细胞周期 取对数期的MV4-11细胞,以2×108个/L的密度接种,设对照组,FK106浓度设为0.2、0.4、0.8 μmol·L-13个浓度。加入不同浓度的化合物混匀,放入37 ℃,5%CO2,湿度100%的培养箱中培养48 h后,收集各组细胞,遇冷PBS洗涤2次,75%乙醇固定过夜,用PI试剂染色,预冷PBS洗涤2次,流式细胞仪分析细胞周期。
2.4 流式细胞仪检测细胞凋亡 细胞培养和处理方法同“2.3”项下,收集细胞,用冷PBS洗两次,吸去PBS。按Annexin V-FITC/PI细胞凋亡检测试剂盒说明书操作,加入Annexin V结合液重悬细胞,吹打均匀,使细胞浓度约为1×108个/L,移至流式管中,再加入5 μL Annexin V-FITC染色液,混匀,置于4 ℃避光孵育15 min后,加入10 μL PI染色液,混匀,置于4 ℃避光孵育5 min,立即用流式细胞仪检测,样本经流式细胞仪检测后,生成散点图,记录数据。
2.5 Western blot实验 细胞培养和处理方法同“2.3”项下,收集细胞,用 PBS 缓冲液冲洗2遍,加入细胞裂解液,BCA 法测蛋白浓度,加入上样蛋白缓冲液,沸水中煮沸变性,经8%聚丙烯酰胺凝胶电泳分离,转移至 PVDF膜上,室温封闭后,4 ℃孵育一抗过夜,用对应的二抗孵育后化学发光显色。
3 结果
3.1 FK106对MV4-11细胞增殖抑制率 如图2所示,FK106低浓度0.1 μmol·L-1时,对白血病细胞株MV4-11的抑制率均为10%以上,FK106高浓度为1.0 μmol·L-1时,对MV4-11的抑制率已达到90%以上。在FK106浓度0.1~1.0 μmol·L-1范围内均能抑制MV4-11细胞活力。随着FK106对MV4-11作用时间的增长,对MV4-11细胞的抑制率也随之增加,并呈浓度和时间依赖性。通过计算得出,培养24、48、72 h时,FK106对MV4-11细胞的半数抑制浓度(IC50)分别为0.491、0.419、0.358 μmol·L-1。
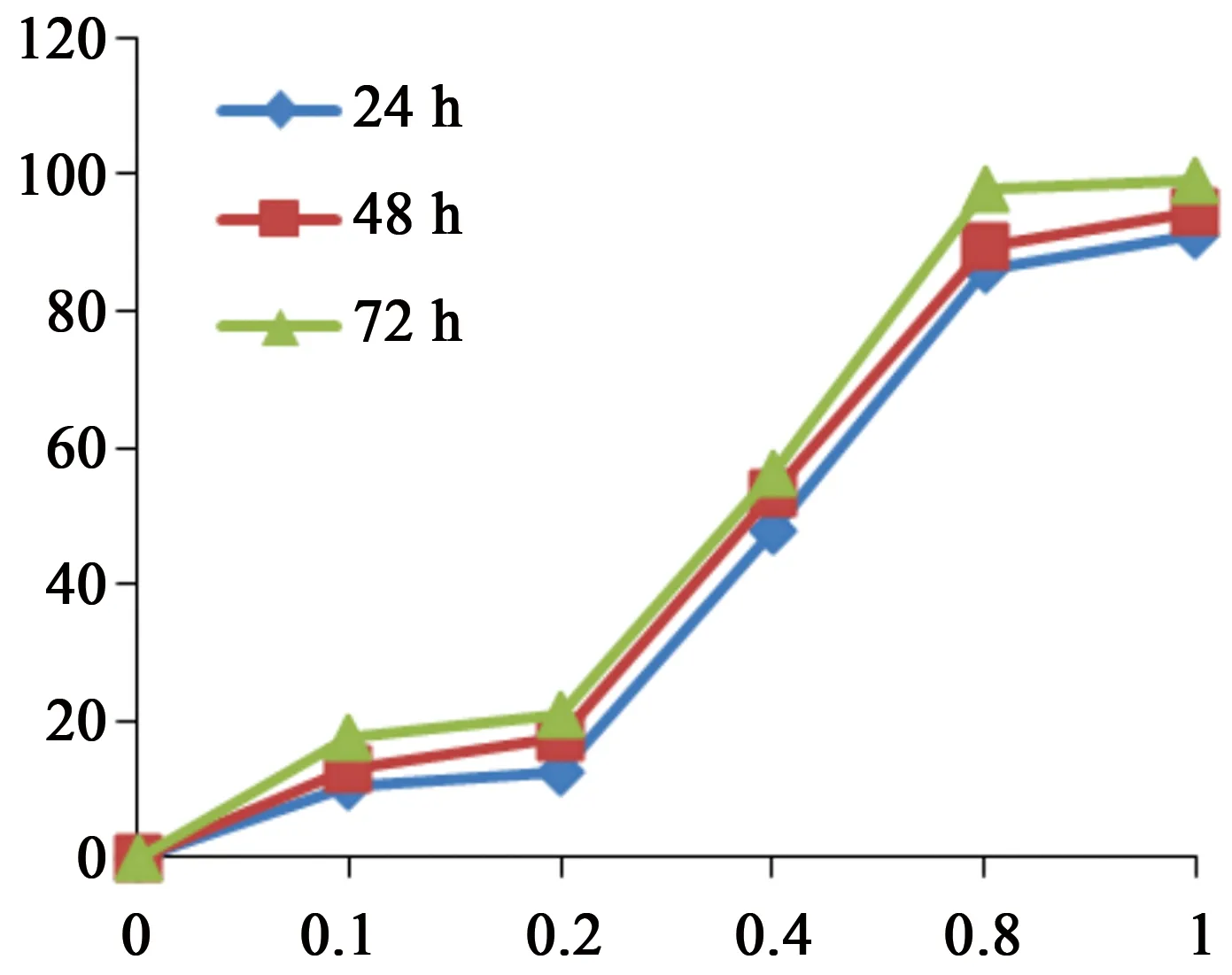
图2 FK106对MV4-11不同作用时间的细胞抑制率
3.2 FK106对MV4-11细胞周期的影响 如表1所示,不同浓度的FK106作用MV4-11细胞24 h后,细胞增殖周期停滞在G0/G1期。G0/G1期细胞比例逐渐从30.15%±1.93%(对照组)增加到49.31%±1.53%(FK106组)。结果表明,FK106通过诱导MV4-11细胞阻滞在G0/G1期抑制细胞生长。
表1 FK106对MV4-11细胞周期分布的影响
3.3 FK106对MV4-11细胞凋亡的影响 如图3所示,不同浓度的FK106作用MV4-11细胞24 h后,随着FK106浓度的增加,凋亡细胞所占的比例明显升高,并且呈浓度依赖性。

A.对照组;B.0.2 μmol·L-1 FK106;C.0.4 μmol·L-1 FK106;D.0.8 μmol·L-1 FK106图3 不同浓度FK106处理48 h对MV4-11细胞凋亡的影响
表2 不同浓度FK106处理48 h诱导MV4-11细胞凋亡率
由表2可知,FK106作用白血病细胞MV4-11 48 h后,FK106浓度0.2 μmol·L-1的总凋亡率81.76%±5.17%,其中早期凋亡率73.58%±5.12%;0.4 μmol·L-1的总凋亡率为89.88%±8.13%,其中早期凋亡率81.68%±2.35%;0.8 μmol·L-1的总凋亡率为97.97%±5.08%,其中早期凋亡率78.10%±1.07%;MV4-11细胞凋亡率呈剂量依赖性。结果证明,FK106对白血病细胞MV4-11有明显的凋亡作用。
3.4 FK106对MV4-11细胞Bcl-2、Bax、caspase-3、Fas mRNA表达的影响 如表3可知,FK106在0.2~0.8 μmol·L-1范围内处理MV4-11细胞后,Bcl-2 mRNA表达减少,呈剂量依赖性,浓度为0.8 μmol·L-1时为(0.102 3±0.001),与空白对照组比较差异显著(P<0.05);Bax mRNA表达增加,呈剂量依赖性,浓度为0.8 μmol·L-1时为(4.236 4±0.001 8),与空白对照组比较差异显著(P<0.05);Fas mRNA表达呈进行性减少,浓度为0.8 μmol·L-1时为(0.198 3±0.000 3),与空白对照组比较差异显著(P<0.05);Caspase-3 mRNA表达呈进行性增加,浓度为0.8 μmol·L-1时为(4.147 9±0.001 4),与空白对照组比较差异显著(P<0.05)。
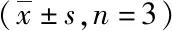
表3 不同浓度FK106处理MV4-11细胞后Bcl-2、Bax、caspase-3、Fas mRNA表达变化
4 讨论
白血病是威胁人类生命和影响生命健康的恶性造血系统疾病,其发病率居全球第6位。造血干细胞由于增殖、分化异常以及凋亡受阻等机制在骨髓和其他造血组织中大量增殖、蓄积并浸润其他非造血组织和器官,从而导致正常造血功能受到抑制,诱发白血病。细胞周期在调控细胞增殖、凋亡过程中具有重要意义[4-5]。细胞凋亡是细胞程序性死亡的过程, 凋亡细胞染色质凝集,DNA片段化,被巨噬细胞吞噬,此过程中不产生炎症反应[6-7]。Bcl-2是调节细胞凋亡的主要因子,可抑制细胞凋亡,提高细胞存活率,其作用机制是阻断凋亡信号转导的最后共同通路,从而发挥抑制凋亡作用,对正常细胞周期不产生影响[8-9]。Caspase-3是caspase家族中的一员,存在形式多为非活性酶原,在凋亡信号作用下激活, 可将细胞周期进一步阻滞,最终导致核皱缩、染色体聚集、凋亡小体形成,是细胞凋亡的执行蛋白,常用作细胞凋亡程度的评估指标之一[10]。本实验首次探讨了FK106对MV4-11的抑制作用及其机制,实验结果表明,FK106对白血病细胞MV4-11的增殖具有抑制作用,且在FK106浓度0.1~1.0 μmol·L-1范围内抑制率具有浓度、时间依赖关系;FK106能阻滞 MV4-11细胞G0/G1期;随着FK106浓度的增加,MV4-11细胞凋亡率呈现升高的趋势,细胞凋亡率呈剂量依赖性;FK106可以抑制 Bcl-2和Fas mRNA的表达,同时Bax和caspase-3 mRNA表达明显增加,以上均呈依赖性,可能通过Bcl-2和Fas途径诱导MV4-11细胞凋亡。这为临床治疗提供了实验数据和理论支持。
