新疆喀什地区维吾尔族母乳源双歧杆菌分离筛选及其益生特性分析
2019-12-04赵志霞安美玲魏小晶倪永清
赵志霞,许 翠,安美玲,魏小晶,廖 宁,倪永清*,张 艳*
(石河子大学食品学院,新疆 石河子 832003)
益生菌被定义为活性微生物,服用足够量后可赋予宿主许多益生作用[1]。目前开发使用的益生菌中,双歧杆菌(Bifidobacterium)是最常见的属。1899年法国巴斯德研究院首次从母乳喂养的婴儿粪便中分离得到动物双歧杆菌,进一步研究发现分离出的此菌可以抑制导致腹泻的蛋白水解菌,并且建议给患有该症状的婴儿服用此双歧杆菌[2]。目前,双歧杆菌作为正常的肠道微生物区系中的重要成员,通过抑制胃肠道中潜在致病菌的生长,进而诱导健康、促进全身效应而对宿主发挥有益作用[3-4]。最近研究表明,双歧杆菌对人体健康产生积极的影响,包括预防感染性腹泻[5]、改善乳糖不耐症[6]、降低血清胆固醇[7]、免疫调节[8-10]和抗癌能力[11]。
研究显示,双歧杆菌是新生儿肠道的最早定植者,但喂养方式极大地影响婴幼儿肠道中双歧杆菌的定植[12],早期母乳喂养的婴幼儿其肠道菌群中双歧杆菌为优势菌群。有研究认为,母乳不仅为婴幼儿提供了必需的营养物质(碳水化合物、必需脂肪酸、蛋白质、维生素和矿物质)[13-14],更重要的是母乳作为中间载体,通过母乳喂养将母亲的双歧杆菌等益生菌群转移给了婴幼儿[15]。因此,一般认为母乳是婴幼儿肠道中双歧杆菌的主要来源[16]。Martín等[17]首次从母乳中分离出乳酸菌,此后有研究者从不同地区的母乳中分离出双歧杆菌,例如Martín等[18]采集了23 位西班牙妇女的母乳样品,从中分离出了B. breve、B. adolescentis和B. bifidum;Sallam等[19]采集了50 份埃及妇女的母乳样品,最终仅从14 个样品中分离到了双歧杆菌。近期研究发现,母乳中双歧杆菌种群的发生、丰度高低因民族群体的地域分布、饮食习惯、遗传背景差异而显著不同,甚至一些母乳中检测不到双歧杆菌的存在。
但对于婴幼儿来说,母乳被认为是最安全的食品,开发母乳中的益生双歧杆菌作为功能食品,添加在婴幼儿配方食品中对于促进婴幼儿健康成长,辅助治疗儿童过敏性疾病、腹泻等具有巨大的潜力[20]。Arboleya等[21]通过一系列体外实验证实了母乳来源双歧杆菌的益生功能,可作为益生菌添加于新生儿奶粉配方中;从阿根廷母乳样品中分离出了动物双歧乳亚种,经过耐受性、安全性测试以及动物实验显示,筛选的双歧杆菌对肠道微生物有一定的调控能力[22]。
新疆是我国众多少数民族聚集区,维吾尔族有着独特的文化习俗、饮食习惯以及相对封闭的生存环境,为母乳中益生菌资源的开发提供了丰富来源。本研究从新疆喀什地区健康的维吾尔族哺乳期妇女母乳中分离筛选双歧杆菌,通过基因型和表型相结合的方法,对分离菌株进行鉴定,了解民族群体中双歧杆菌种群的发生;通过抑菌和模拟胃肠液耐受性实验筛选具有益生作用的优良菌株,以期为特色婴幼儿配方功能食品和其他益生菌产品的研发奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与菌株
母乳样品采集自新疆喀什市不同乡镇(克勒鲁克乡、克孜勒苏乡及伽师)不同哺乳期(初乳和常乳)的维吾尔族健康妇女。产妇皆为顺产,且在生育之后无服用任何抗生素,无乳腺炎。
采集母乳样品时首先要将产妇乳头以及乳房乳晕用肥皂水和无菌水清洗,手戴无菌手套手动将母乳样品收集在装有厌氧菌保护剂的无菌管中,挤出来的第1滴母乳被丢弃。采集之后的采样管用封口膜封口,放入-20 ℃的车载冰箱里运回实验室。
指示菌包括购自中国工业微生物菌种保存管理中心的致泻大肠埃希氏菌(Escherichia coli O127:K63 CICC 10411)、鼠伤寒沙门氏菌(Salmonella enterica subsp.enterica serovar typhimurium CICC 10420)、产肠毒素大肠埃希氏菌(E. coli O78:K80 CICC 10421)、出血性大肠埃希氏菌(E. coli O157:H7 CICC 21530)、单核细胞性李斯特菌(Listeria monocytogenes CGMCC 1.9136)、血清型肠炎沙门氏菌(Salmonella enterica subsp. enterica CGMCC 1.10754)以及前期实验室从母乳中筛选出来的条件致病菌蜡状芽孢杆菌(Bacillus cereus JM57)、粪肠球菌(Enterococcus faecalis HM69)、表皮葡萄球菌(Staphylococcus epidermidis JM92)。
1.1.2 培养基与试剂
分菌培养基为添加了0.5% L-半胱氨酸的改良MRS(deMan Rogosa Sharpe agar)培养基;HM69和JM92用MRS培养基培养;LB培养基用于培养CICC 10411、CICC 10420、CICC 10421、CICC 21530及JM57;PYG培养基用于培养CGMCC 1.9136;TSA培养基用于培养CGMCC 1.10754。
聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、ddH2O 北京康为世纪生物科技有限公司;PCR所需引物 上海捷瑞生物有限公司;Marker天根生化科技(北京)有限公司。
1.2 仪器与设备
DG520厌氧培养箱 英国DWS公司;Fresco21高速冷冻离心机 德国Thermo公司;UVmini-1240紫外分光光度计 日本岛津公司;TC-512 PCR仪 英国Techne公司;凝胶成像系统 法国Vilber公司;PowerPac Universal水平电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 双歧杆菌的分离纯化
在采集管底部吸取100 μL母乳样品,用添加有0.5% L-半胱氨酸的生理盐水梯度稀释至101、102、103,吸取100 μL各稀释液于分菌培养基进行涂布,涂布好的平皿放于厌氧箱中,37 ℃厌氧(10% H2,10% CO2和80% N2)培养48 h,用相差显微镜对单菌落进行镜检,剔除球菌,保留杆菌,对所有杆菌连续转接划线培养3 次,挑单菌落于3 mL改良的MRS液体培养基中37 ℃厌氧培养36 h,部分纯培养物进行革兰氏染色和过氧化氢酶实验,初步筛选得到疑似双歧杆菌菌株。另一部分纯培养物5 600 r/min离心10 min,弃上清液并加入新鲜的培养液重悬,补充70%的灭菌甘油,冷冻保藏于-80 ℃冰箱。
1.3.2 基于分子生物学方法的菌株鉴定
1.3.2.1 DNA提取及多重聚合酶链式反应(repetitive polymerase chain reaction,rep-PCR)指纹图谱分析
使用苯酚-氯仿-玻璃珠击打的方法提取菌株DNA[23]。采用单引物GTG5(5’-GTGGTGGTGGTGGTG-3’)对分离的菌株DNA进行PCR扩增。所有反应在25 μL体系中进行,包括:PCR Master Mix 12.5 μL,引物GTG5(10 μmol/L)1.5 μL,DNA模板3 μL,ddH2O 8 μL。扩增条件:95 ℃预变性7 min;35 次循环(94 ℃变性1 min,52 ℃复性1 min,65 ℃延伸8 min),最后72 ℃延伸16 min。PCR扩增产物经1.5 g/100 mL琼脂糖凝胶,在0.5×TAE Buffer中80 V/cm电压下电泳检测1.3 h。电泳结束后,在紫外凝胶成像仪中观察电泳结果并拍照,用软件Gel Compar II对DNA图谱进行聚类分析。DNA带型完全一致的菌株通常被认为属于同一物种,可据此将分离所得菌株归为若干种系型,并从每组中选取至少1 株代表菌株进一步测序分析。
1.3.2.2 16S rRNA基因扩增、测序及系统发育分析
经rep-PCR指纹图谱分析去重后,从每个种系型选取2~3 株代表菌株进行16S rRNA基因测序分析。采用扩增引物27f(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492r(5’-CTACGGCTACCTTGTTACGA-3’)[24]进行16S rRNA基因的PCR扩增。扩增体系及程序参照Yu Jie等[25]的方法进行。PCR产物纯化后,由生工生物工程(上海)股份有限公司测序,测序结果提交到GenBank数据库中,序列同源性分析利用BLAST在线进行。在MAGE 7.0软件中构建系统发育树。
1.3.3 双歧杆菌的表型特征
1.3.3.1 常规的生理生化实验
甲基红实验、乙酰甲基甲醇实验、硝酸盐还原实验、精氨酸产氨实验的具体方法参照文献[26]。
1.3.3.2 碳水化合物代谢谱
按文献[27]的方法测试15 株双歧杆菌对16 种碳源的利用实验,其中16 种碳源包括:单糖(阿拉伯糖、木糖、核糖、葡萄糖、甘露糖、果糖、半乳糖),双糖(蔗糖、麦芽糖、纤维二糖、乳糖、蜜二糖),三糖(棉子糖),多糖(淀粉),单糖衍生物(甘露醇、山梨糖醇)。实验重复3 次并做空白对照。
1.3.4 双歧杆菌的益生特性
1.3.4.1 双歧杆菌抑制病原菌实验
将保藏的双歧杆菌菌株以1%接种量接入改良MRS液体培养基中,37 ℃厌氧培养36 h,10 000 r/min离心5 min,取上清液,经0.22 μm滤膜过滤除菌,即得无细胞上清液(cell-free supernatants,CFS),以常见的6 种肠道致病菌及从母乳中筛选出的条件致病菌为指示菌,参照刘冬梅等[28]方法测定分离菌株的抑菌活性,配制各种指示菌所需的固体培养基,121 ℃灭菌20 min,冷却到60 ℃左右,吸取20 mL培养基加入放置好的平皿中,待其凝固后,取100 μL浓度为105CFU/mL的指示菌在平板上涂布均匀,随后每个培养皿中等距离放入4 个已灭菌的牛津杯,向每个牛津杯中加入200 μL CFS,以不加菌的MRS培养基作空白对照,放置4 ℃冰箱扩散6 h,然后在37 ℃培养24 h,若有抑菌圈出现,说明该菌株具有抑菌活性,用游标卡尺测量抑菌圈直径。每株菌做3 个平行,取平均值。
1.3.4.2 胃肠液耐受性实验
125 mmol/L NaCl、7 mmol/L KCl、45 mmol/L NaHCO3和3 g/L胃蛋白酶,用盐酸调节pH 2.5,制成模拟胃液;45 mmol/L NaCl、1 g/L胰蛋白酶、3 g/L牛胆盐,用氢氧化钠调节pH 8.0,制成模拟肠液[21]。
将活化之后的双歧杆菌按2%接种量接入改良MRS液体培养基中,37 ℃厌氧培养36 h,无菌条件下取5 mL菌液离心,弃上清液;用无菌生理盐水将菌体洗涤2 次,用500 µL生理盐水重悬菌体。将100 µL菌悬液加入900 µL模拟胃液中,在37 ℃厌氧条件下放置90 min,取样稀释涂平板,进行活菌计数,每个样品做3 个平行;另取100 µL菌悬液,向其中加入900 µL模拟肠液,37 ℃厌氧条件下放置180 min,取样,平板计数,每个样品做3 个平行;实验对照为100 µL菌悬液中加入900 µL无菌生理盐水,放置在37 ℃的厌氧箱中,分别在90 min和180 min后取样稀释涂平板,进行活菌计数,做3 次平行实验。统计结果,按下式计算存活率[29]:

2 结果与分析
2.1 双歧杆菌分离及鉴定结果
不同来源的15 份母乳中,镜检结果有167 株为杆状,经革兰氏染色及过氧化氢酶实验,有56 株表现为革兰氏阳性、过氧化氢酶阴性,疑似为乳酸菌。

图1 基于16S rRNA基因序列的双歧杆菌系统发育树Fig. 1 Phylogenetic tree of Bifidobacterium strains based on the 16S rRNA gene sequences
经rep-PCR去重,挑取得到的29 株代表菌株经16S rRNA基因测序,测序结果经BLAST在线比对,有15 株双歧杆菌分离自10 份母乳样品中,13 株属Lactobacillus,1 株属Propionibacterium。将15 株双歧杆菌与同源菌株构建系统发育树(图1)。在系统发育树中,12 株双歧杆菌被划分为3 个分支,其中B. pseudocatenulatum构成一个独立的大分支;B. breve和B. longum亲缘关系较近,分布在同一个大分支上;B. longum subsp. infantis和B. longum subsp. longum在同一个分支上,相似度达到86%。在GTG5-PCR指纹图谱(图2)中,15 株双歧杆菌被分为8 种基因型,其中B. longum subsp. infantis有2 种基因型,MK49和MK138基因型在85%的水平上相似;2 株B. breve的基因型在80%的水平上相似;2 株B. longum subsp. longum的基因型相似度较低,为65%;8 株B. pseudocatenulatum有4 种基因型,MY72-1、MY72-2和MY86-1基因型相似度达到100%,MY86-2和MY92基因型相同,另外MY75-1和MY78-2基因型相同,与MY81的基因型在80%的水平上相似。由此可以看出,16S rRNA序列系统发育树只能区分到种水平,而GTG5-PCR指纹图谱可以区分到菌株水平。
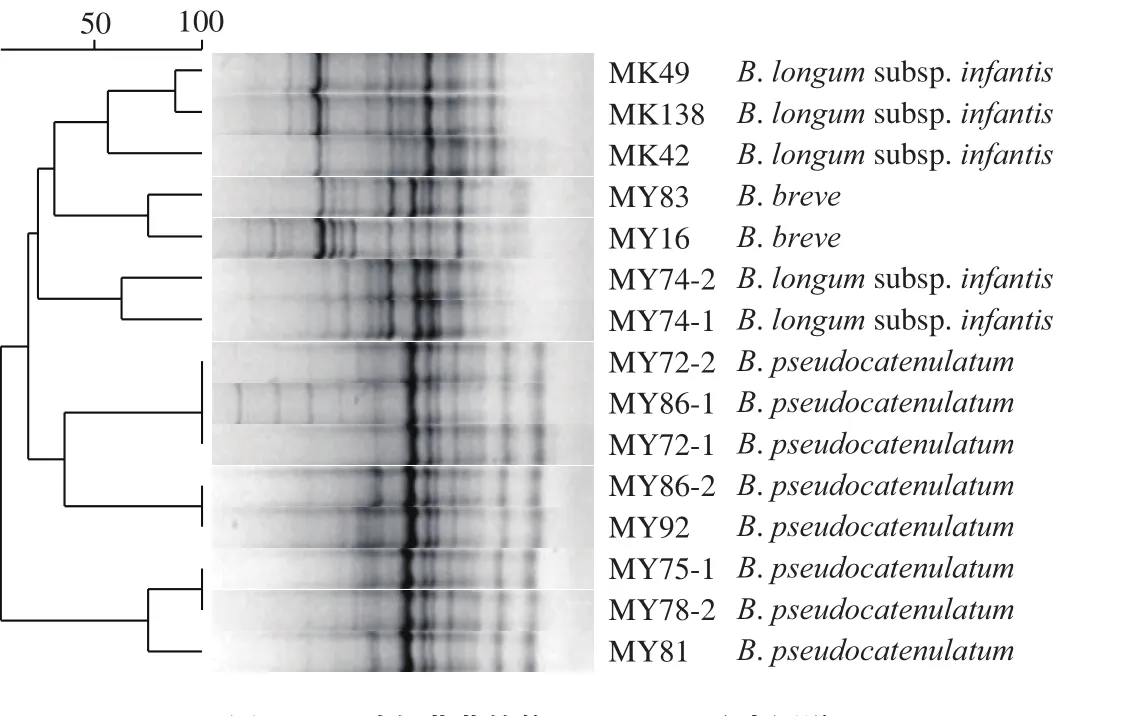
图2 双歧杆菌菌株的GTG5-PCR聚类图谱Fig. 2 GTG5-PCR clustering map of Bifidobacterium strains
2.2 双歧杆菌的表型特征
4 项生理生化实验结果显示所检测菌株都不能产硝酸盐还原酶,不能将硝酸盐还原为有害的亚硝酸盐;所有双歧杆菌均不能分解精氨酸产生氨气(表1)。不同双歧杆菌的糖代谢结果见表2,15 株测试菌株都可以代谢葡萄糖、乳糖、果糖、半乳糖和蔗糖;没有菌株能代谢甘露醇;3 个种中,只有8 株B. pseudocatenulatum能利用山梨醇;3 株B. longum subsp. infantis对碳源的利用能力与其他种(包括一个亚种)的菌株相比存在很大的差异,相对其他菌株可利用的碳水化合物少,只能利用6 种;由糖代谢聚类图可知,对于基因型相同的菌株,其碳水化合物利用能力基本相同。例如3 株B. longum subsp.infantis构成一个独立的分支;2 株B. breve对碳水化合物的利用能力相同;2 株longum subsp. longum在95%的水平上对碳源的利用能力相似;8 株B. pseudocatenulatum在糖代谢聚类分析中被分为4 个小分支,其中MY72-1和MY72-2基因型相同,对碳源的利用能力也相同;MY81与MY92基因型存在差异,但是对碳源的利用能力却相同,在Gueimonde等[30]的研究中也存在类似情况。

表1 双歧杆菌菌株的生理生化特性Table 1 Physiological and biochemical characteristics of Bifidobacterium strains

表2 双歧杆菌的碳水化合物发酵谱Table 2 Carbohydrate fermentation profile of Bifidobacteria
2.3 益生特性分析
2.3.1 抑菌特性
通过牛津杯法测定不同双歧杆菌上清液对致病菌的抑制能力(表3)。实验菌株都可以抑制产肠毒大肠埃希氏菌和单核细胞性李斯特菌;除菌株MY86-1和MY72-2之外,其余B. pseudocatenulatum菌株抑菌能力都较强,尤其菌株MY81、MY75-1、MY92及MY72-1可以抑制实验中的所有肠道致病菌,而且对母乳源条件致病菌也有很好的抑制能力,抑菌谱广;相对而言,两株B. breve抑菌能力都相对较弱,尽管MY16比MY83抑菌能力稍强;而B. longumsubsp.infantis与B. longumsubsp.longum菌株之间的抑菌能力存在着明显差异,B. longumsubsp.longum的抑菌能力相对较强。

表3 双歧杆菌菌株对指示菌的抑菌直径Table 3 Antibacterial activity of Bifidobacterium strains against indicator pathogensmm
2.3.2 耐受性实验结果

表4 双歧杆菌经模拟胃肠液处理后的存活率Table 4 Survival rate of bifidobacterial strains in simulated gastrointestinal juices
通过模拟胃肠液计算存活率检测实验双歧杆菌菌株的耐受能力,结果见表4。基本上所有测试菌株对模拟胃液都有一定的耐受能力,其中MY92在模拟胃液中具有最强的稳定性,经90 min保温处理后存活率达到了20.37%,其次是MY75-1,经处理存活率为1.157%,其他测试菌株的存活率都低于1.0%。实验结果显示,模拟肠液对菌株存活率的影响比模拟胃液更明显。所有测试菌株与模拟肠液保温培养180 min之后,存活率都低于1.0%。菌株MK49、MY83、MY72-1等的存活率低于0.000 1%,被认为不能耐受肠液。只有MY92经模拟肠液处理后存活率仍然达到0.302%,相比其他测试菌株耐肠液能力最强。综合模拟胃肠液实验结果,MY92是耐受能力最优的测试菌株。
3 讨论与结论
母乳是人类进化过程中养育后代形成的营养物质复杂的天然食品,是婴幼儿发育关键阶段最重要的营养和能量来源。同时母乳提供了婴儿免疫系统成熟、促进代谢和认知发育以及健康的肠道微生物定植所必须的各种生物活性成分[31]。研究发现,虽然母乳中金黄色葡萄球菌属(Staphylococcus)和链球菌属(Streptococcus)的丰度普遍最高,但双歧杆菌属、乳杆菌属、梭菌属和肠球菌属在母乳中的存在对婴幼儿肠道的发育成熟起到至关重要的作用[13]。最近研究报道显示,虽然母乳中乳杆菌属和双歧杆菌属丰度普遍较低,但是鉴于母乳作为婴幼儿天然的最优营养物,为安全益生菌菌株的筛选提供了最佳来源,从而对于婴幼儿配方食品的开发具有极大的潜力。
数据显示,母乳中双歧杆菌的存在和物种丰富度具有明显的地域性和人口群体差异性。比如,有人从西班牙初乳和成熟乳中分离到了B. longum、B. breve以及未鉴定的Bifidobacterium-like,其中B. longum是最常见的种类[32]。而Sallam等[19]从埃及妇女母乳中分离出了3 种双歧杆菌,包括B. bifidum、B. breve及齿双歧杆菌B. dentium,但与西班牙人母乳不同,B. bifidum是样品中最常见的种。本实验结果显示,B. pseudocatenulatum是喀什地区母乳中最常见的种,占分离菌株总数的53%。此外,对15 个母乳样品的分菌结果显示,有5 个样品中没有分离到任何双歧杆菌,此种情况在其他地区的研究报道中也存在。例如有研究者采集了20 个西班牙马德里健康妇女的母乳样品,结果仅从3 个母乳中分离到B. breve、B. longum[15];对28 份伊朗健康妇女的母乳样品的分菌结果显示,只有11 个样品中分离到B. breve、B. longum及B. bifidum[33]。显然,针对母乳中双歧杆菌种群存在的地域差异性,对其原因需要开展更深入的探究。
首先,母乳中双歧杆菌的存在虽然很重要,但相比肠道和口腔等体其他部位,细菌总丰度要低几个数量级。尤其是双歧杆菌的绝对数量更低,活菌数约达1.4×103个/mL[34];其次,双歧杆菌为严格厌氧细菌,对采样条件要求较高,采样过程严格厌氧条件保持的持久性以及菌株分离过程中培养基厌氧还原条件的维持也对双歧杆菌的分离至关重要,也决定了能否有效分离到菌株。此外,对于不同哺乳阶段母乳样品双歧杆菌的检测结果也存在明显的种类和丰度差异,甚至于有的样品中没有分离到双歧杆菌,即使采用高通量测序技术,在一些母乳样品中也没有监测到双歧杆菌[35]。因此,对于母乳中双歧杆菌的发生目前没有一致的结论,需要更广泛的取样研究。
双歧杆菌作为益生菌被广泛研究开发用于微生态制剂,对常见肠道病原细菌的抑菌性能和胃肠液的耐受性是重要的筛选标准。Arboleya等[21]对7 株双歧杆菌菌株的耐受性比较研究,菌株在模拟胃肠液中的最高存活率分别为74.5%及0.84%,而目前已经市场化认可的益生菌菌株B. lactis Bb12的耐受性存活率分别为74.5%和0.04%。本研究采用同样的胃肠液实验,15 株菌株中最强耐受性菌株为B. pseudocatenulatum MY92,其在模拟胃液中的存活率比B. lactis Bb12低3 倍,但在模拟肠液中的存活率高出7 倍。Awasti等[36]从印度健康妇女母乳、成人粪便及婴儿粪便中分离到B. pseudocatenulatum、B. breve和B. animalis的耐受性研究发现,所分离的B. pseudocatenulatum的耐受能力都相对较弱,而分离出来的3 株B. breve具有很强的耐受能力,其中耐受性最强的1 株在pH 2.0的MRS培养液中温育2 h及在含有2%胆盐的MRS培养液中温育3 h后的存活率分别可达87%和63%,这一研究结果与本研究耐受性结果存在明显的差异。而Haros等[37]对从意大利婴儿粪便中分离出来的1 株B. pseudocatenulatum的耐受性研究后发现,此菌株耐受能力较强,在含有4%胆盐的磷酸盐缓冲溶液中温育6 h后,其存活率可达8.05%。因此,双歧杆菌的耐受性强弱没有明显的种依赖性,而具有菌株依赖性。同时,由于不同研究所采用的耐受液不同导致测试菌株的耐受能力无法进行有效的比较。
统计显示,引起婴幼儿腹泻的病原体中,大肠埃希氏菌(11%)及志贺氏菌(5%)是最常见的致病菌[38]。Eshaghi等[33]研究从母乳及婴儿粪便分离出来的12 株双歧杆菌代表菌株对4 种致病菌的抑菌结果发现,分别有3/4的双歧杆菌菌株可以抑制大肠埃希氏菌及志贺氏痢疾杆菌,从而有效预防腹泻;Delcaru等[39]从健康婴儿肠道中分离到12 株双歧杆菌,从3~5 岁腹泻婴幼儿肠道中分离出7 株肠道致病菌,其中包括致泻大肠埃希氏菌和肠侵袭性大肠埃希氏菌,通过斑点法研究12 株双歧杆菌对分离出来的肠道致病菌的抑菌活性,结果发现有1/4的菌株可以有效抑制肠侵袭性大肠埃希氏菌,2/3的菌株对致泻大肠埃希氏菌有抑菌活性。本研究抑菌结果显示有2/3的测试菌株对致泻大肠埃希氏菌没有表现出抑菌活性,但所有测试菌株都对产肠毒大肠埃希氏菌有较强的抑菌能力,50%的菌株对出血性大肠埃希氏菌抑菌能力较强。其中综合抑菌活性最强的菌株是B. pseudocatenulatum MY81和MY92,它们对条件致病菌蜡状芽孢杆菌、表皮葡萄球菌、粪肠球菌也有明显的抑菌性能,因此这些菌株对预防因大肠埃希氏菌引起的婴儿腹泻及因条件致病菌引起的疾病都具有潜在的应用价值。然而,最近已发表的关于婴幼儿腹泻研究报道显示,轮状病毒也是引起婴儿腹泻的主要原因,占到总腹泻发生率20%左右。同样有研究者报道,双歧杆菌可以有效的预防轮状病毒引起的腹泻[5,40],因此本研究将进一步测试所分离双歧杆菌对轮状病毒的抑制能力。
本实验以新疆喀什地区维吾尔族母乳为研究对象,从中分离筛选到15 株可培养的双歧杆菌菌株,并通过基因型和表型相结合的方法对分离出的双歧杆菌进行了研究。此外,对15 株双歧杆菌菌株经抑菌及模拟胃肠液实验后发现,从母乳中分离出的双歧杆菌菌株均具有良好的益生菌潜力,尤其是B. pseudocatenulatum MY92,可作为潜在益生菌菌株进行系统的研究。
