不同乳糖酶酶学特性比较及在无乳糖原料奶生产中的应用
2019-12-04程凯丽胡志和张秋月吴伟捷赵旭飞贾凌云
程凯丽,胡志和*,张秋月,季 钰,王 帅,吴伟捷,赵旭飞,贾凌云
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
乳糖是以单体分子形式存在于乳中的唯一双糖,经乳腺内乳糖合成酶作用产生[1]。乳糖摄入后需要乳糖酶将其分解成单糖后才可以被吸收。由于肠道缺少乳糖酶,常引发乳糖不耐受。其最常见的症状为腹泻,如不引起重视可导致营养不良、贫血、骨质疏松等疾病[2-3]。
降低牛奶中乳糖的方法主要有物理法(主要是膜分离技术)[4]、生物法(酶法和微生物发酵法)[5-8]、基因工程法[9]。利用乳糖酶水解降低乳中乳糖含量是常用的方法。乳糖酶在动植物和微生物中分布广泛,微生物来源主要有大肠杆菌、乳酸杆菌、酵母菌和霉菌等,多数乳糖酶都采用微生物发酵生产[10-12]。源于微生物的乳糖酶,研究较多的是米曲霉和克鲁维酵母[13-14]。岳寿松等[15]对马克斯克鲁维酵母菌所产乳糖酶酶学性能进行研究,发现该酶最适反应温度和pH值分别为47 ℃和7.0;侯重文等[16]对重组米曲霉乳糖酶和原米曲霉乳糖酶酶学性对照,证明重组酶与对照酶的最适反应温度相同,虽然pH稳定性相差不大,但重组酶的热稳定要明显优于对照酶。
牛乳营养丰富,含有多种生物活性成分,是人类天然的保健食品[17]。同时,牛乳中的各种活性成分为不同类型功能性食品的开发提供了极好的天然原料来源[18]。但受乳糖不耐的影响,牛乳资源的利用受到限制。开发低乳糖或无乳糖的乳制品,对解决乳糖不耐受群体对乳的消费,以及开拓乳品市场非常必要。本研究对不同微生物来源的乳糖酶的水解特性进行研究,并应用于无乳糖原料奶制备,以期为无乳糖乳制品生产提供理论依据。
1 材料与方法
1.1 材料与试剂
原料乳和乳糖酶A、B、C 天津海河乳业有限公司;邻硝基苯β-D-半乳吡喃糖苷(o-nitrophenol β-D-galactoside,ONPG) 北京Biotopped科学技术有限公司;其他常规试剂均为国产分析纯。
1.2 仪器与设备
U-5100紫外-可见分光光度计 北京普析通用仪器有限责任公司;Bayer LactoMonitor乳糖检测仪 美国拜安捷公司;VELP旋涡振荡器 德祥科技有限公司;DK-420型电热恒温水槽 上海精宏实验设备有限公司;Heracles II电子鼻 法国Alpha M.O.S公司;ME2002电子天平 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 SDS-PAGE检测乳糖酶成分及分子质量
选择十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)的方法检测不同乳糖酶成分及分子质量,选用浓缩胶和分离胶分别为5%和12%,考马斯亮蓝R-250染色液染色。
1.3.2 乳糖酶等电点的测定
采用考马斯亮蓝G-250法[19]测定乳糖酶等电点。具体方法为:将3 种不同的乳糖酶分别称取11等份置于50 mL离心管中,加入适量的去离子水;然后分别将粗酶液pH值调至2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5和7.0,4 000 r/min离心20 min,分别取0.6 mL样品上清液于试管中,加入5.0 mL的考马斯亮蓝溶液及0.4 mL去离子水,混合后静置3 min。取上清液在595 nm波长处测吸光度。
1.3.3 乳糖酶活力的测定
采用ONPG法测定乳糖酶活力,中性乳糖酶活力参照文献[20]中的方法进行测定;酸性乳糖酶活力测定参照文献[21]方法,并做适当调整。
样品的制备:称量适量样品,精确至毫克,用反应缓冲液溶解后,转移至合适容量瓶中并定容,使得最后的溶液中含有0.027~0.095 U的酶活力。取0.5 mL稀释后的实验液,在42 ℃水浴10 min,加入已预热至42 ℃的ONPG溶液2 mL,42 ℃水浴15 min后,快速加入2.5 mL 10% Na2CO3溶液,并涡旋管以停止酶反应。反向添加ONPG底物和Na2CO3溶液作为空白,其余步骤与样品相同。30 min内,在420 nm波长处检测样品和空白液的吸光度。
1.3.4 不同条件对乳糖酶活力的影响
1.3.4.1 温度对乳糖酶活力的影响
分别在5、10、15、20、25、30、35、40、45、50、55 ℃的反应温度下测定乳糖酶活力。酶活力测定过程中每个测试样各取3 份做平行检测,取平均值(以下实验平行处理方式相同)。
1.3.4.2 pH值对乳糖酶活力的影响
在同一温度下,按1.3.3节酶活力测定方法,测定pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5和8.0条件下酶活力。
1.3.5 不同温度下储存原料奶挥发性成分分析
为确定酶解时间,分别将原料奶储存在于4、6、8 ℃和10 ℃环境中,每小时取1 次样,精确称取7.0 g样品,放入10 mL的顶空瓶中,加盖密封后在Heracles II超快速气相色谱电子鼻上进行测定分析,采用AlphaSoft V 14.2进行数据处理。Heracles II电子鼻系统采用两根并行不同极性的金属毛细管色谱柱MXT-5和MXT-1701,升温速率10 ℃/s,使用双氢火焰离子化检测器。采用正构烷烃标准溶液(n C6~n C16)进行校准,将保留时间转化为保留指数,然后通过Aro Chem Base数据库对化合物进行定性分析。
实验参数如下,顶空进样参数:加热器孵化期20 min,孵化温度50 ℃;进样量5 000 μL,进样口温度200 ℃,注射时间45 s。捕集阱参数:捕集温度40 ℃,分流10 mL/min,捕集时间50 s,最终温度240 ℃。柱温参数:初始温度50 ℃,以1 ℃/s速率升温至80 ℃,然后以3 ℃/s速率升温至250 ℃;数据采集时间110 s。检测器参数:检测器温度260 ℃。
1.3.6 无乳糖原料奶制备条件
1.3.6.1 低温下加酶量对乳糖残留量的影响
根据原料储存温度,水解温度分别设置为4、6、8、10 ℃,酶A、B和C加酶量分别为2 000、3 000、4 000、5 000 U/kg和6 000 U/kg,分别于不同时间取样测乳糖残留量。
1.3.6.2 原料奶中乳糖残留量的检测
使用乳糖检测仪,根据原料奶中含有的葡萄糖以及乳糖的含量计算出液态奶中乳糖残留量。
1.4 数据处理
每个处理设置3 个重复,结果取平均值,用Origin 95c作图,用电子鼻自带软件Alpha Soft V14.2进行主成分分析。
2 结果与分析
2.1 乳糖酶酶学特性比较
2.1.1 乳糖酶SDS-PAGE分析
3 种乳糖酶的SDS-PAGE结果见图1。经计算,乳糖酶B和C的分子质量约为130 kDa;乳糖酶A的分子质量分别约为38 kDa和55 kDa。因此,乳糖酶A含有两种成分。

图1 乳糖酶的SDS-PAGE结果Fig. 1 SDS-PAGE profiles of lactases derived from different sources
2.1.2 乳糖酶的等电点分析
将乳糖酶溶液调整至不同pH值、离心,取上清液,检测其溶解情况,进而确定其等电点。由图2可知,乳糖酶A有两个等电点,分别为4.0和5.0,这与电泳结果(图1)相符;乳糖酶B等电点为5.0;乳糖酶C等电点为3.0。虽然乳糖酶B和C的电泳结果(图1)显示具有相同的分子质量,但其等电点不同,因此,乳糖酶B和C是不同来源的乳糖酶。

图2 pH值对乳糖酶溶解性能的影响Fig. 2 Effects of pH on lactase solubility
2.1.3 乳糖酶活力测定
2.1.3.1 ONP标准曲线及3 种酶活力检测
将不同浓度的ONP溶液在波长420 nm处测定吸光度,以ONP浓度为横坐标,以波长420 nm处吸光度为纵坐标制作ONP标准曲线,可得拟合方程:Y=4.576 8X+0.007 3,R2=0.999。按照酶活力定义[20-21]为一个中性乳糖酶单位(U)定义为在实验条件下以1.30 μmol/min的速率释放邻硝基苯酚的酶量;一个酸性乳糖酶单位(U)定义为在测定条件下以1 μmol/min的速率释放邻硝基苯酚的酶量。计算乳糖酶A、B和C的酶活力分别为6 341、9 469、15 039 U/g。
2.1.3.2 温度对乳糖酶活力的影响

图3 温度对酶活力的影响Fig. 3 Effect of temperature on lactase activity
如图3所示,酶A、酶B和酶C最适反应温度分别为40、35 ℃和45 ℃,因为温度是影响酶活性的主要因素之一,通常情况下各种酶都会有其最适作用温度,在此温度下酶的活力最高。如果温度太高会影响酶蛋白的次级键,使蛋白质变性,降低其酶活性;温度过低,不利于酶的反应进程[22]。因此,温度过高或过低,酶活都有一定程度的降低。厂家提供数据显示酶A最适温度为37~40 ℃,酶B和酶C最适温度为38~40 ℃。因此,测定结果与厂家提供略有差异。
2.1.3.3 pH值对乳糖酶活力的影响
在不同pH值条件下,检测乳糖酶活力,其活力变化见图4。酶A和酶B趋势基本一致,在pH 6.5时到达最高值;而酶C在pH 5.0时酶活性最高。在实验范围内,酶活力随着pH值的增大而逐渐增强;但当pH值继续增加时,酶活力开始呈下降趋势。由于pH值对乳糖酶的活性有重要影响,在一定的pH值范围内,酶表现出较高的活性,pH值过高或过低都会影响酶的构象,从而影响酶与底物的结合能力,导致酶活降低[23]。厂家提供酶A、酶B和酶C最适pH值分别为6.5、6.5和5.0,研究结果均与3 个厂家提供信息一致;酶A和B为中性乳糖酶,酶C为酸性乳糖酶。因此,通过电泳、等电点分析,以及不同温度和pH值下酶活力的变化,3 种酶的性质不同,可能来自不同的微生物。根据3 种乳糖酶的性质不同,在制备无乳糖原料奶过程中,可采用中性乳糖酶A和B。
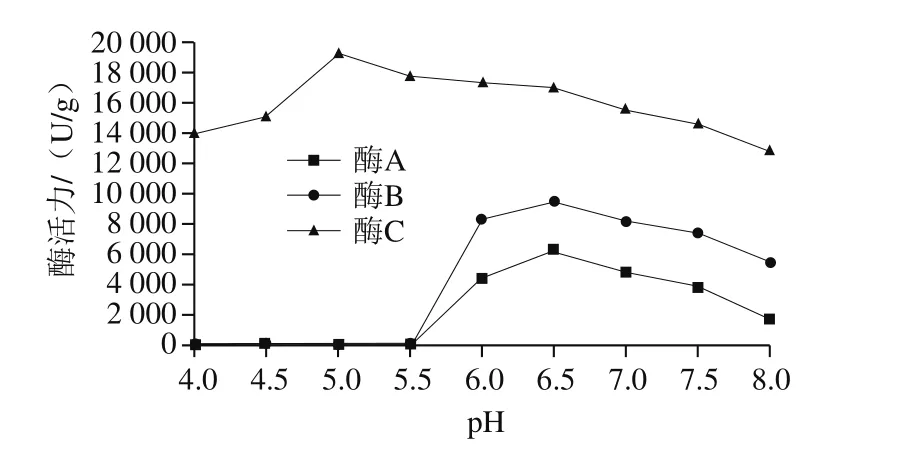
图4 pH值对乳糖酶活力的影响Fig. 4 Effect of pH on lactase activity
2.2 低温储存对原料奶气味的影响
采用电子鼻对储存期间原料奶气味变化进行分析,确定不同温度下储存时间,进而为不同温度下乳糖酶水解乳糖,制备无乳糖原料奶提供时间参数。
2.2.1 不同温度储存原料奶的主成分分析
根据Alpha MOS电子鼻数据分析规则,若主成分分析累计贡献率达到95%以上,且识别指数大于80,即可证明样品间具有显著性差异。由图5可知,4、6、8 ℃和10 ℃主成分分析,其主成分1和2的累计贡献率分别为60.274%、57.393%、53.852%、64.448%,均未达到80%;且识别指数分别为-172、-36、-178和-162,均未达到80,说明在4、6、8 ℃和10 ℃储存12 h无法区别原料奶中气味成分的变化,因此,在4~10 ℃范围内,原料奶储存12 h无显著变化。


图5 不同储存温度下的原料奶主成分分析Fig. 5 Principal component analysis of raw milk stored at different temperatures for different durations
2.2.2 不同温度储存原料奶的挥发性风味物质分析
利用电子鼻对原料奶在4、6、8 ℃和10 ℃条件下储存不同时间产生的挥发性物质进行定性分析,表1~4显示,原料奶主要挥发性物质包括:丙酮、2,3-丁二酮、2-丁酮、乙醛、月桂酸甲酯、甲硫醇、1-十九碳烯、1-壬烯-3-酮、二甲基硫醚、1-辛烯、2-乙基-6-甲基吡嗪、2-乙酰基-2-噻唑啉、乙酸等,在检出的化合物中,酮类物质最丰富。本实验的检测结果与韩清波等[24]报道结果一致。各物质间共同作用构成原料奶的挥发性风味,随着储存时间的延长,各类挥发性物质比例发生变化,乙酸、2,3-丁二酮、2-丁酮、2-乙基-6-甲基吡嗪、吲哚出现下降趋势,但整体无显著性差异。乙酸具有淡淡的酸味[25],是牛奶中的主要挥发性成分之一,不同温度下储存比例略有变化,但变化幅度不大;酮类物质多由不饱和脂肪酸的氧化、热降解或微生物代谢产生,由于温度较低,微生物代谢受抑制。因此,酮类略下降,但无显著性差异[26-28]。丙酮、2-壬酮、乙醛、月桂酸甲酯、甲硫醇、1-十九碳烯总体呈现上升趋势,整体也无显著性差异。醇类化合物主要来自脂肪氧化和氨基酸分解,有文献报道饱和醇的风味阈值较高,对整体风味贡献较小,不饱和醇的风味阈值较低,对风味贡献较大[29];2-壬酮具有果香、甜香、青香及椰子、奶油的气味;随着储存时间的延长,微生物可分解原料奶中的糖类,在各种酶参与下经过一系列催化反应,可生成醛类,醛类又可进一步生成醇类,酸与醇发生反应生成酯类。因此,月桂酸甲酯出现小幅度增长;含硫氨基酸主要是指半胱氨酸和蛋氨酸,硫醇来自牛乳中含硫氨基酸的分解[30-31],是一种具有明显风味的挥发性含硫化合物。储存过程中二甲基硫无明显变化,较为平稳,二甲基硫化物是新鲜牛奶的重要香气成分[32],微量的二甲基硫是牛奶风味的主体,且在储存的每一个阶段均可检出,但未能找到其风味阈值,故未能对原料奶储存过程中风味贡献大小进行评价[33]。

表1 4 ℃储藏条件下原料奶中挥发性风味物质Table 1 Analysis of volatile flavor compounds in raw milk stored at 4 ℃
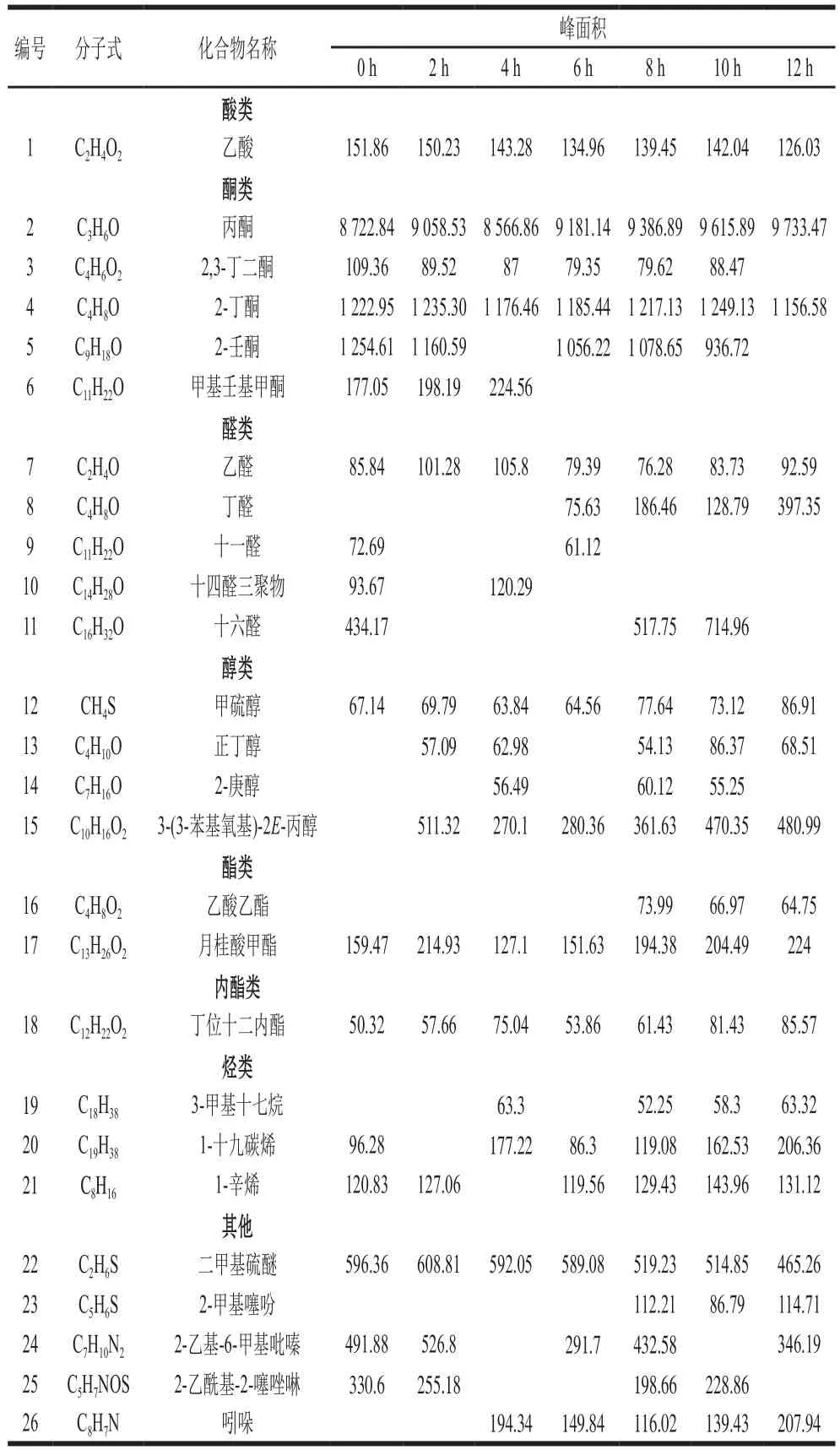
表2 6 ℃储藏条件下原料奶中挥发性风味物质Table 2 Analysis of volatile flavor compounds in raw milk stored at 6 ℃
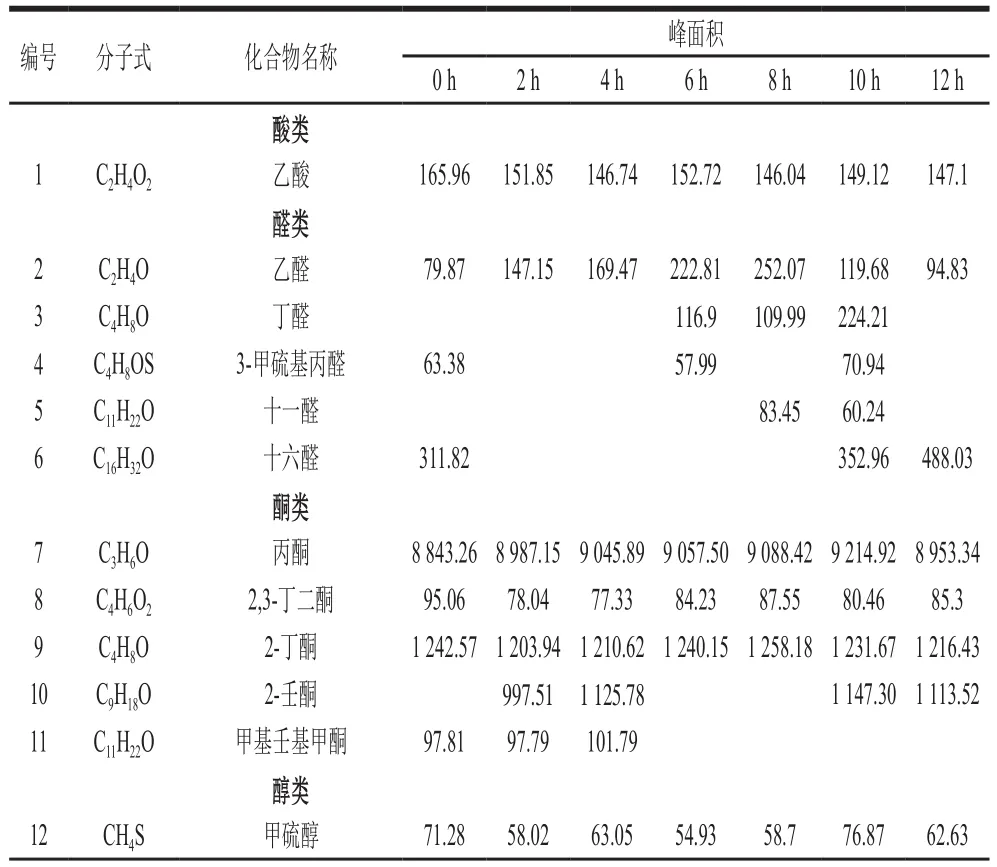
表3 8 ℃储藏条件下原料奶中挥发性风味物质Table 3 Analysis of volatile flavor compounds in raw milk stored at 8 ℃

续表3

表4 10 ℃储藏条件下原料奶中挥发性风味物质Table 4 Analysis of volatile flavor compounds in raw milk stored at 10 ℃
2.3 低温下乳糖酶添加量对原料奶中乳糖水解效果的影响
乳糖水解率是衡量乳糖水解程度的一个重要指标[34],根据2.2.1节的检测结果,低温下储存12 h,原料奶气味无显著性差异。不同量的乳糖酶A对乳糖水解结果如图6所示,原料奶乳糖质量分数为4.5%,在4 ℃条件下,当酶添加量为2 000 U/kg时,乳糖水解速率较慢,水解12 h,乳糖残留量仍不到无乳糖牛奶标准(即乳糖质量分数小于0.5%),随着温度的升高,相同加酶量下,乳糖水解效率提高,8 ℃和10 ℃分别在11 h和10 h降到0.5%以下;当酶添加量为3 000 U/kg时,不同储存温度,均可在12 h内达到无乳糖牛奶标准。同时,随着加酶量的增加,水解效率明显加快,10 ℃加酶量为6 000 U/kg时,3 h即可水解到无乳糖牛奶标准水平。伍桃英等[35]研究证明,加酶量相同,乳糖水解率与水解时间呈正相关;相同温度下,乳糖水解率随着加酶量的增加而增大。
在实际生产中,原料奶的储存温度在4~8 ℃之间,储存时间一般在5~6 h之间。在此时间内,4 ℃和6 ℃条件下,酶A添加量为6 000 U/kg;在8 ℃和10 ℃条件下,酶A添加量为4 000 U/kg,其乳糖含量即可降至无乳糖牛奶的水平。



图6 添加不同量的乳糖酶A对原料奶中乳糖残留量的影响Fig. 6 Effect of adding different amounts of lactase A on lactose residue in raw milk
在4~10 ℃添加不同量乳糖酶B,乳糖水解效果见图7。乳糖残留量降低趋势与图6基本相同。与酶A相比,酶B的水解效率较低,在4、6 ℃和8 ℃条件下,2 000 U/kg的加酶量乳糖均未在12 h内降至无乳糖牛奶水平;在10 ℃条件下,11 h时乳糖残留量才能够降至0.49%,达到无乳糖牛奶标准。因此,在实验温度范围内,温度越高,乳糖水解速度越快。低温下,0~1 h乳糖残留量降低幅度很大,1 h后降低速率减慢,这可能是随水解时间的延长,乳糖水解成葡萄糖的量增加,导致水解效率下降[36],冯永强等[37]研究无乳糖酸乳的制备时证实了乳糖酶的添加量对乳糖残留影响较大。因在实际生产中原料奶储存时间一般在5~6 h之间,8 ℃和10 ℃储存时均可选择5 000 U/kg和6 000 U/kg的乳糖酶添加量。
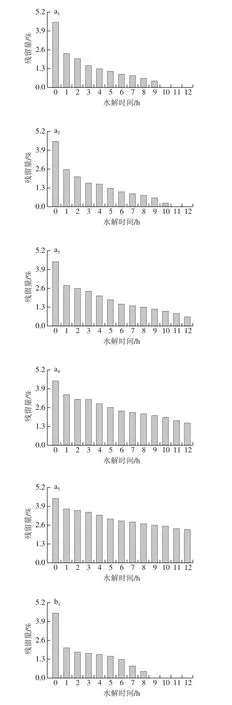
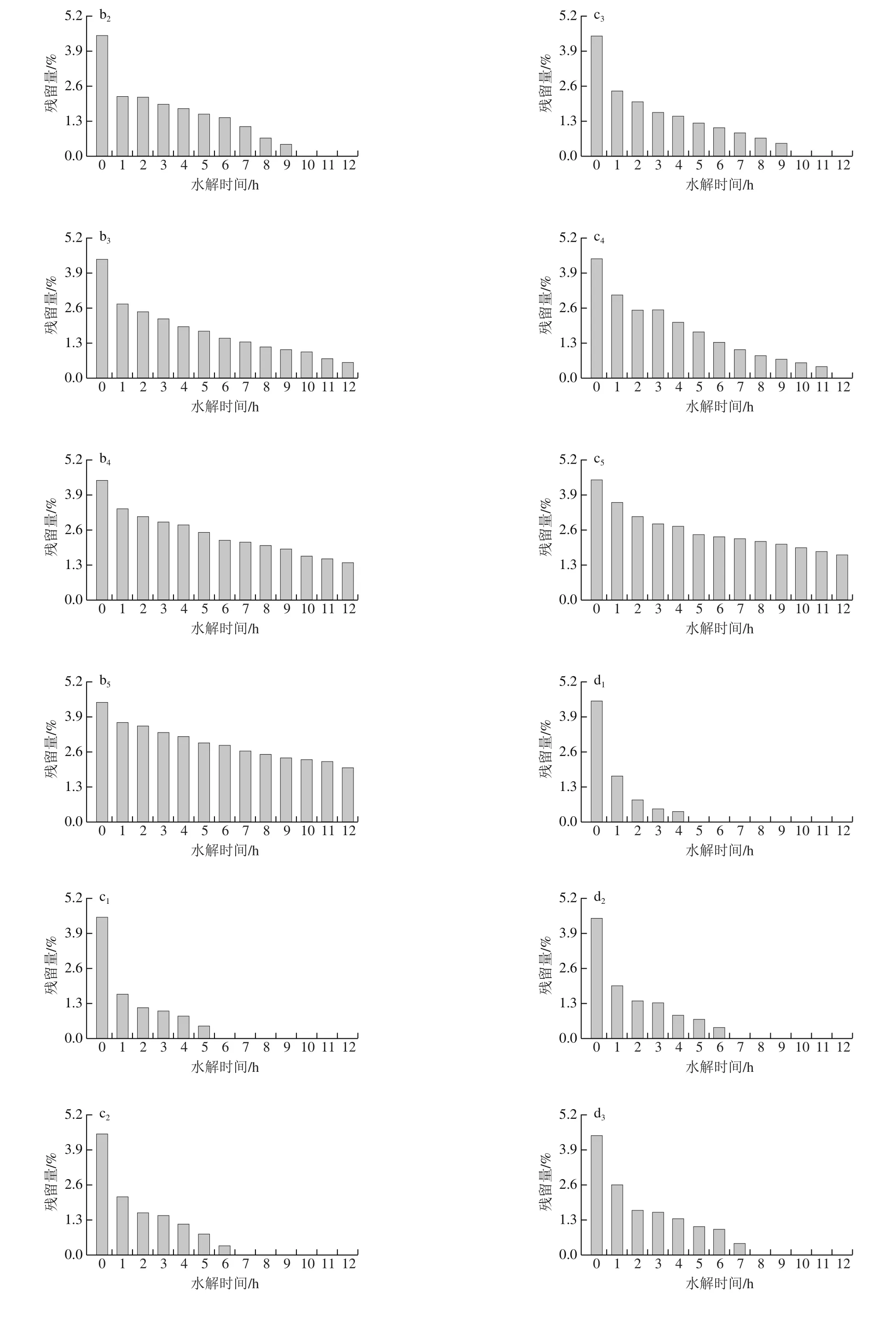

图7 添加不同量的乳糖酶B对原料奶中乳糖残留量的影响Fig. 7 Effect of adding different amounts of enzyme B on lactose residue in raw milk
3 结 论
经检测,3 种乳糖酶中,酶A和酶B为中性乳糖酶(酶活力的最适pH值为6.5),酶C为酸性乳糖酶(酶活力的最适pH值为5.0),且3 种乳糖酶来自不同微生物。在无乳糖原料奶生产中,应用中性乳糖酶A和酶B较好。电子鼻结果表明,原料奶低温储存12 h风味上无显著性差异;在该时间范围内,4~8 ℃条件下,原料奶中添加乳糖酶A或酶B,添加量6 000 U/kg,可将原料奶乳糖含量降至无乳糖水平(小于0.5%),且能够保证原料奶质量;另外,乳糖酶A的降解原料奶中乳糖的效率更好。
