抗青霉芽孢杆菌的筛选及抑菌物质分析
2019-12-04邱博书乌日娜史海粟张鹤男陈玉婷武俊瑞
邱博书,乌日娜,史海粟,张 妍,张鹤男,陈玉婷,武俊瑞*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
自然发酵豆酱是一种以大豆为原料利用微生物发酵而成的半流态传统调味品[1]。豆酱因其独特的风味,浓郁的香气和丰富的营养价值,一直广受百姓喜爱,成为餐桌上必备的佐餐食品。豆酱中复杂庞大的微生物体系是一个宝库,具有极大的开发价值。
青霉菌是引起水果蔬菜、谷物、饲料等在贮藏运输过程中发生腐败变质的主要真菌[2]。青霉菌污染严重影响了产品的外观,不仅降低产品自身的营养价值还会产生展青霉素、黄绿青霉素、青霉酸、橘青霉素[3-4]等真菌毒素,从而引发食用者急性中毒或慢性毒害,造成巨大的危害和经济损失。
目前防止食品发生由真菌引起的腐败变质主要依靠化学防腐剂,但存在毒性风险,过于频繁的使用还会导致耐药性的菌群出现。而使用生物防腐剂不但能减少对产品本身的影响还可以减少化学残留,降低对人体的危害。
芽孢杆菌是自然发酵豆酱中的优势细菌[5],对豆酱品质的形成起到至关重要的作用。芽孢杆菌能代谢产生大量酶类及抗菌物质,而且菌体本身抗逆性强,对培养条件的需求较低,有利于生物抗菌剂的生产加工[6]。目前,国内外大量研究显示芽孢杆菌可产生脂肽类、蛋白类等代谢产物对黄曲霉、青霉、灰霉等真菌具有良好的抑菌效果[7-8],但用于食品的防腐保鲜剂的生产还需对其安全性进行进一步的探究。所以,寻找来源安全、抑菌效果显著的芽孢杆菌是亟待解决的问题。本实验采用对峙培养法和琼脂柱法从自然发酵豆酱中分离出对青霉菌具有显著抑制作用的芽孢杆菌,并对抑菌物质的性质进行研究,对减少青霉菌污染引起的危害具有重要意义。
1 材料与方法
1.1 材料与试剂
自然发酵农家豆酱采自黑龙江的齐齐哈尔、大庆、佳木斯以及辽宁的康平、沈阳、辽阳、朝阳和本溪8 个地区。
细菌培养基:LB培养基(胰蛋白胨10 g/L、酵母浸粉5 g/L、NaCl 10 g/L,pH 7.2~7.4)。真菌培养基:PDA培养基(马铃薯200 g/L、葡萄糖20 g/L,自然pH值),固体培养基中加入20 g/L琼脂粉,121 ℃,20 min灭菌备用。
青霉菌(Penicillium polonicum)为实验室鉴定保藏;菌株DNA提取试剂盒及聚合酶链式反应(polymerase chain reaction,PCR)所用试剂 北京艾德莱生物科技有限公司。
1.2 仪器与设备
GMSX280手提式压力蒸汽灭菌器 北京中科路达试验仪器有限公司;QYC-200恒温培养摇床 上海福玛实验设备有限公司;Mastercycler nexus SX1 PCR仪Eppendorf中国有限公司;UVP GDS-8000凝胶成像系统美国UVP公司;Regulus 8100场发射扫描电子显微镜、HT 7700透射电子显微镜 日本日立公司。
1.3 方法
1.3.1 芽孢杆菌的分离
取1 g豆酱样品,加入到9 mL的无菌生理盐水中,充分振荡混匀,80 ℃水浴20 min,用无菌生理盐水进行10 倍梯度稀释后取0.1 mL,涂布在LB固体培养基上,37 ℃培养24~48 h,挑取单菌落进行划线纯化,对纯化得到的菌株进行革兰氏染色和芽孢染色,选择有芽孢产生的革兰氏阳性菌株进行下一步实验。
1.3.2 抗青霉芽孢杆菌的筛选
采用平板对峙法[9]初步筛选对青霉菌生长有抑制作用的芽孢杆菌,然后采用琼脂柱法[10]进行复筛并计算其抑菌率。琼脂柱法:将芽孢杆菌的发酵上清液按照1∶10(V/V)的比例添加到PDA培养基中,用6 mm的打孔器取青霉菌菌块放置在PDA培养基中央,28 ℃恒温培养,每24 h采用十字交叉法测量菌体直径,至空白对照培养皿中的菌体长满为止,抑菌率计算公式如下:

1.3.3 抗青霉芽孢杆菌的鉴定
采用试剂盒法[11-12]提取芽孢杆菌基因组DNA,利用微量紫外分光光度计检测菌株的DNA质量浓度和纯度。以芽孢杆菌菌株基因组DNA为模板,16S rDNA扩增引物选择细菌通用引物:正向引物为27f(5’-AGAGTTTGATCCTGGCTCAG-3’);反向引物为1495r(5’-CTACGGCTACCTTGTTACGA-3’)。PCR扩增反应体系(50 μL):上下游引物各2 μL(10 pmol/μL),10×PCR Buffer(含Mg2+)2 μL,Taq DNA polymerase 0.6 μL,dNTP MIX 4 μL。基因组DNA模板在反应体系内最终质量浓度为200 ng/µL,剩余的体系体积用ddH2O补齐。PCR扩增反应条件[13]:94 ℃ 、5 min预变性;94 ℃、30 s变性,58 ℃、30 s退火(复性),72 ℃、1 min延伸,30 个循环;72 ℃、10 min。PCR产物用1%琼脂糖凝胶电泳检测。将PCR产物送至上海派森诺生物医药科技有限公司测序。将测序得到的16S rRNA基因序列与NCBI数据库中标准菌株序列进行BLAST同源性进行比对。
1.3.4 扫描电镜观测青霉菌菌丝状态
将青霉菌菌丝用体积分数3.5%的戊二醛固定液固定24 h,用pH 6.8的磷酸盐缓冲溶液每20 min冲洗1 次,共冲洗5 次,后用丙酮进行梯度脱水(体积分数分别为30%、50%、70%、80%、90%、95%、100%),每次间隔15 min,其中100%丙酮重复3 次,纯醋酸异戊酯置换2 次,每次30 min。CO2临界点干燥、粘样、镀膜后在扫描电镜下观察、拍照。
1.3.5 芽孢杆菌抑制青霉菌有效成分分析
1.3.5.1 pH值对发酵上清液抑制青霉菌活性的影响
用1 mol/L HCl溶液和1 mol/L NaOH溶液调节芽孢杆菌发酵上清液pH值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0,处理12 h后再调节pH值至中性。用琼脂柱法测定经过不同pH值处理的发酵上清液的抑菌活性,以未经处理的上清液为对照,每个处理重复3 次。
1.3.5.2 温度对发酵上清液抑制青霉菌活性的影响
将芽孢杆菌的发酵上清液分别在10、20、30、40、50、60、70、80 ℃条件下处理30 min,用琼脂柱法测定经过不同温度处理的发酵上清液的抑菌活性,以未处理的上清液为空白对照,每个处理重复3 次。
1.3.5.3 蛋白酶对发酵上清液抑制青霉菌活性的影响
向芽孢杆菌发酵上清液中加入胰蛋白酶、胃蛋白酶和蛋白酶K使其最终质量浓度为1 mg/mL,37 ℃水浴处理2 h,用琼脂柱法测定处理后发酵上清液的抑菌活性,以未处理的上清液为对照,每个处理重复3 次。
1.3.6 SDS-PAGE测定抑菌物质提取物分子质量
前期实验证明80%饱和度的硫酸铵为最佳提取浓度,因此以80%饱和度的硫酸铵提取抑菌物质,并对提取物抑菌作用进行验证。然后利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrymyl gel electrophoresis,SDS-PAGE)测定抑菌提取物的分子质量大小。分离胶15%,浓缩胶5%,浓缩胶电压恒定80 V,分离胶电压恒定120 V,考马斯亮蓝染色30 min,脱色液脱色至背景色消失条带清晰[14]。
1.4 数据统计分析
2 结果与分析
2.1 抗青霉芽孢杆菌的分离及筛选
从采自8 个地区的10 份自然发酵豆酱样品中共分离出40 株菌落纯芽孢杆菌,如表1所示。将筛选出的芽孢杆菌进行穿刺保藏,以备后续实验使用。

表1 芽孢杆菌的来源及分布Table 1 Sources and distribution of Bacillus strains
将分离出的芽孢杆菌与青霉菌进行对峙实验,28 ℃培养24 h后每12 h观察一次,至培养72 h后停止,共筛选出2 株对青霉菌具有生长抑制的芽孢杆菌菌株QQHE-2和DQ1-3,如图1所示。通过观察发现对峙实验过程中QQHE-2菌株周围无青霉菌生长,而空白对照组的青霉菌孢子分散至整个培养皿,形成多个青霉菌菌落。DQ1-3菌株实验组青霉菌虽然形成了多个菌落,但在芽孢杆菌菌落周围并无青霉菌生长,可以判断出芽孢杆菌QQHE-2和DQ1-3菌株对青霉菌产生了生长抑制。由于对峙实验是两菌共生体系,所以产生上述现象的原因可能是青霉菌和芽孢杆菌2种微生物之间存在生长竞争关系,也可能是芽孢杆菌分泌的代谢产物对青霉菌的生长存在抑制效果。因此进行琼脂柱法实验,将青霉菌接种在添加了芽孢杆菌的无菌发酵上清液的PDA培养基中,观察生长状态进行进一步的探究。


图1 QQHE-2菌株和DQ1-3菌株对峙实验图Fig. 1 Confrontation of QQHE-2 and DQ1-3 against Penicillium
如图2所示,在培养72 h后,对照组青霉菌菌丝已长满整个培养皿,而含有QQHE-2菌株发酵上清液的培养皿中青霉菌的生长受到强烈抑制,经计算抑菌率高达83.42%。观察菌落发现实验组仅在接种的青霉菌菌块边缘有少量扩散,培养皿其他部位有少量菌丝生长,但颜色呈淡黄色,较对照组正常生长的菌丝相比在形态上存在很大差异。在添加DQ1-3菌株无菌发酵上清液的培养皿中有少量青霉菌生长,经计算抑菌率为46.83%。观察菌落形态发现,实验组生长的青霉菌菌落更大,菌丝更为疏松,边界不明显。而对照组的菌落较小,菌丝致密,边界清晰。总结2组实验可以推断出芽孢杆菌的发酵上清液中含有能够抑制青霉菌生长发育的物质,能够抑制孢子的萌发和菌体的生长,能够改变菌丝体的正常形态,而且3 次重复实验结果波动不大。因此QQHE-2和DQ1-3菌株为能够抑制青霉菌生长的目标菌株。
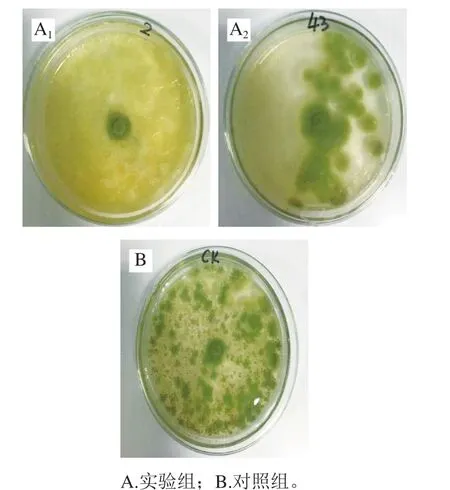
图2 QQHE-2菌株和DQ1-3菌株琼脂柱法抑菌图Fig. 2 Antimicrobial activity of QQHE-2 and DQ1-3 tested by agar column method
2.2 芽孢杆菌菌株的16S rRNA鉴定
利用微量紫外-可见分光光度计测定菌株QQHE-2和DQ1-3的DNA质量浓度和纯度,结果显示DNA质量浓度均达到200 ng/µL,且OD260nm/OD280nm值处于1.6~1.8之间,符合PCR扩增实验标准,可以进行下一步实验。用1%的琼脂糖凝胶电泳对PCR产物进行检测后发现,菌株的扩增产物在1 500 bp处有单一明亮的条带,符合测序工作的要求。将得到的基因序列与NCBI数据库中标准菌株序列进行BLAST同源性比对,结果显示QQHE-2和DQ1-3菌株皆为枯草芽孢杆菌,同源性均达到99%。利用MEGA.10.4进行序列相似性计算和系统发育分析,结果见图3。
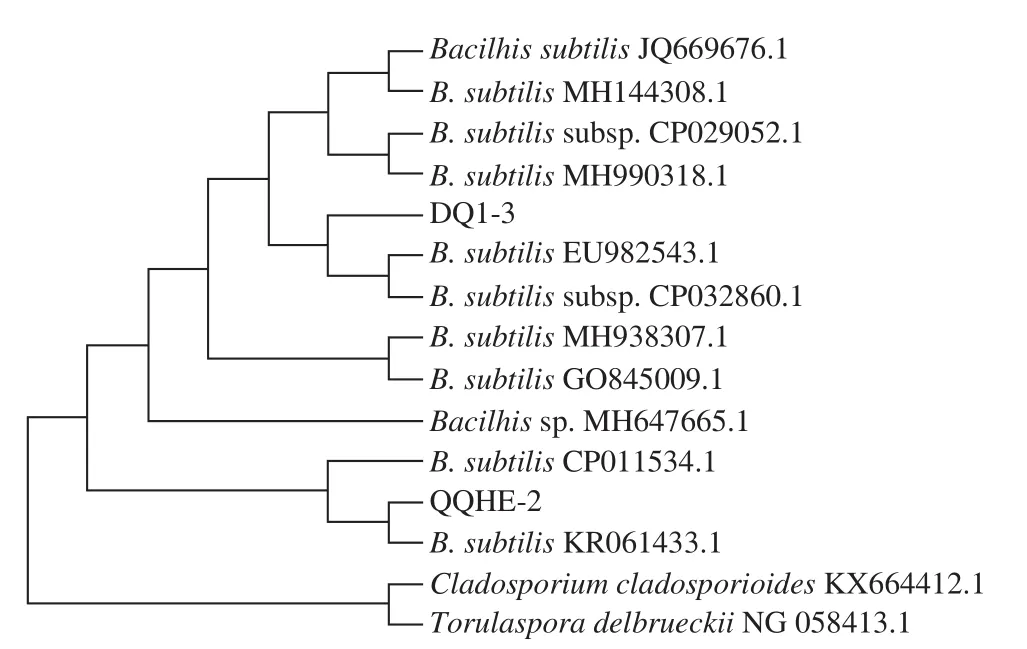
图3 菌株QQHE-2和DQ1-3菌株的16S rRNA系统发育树Fig. 3 Phylogenetic tree of QQHE-2 and DQ1-3 based on 16S rRNA gene sequences
2.3 扫描电镜观察菌丝形态
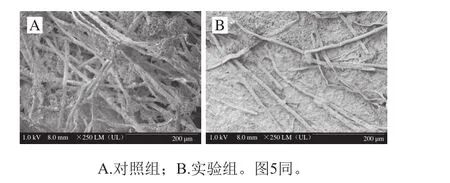
图4 菌株QQHE-2对青霉菌菌丝的影响Fig. 4 Effect of QQHE-2 on mycelial morphology of P. polonicum observed by SEM

图5 菌株QQHE-2对青霉菌孢子梗的影响Fig. 5 Effect of QQHE-2 on spore of P. polonicum observed by SEM
通过扫描电镜对青霉菌的菌丝进行观察,结果如图4所示。对照组菌丝饱满粗细均匀,表面光滑,形态较为规整,伸展良好。而实验组菌丝量与对照组有明显差距,而且菌丝干瘪细小,较为弯曲。图5为对孢子梗的观察结果,对照组孢子梗粗壮均匀,孢子分布密集,而且孢子饱满圆滑,产量丰富。而实验组孢子梗干瘪细小,而且孢子量少,孢子颗粒细小且不饱满。综上所述,芽孢杆菌QQHE-2的发酵上清液对青霉菌的生长产生了很大的影响,改变了青霉菌菌丝的生长状态,降低了孢子的产量,抑制了青霉菌的正常生长。
2.4 芽孢杆菌抑制青霉菌有效成分分析
本实验通过pH值调节、温度调节和蛋白酶处理分别对菌株QQHE-2和DQ1-3的发酵液中抑制青霉菌生长的有效成分进行了分析。已知芽孢杆菌QQHE-2和DQ1-3发酵上清液的原始pH值为7.42和7.26。如图6所示,pH值为7时两株菌发酵上清液的抑菌效果最好,随着pH值的降低,两株菌对青霉菌的抑制能力也在降低,当pH值为3时QQHE-2和DQ1-3菌株的抑菌率与pH值为7时相比分别降低了50%和60%。菌株QQHE-2的抑菌稳定性在碱性条件下稍有下降,而菌株DQ1-3在pH值高于8后抑菌率大幅下降。可见,两株菌产生的抑菌物质的酸耐受性都很低,但菌株QQHE-2抑菌能力在碱性条件下比菌株DQ1-3更稳定。
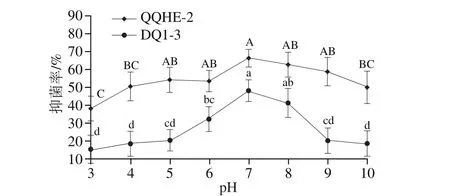
图6 pH值对芽孢杆菌发酵上清液抑制青霉菌活性的影响Fig. 6 Effect of pH on the antimicrobial activity of Bacillus culture supernatant against Penicillium
如图7所示,低温使抑菌率略有降低但并不显著,两菌株相比QQHE-2菌株产生的抑菌物质在低温条件下抑菌能力更为稳定。当温度高于40 ℃后抑菌率大幅降低,当温度为80 ℃时,抑菌率下降至20%以下,可见两株芽孢杆菌产生的抑菌物质的热稳定性较差。其中DQ1-3菌株当温度高于40 ℃后,抑菌效果显著下降,温度高于50 ℃后抑菌率低于20%,而QQHE-2菌株仍可保持40%左右的抑菌率,可见菌株DQ1-3产生的抑菌物质在高温条件下更不稳定。

图7 温度对芽孢杆菌发酵上清液抑制青霉菌活性的影响Fig. 7 Effect of temperature on the antimicrobial activity of Bacillus culture supernatant against Penicillium
如表2所示,QQHE-2菌株经胃蛋白酶和蛋白酶K处理后对青霉菌的抑菌率明显下降,而胰蛋白酶处理对其抑菌效果影响较小。而菌株DQ1-3经这3 种蛋白酶处理后抑菌活力都呈现明显下降的趋势。蛋白酶K相比胃蛋白酶和胰蛋白酶作用位点和切割范围更为广泛,结合pH值和温度的实验结果推测菌株QQHE-2和DQ1-3菌株产生的抑制青霉菌生长的有效物质为蛋白质或者肽类物质。

表2 蛋白酶对芽孢杆菌发酵上清液抑制青霉菌活性的影响Table 2 Effect of protease on the antimicrobial activity of Bacillus culture supernatant against Penicillium
2.5 SDS-PAGE测定抑菌物质提取物分子质量
以饱和度为80%的硫酸铵提取QQHE-2抑菌物质,提取物的抑菌率达75.04%,如图8所示,证明抑菌物质为蛋白类或肽类物质。将提取物进行SDS-PAGE,由图9可以看出,抑菌蛋白的分子质量约为35 kDa。
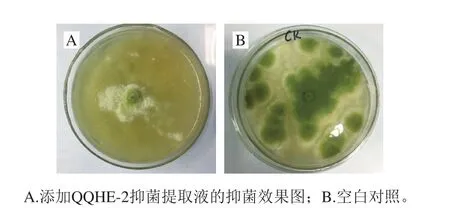
图8 提取物抑菌效果Fig. 8 Antimicrobial effect of the supernatant extract

图9 抑菌提取液SDS-PAGE结果Fig. 9 SDS-PAGE of the supernatant extract
3 讨 论
随着生物抑菌剂研究的深入,芽孢杆菌属作为抗菌剂的生产菌已得到广泛认可,正成为生物控制病原真菌生长和霉菌毒素生产的有竞争力的候选者[15-16]。芽孢杆菌能够产生不同的抑制真菌的代谢物,其中枯草芽孢杆菌和解淀粉芽孢杆菌是最知名的生物拮抗剂[17-18],一些菌株已经作为田间和饲料生产中的商业生物防治剂[19]。
目前研究表明枯草芽孢杆菌可以分泌多种高效多功能的抑菌物质,多为环脂肽类的抗菌物质,包括表面活性素、伊枯草素、芬枯草素[20-22]等,还有一部分为抗真菌蛋白类物质,如几丁质酶和葡聚糖酶[23-24]等。但一些芽孢杆菌属菌株的代谢产物具有细胞毒活性,尤其是蜡样芽孢杆菌属[25]。目前主要的益生芽孢杆菌来自于枯草芽孢杆菌属[26-27],但是有少量枯草芽孢杆菌属的菌株含有致病基因,并且大多数安全性问题是由菌株的代谢毒性引起的[28]。因此在芽孢杆菌作为生物抑菌剂应用于实际生产时不仅要进行常规的体外和动物安全性评价,还需要特别对它代谢物相关的毒性因子进行安全性评价[29]。芽孢杆菌的安全性问题对其广泛应用于食品医药行业产生了很大的限制[30]。虽然本实验是从食品级自然发酵豆酱中分离出的芽孢杆菌,来源具有一定的安全性,但还需要进行更细致的安全性评价。
本实验从自然发酵豆酱中筛选出两株对青霉菌具有良好抑菌效果的枯草芽孢杆菌,并对抑菌物质进行了初步的分析,判定抑菌有效成分为蛋白类物质,其中QQHE-2分子质量约为35 kDa,具有一定的研究价值。筛选出的QQHE-2和DQ1-3菌株在中性及碱性条件下较为稳定,作用温度低于50 ℃时抑菌效果显著。菌株代谢产生的抑菌物质适用范围较广,可以广泛应用于抑制由青霉菌引起的腐败变质。
4 结 论
本实验从采自8 个地区的10 份自然发酵豆酱样品中分离出40 株芽孢杆菌,筛选出两株枯草芽孢杆菌QQHE-2和DQ1-3对青霉菌具有显著的抑菌效果。本实验判定筛选得到菌株的抑菌成分为蛋白类物质,其中以QQHE-2抑菌效果更为显著,抑菌率可达83.42%,经SDS-PAGE测定其分子质量约为35 kDa。菌株具有广泛的应用前景,但对其作用机制还没有深入的研究,而且抑菌物质的提取纯化比较复杂,达到工业化生产有很大的难度,还需要更深入的研究。
