人Krüppel样因子3对非小细胞肺癌细胞上皮间质转化的影响
2019-12-04胡山孙威邓豫李樊孔康乐赵波
胡山 孙威 邓豫 李樊 孔康乐 赵波
华中科技大学同济医学院附属同济医院胸外科(武汉430030)
肺癌是全球癌症相关死亡的最常见原因之一[1-2]。目前肺癌治疗的各种临床进展主要包括手术切除和化疗,已取得了一定的成果[3-4]。然而晚期肺癌的预后极差,主要是由于肿瘤转移。针对肿瘤转移的分子机制是目前研究的热点及难点之一[5]。人Kruppel 样 因 子3(Krüppel-like factor 3,KLF3)是Krüppel 样因子家族的一员,在多种恶性肿瘤中表现出异常表达。研究表明KLF3 在人转移性肉瘤中失调表达,并且敲低KLF3 促进癌细胞转移[6]。在结肠癌中,二代RNA 测序分析表明KLF3 可能在结直肠癌中发挥保护作用[7]。然而KLF3 介导的调节肿瘤转移的分子机制尚不明确,KLF3 在肺癌中的作用也尚不清楚。本文以非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞A549 及H1299 为研究对象,以KLF3 敲减慢病毒作为实验工具,拟研究KLF3 在临床肺癌组织中的表达水平,并探索其在肺癌转移中的潜在作用。
1 材料与方法
1.1 试剂和细胞培养TRIzol 试剂获自上海Invitrogen 公司。A549 和H1299 购自上海生物研究所,并在补充有10%胎牛血清的DMEM 培养基中于37 ℃在含5%CO2的潮湿培养箱中培养。KLF3 敲减病毒系统和阴性对照病毒系统购自广州锐博生物有限公司。从美国CST 公司获得抗KLF3、E-钙粘蛋白和N-钙粘蛋白的抗体,抗体Vimentin、Zo-1和GAPDH 的抗体购自美国Abcam 公司。
1.2 蛋白质印迹使用临床组织标本或总细胞裂解物进行蛋白质印迹,所述组织或细胞裂解物在NP40[150 mmol/L NaCl,0.1% SDS,1% NaMoO4,1%NP40,50 mmol/L Tris-HCL(pH7.5)和0.02% NaN3]缓冲液中用蛋白酶和磷酸酶抑制剂裂解。通过SDS-PAGE 凝胶分离蛋白质样品,转移到聚偏二氟乙烯膜(PVDF,美国Millipore 公司)上。将条带与一抗在4 ℃孵育过夜后将条带与辣根过氧化物酶(HRP,武汉博世德公司)标记的二抗孵育1 h。然后通过ECL 试剂(Thermo Scientific)检查信号。
1.3 RNA 分离和定量实时PCR(qRT-PCR)用TRIzol 试剂从临床组织标本中或细胞中提取总RNA。然后,用PrimeScript RT 试剂盒(TAKARA 公司)合成cDNA。用SYBR Green Master Mix(TAKARA 公司)进行定量实时PCR(qRT-PCR)。以GAPDH 为内参基因。用2-△△CT法测定相对表达数据。在此使用以下引物进行qRT-PCR 测定:GAPDH 基因:5′-GGAGCGAGATCCCTCCAAAAT-3′(正向),5′-GGCTGTTGTCATACTTCTCATGG-3′(反向);KLF3基因:5′-TGTCTCAGTGTCATACCCATCT-3′(正向),5′-CCTTCTGGGGTCTGAAAGAACTT-3′(反向);E-钙粘蛋白基因:5′-CGAGAGCTACACGTTCACGG-3′(正向),5′-GGGTGTCGAGGGAAA AATAGG-3′(反向);Vimentin 基因:5′-GACGCCATCAACACCGAGTT-3′(正向),5′-CTTTGTCGTTGGTTAGCTGGT-3′(反向);ZO-1 基因:5′-CAACATACAGTGACGCTTCACA-3′(正 向),5′-CACTATTGACGTTTCCCCACTC-3′(反向);N-钙粘蛋白基因:5′-TCAGGCGTCTGTAGAGGCTT-3′(正向),5′-ATGCACATCCTTCGATAAGACTG -3′(反向)。
1.4 质粒构建体和稳定细胞系KLF3 的shRNA序列购自Sigma-Aldrich。使用pGKO.1-嘌呤霉素载体构建所有实验中使用的ShKLF3。使用乱序载体作为阴性对照。对于慢病毒生产,使用Lipofectamine 2000(Invitrogen)将PLKO.1-shRNAKLF3载体,包装质粒(pCMV-dr8.Z dvpr)和包膜(pCMVVSV-G)质粒共转染到293T 细胞中。72 h 后,用病毒颗粒感染肺癌细胞。通过在含有2 μg/mL 嘌呤霉素的培养基中培养细胞2 周来选择稳定的细胞系。
1.5 免疫组化染色及细胞免疫荧光检测人肺癌标本及相邻的正常标本取自我院胸外科。使用IHC 法检查KLF3 的表达。使用免疫荧光法检测上皮细胞间质转化(epithelial-mesenchymal transition,EMT)相关蛋白的表达。每个招募者获得知情同意书。本研究经本院医学伦理委员会批准。所有样品储存在液氮中备用。
1.6 划痕实验和Transwell 测定划痕实验:将细胞接种到六孔板中,密度为90%,24 h 后,用200 μL 移液管尖端制备伤口。然后,在游离血清培养基中培养细胞。在不同时间点观察伤口愈合距离。transwell 迁移测定:将细胞接种到用无血清培养基培养的上室中。下室充满补充有10%胎牛血清的完全培养基。温育24 h 后,以4%甲醇固定并用0.1%结晶紫染色。transwell 侵袭测定:将细胞接种到用基质凝胶(BD Biosciences 公司)预处理的上室中,并且用补充有10% FBS 的完全培养基填充下室。图像由显微镜拍摄。每个实验至少重复3 次独立实验。
1.7 统计学方法使用SPSS 21.0 统计软件和GraphPad Prism 5.0 进行所有统计学分析及制图。数据表示为均值± 标准差。P<0.05 为差异具有统计学意义。
2 结果
2.1 人肺癌中KLF3 表达减少首先检测人正常组织和肺癌组织中的KLF3 表达。与正常组织相比,KLF3 的蛋白质水平在肺癌中明显下降(图1A);进一步检查上述组织中KLF3 的mRNA 水平,KLF3 的mRNA 水平在肺癌组织中也明显下降(图1B)。接下来,通过免疫组织化学染色发现,与正常组织相比,肺癌肿瘤组织中KLF3 表达水平降低(图1C)。
2.2 敲低KLF3 促进肺癌细胞迁移和侵袭本研究通过慢病毒感染建立了表达shRNA-KLF3 的稳定细胞系,在H1299 和A549 细胞中通过蛋白质印迹和qPCR 测定沉默效率(图2A、2B)。划痕实验检测发现,敲低KLF3 在伤口愈合测定中显着促进细胞迁移(图2C、2E),3 次独立重复实验的平均结果见图2D、2F。与这些结果一致,在Transwell 迁移实验中,敲低KLF3 显著促进肺癌细胞中的迁移(图3A),H1299 细胞:ShKLF3 组(215 ± 23)个/视野,ShNC 组(171 ± 11)个/视野;A549 细胞:ShKLF3组(82 ± 19)个/视野,ShNC 组(51 ± 7)个/视野(图3B、3C);在Transwell 侵袭实验中,敲低KLF3 也明显促进肺癌细胞中的迁移(图3D),H1299 细胞:ShKLF3 组(52 ± 10)个/视野,ShNC 组(22 ± 5)个/视野;A549 细胞:ShKLF3 组(25± 6)个/视野,ShNC 组(8 ± 3)个/视野(图3E、3F)。

图1 人肺癌中KLF3 表达减少Fig.1 Reduced expression of KLF3 in human lung cancer
2.3 KLF3 沉默促进肺癌的EMT转移是一个多步骤的进展。EMT 被认为是转移级联中的重要步骤,并且使细胞具有迁移和侵袭能力。首先笔者通过蛋白质印记实验观察到敲减KLF3 后,与对照细胞相比,间充质标记型蛋白表达显著上升,而代表细胞上皮表型的基因表达下降(图4A)。进一步的qPCR 实验中,上述细胞中各种EMT 相关基因的mRNA 水平也有相同趋势的变化(图4B)。本研究通过普通光学显微镜观察不同处理后的稳定表达细胞系,发现shRNA-KLF3 细胞与对照细胞相比明显表现出间充质表型,如细胞的形态变得更类似于梭形,细胞周伪足增多,细胞间间隙变大(图4C)。更重要的是,免疫荧光测定提示ShKLF3 细胞表达比对照细胞更多的间充质标记物(图4D)。
3 讨论
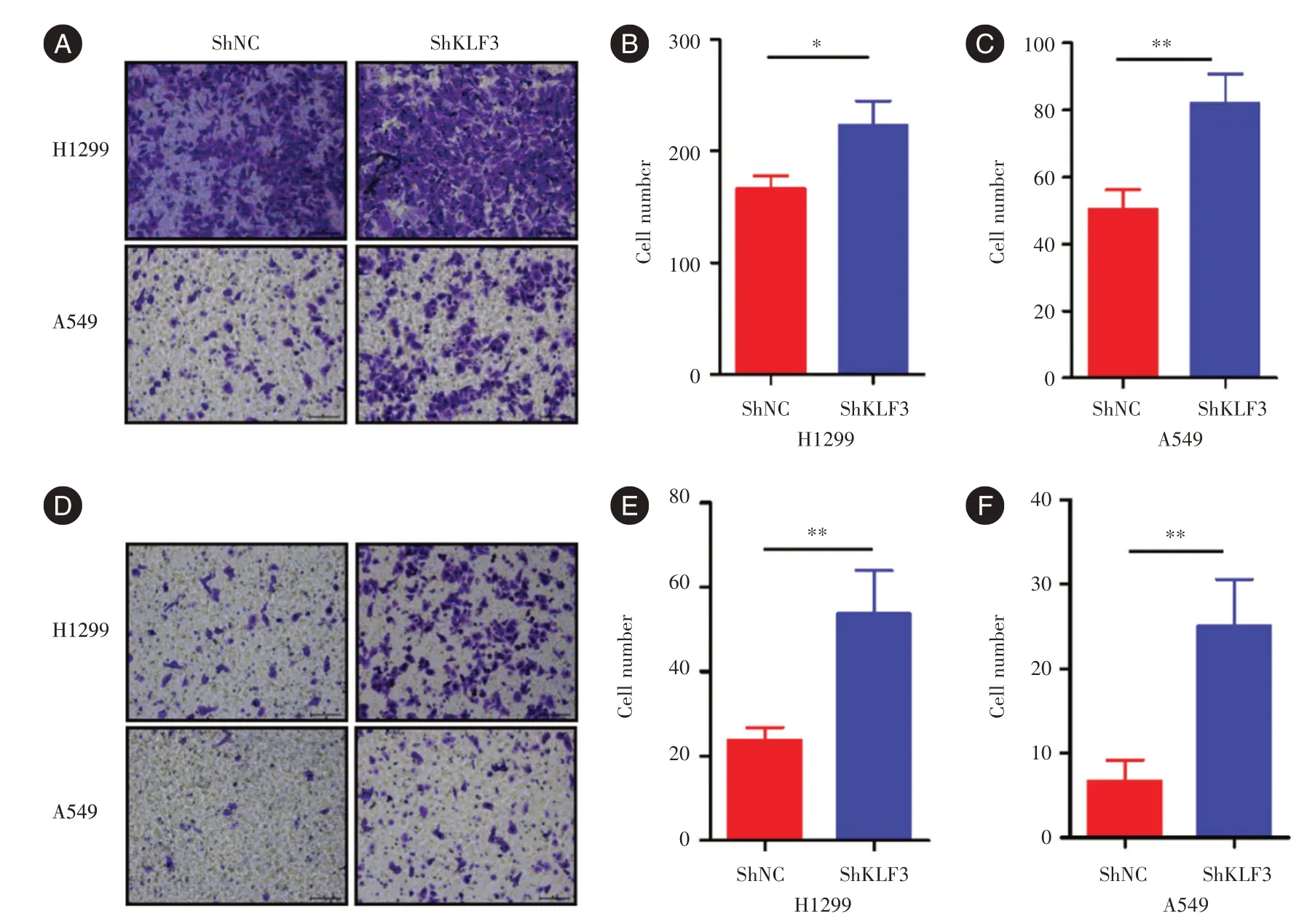
图3 敲低KLF3 促进肺癌细胞迁移和侵袭Fig.3 Knockdown of KLF3 promotes migration and invasion of lung cancer cells

图4 KLF3 沉默促进肺癌的EMTFig.4 KLF3 Silencing Promotes EMT of Lung Cancer
转移是肺癌患者预后不良的主要原因。EMT是上皮癌细胞失去细胞连接和浸润血管以转移至远处区域的关键因素[8-9]。阐明参与转移的异常信号传导途径将为治疗肺癌提供潜在的治疗靶点。EMT 是肿瘤转移研究领域的重要机制之一。越来越多的文献表明这种细胞表型的变化在肿瘤发生发展过程中发挥极其特别的作用[10-11]。在这项研究中,已经证明了KLF3 在肺癌细胞发生EMT 过程及细胞运动、迁移及侵袭转移的分子机制;此外,在肺癌组织中发现KLF3 表达降低。因此,靶向KLF3 的疗法与当前的治疗策略相结合,可能作为肺癌转移的有效治疗方法。
最近的报道[12]显示,KLFs 家族因素在肿瘤的发展中起着重要作用。例如,在结肠癌中观察到KLFs 表达下调,更有趣的是,在家族性腺瘤性息肉病患者的腺瘤中发现该蛋白质水平降低,表明KLFs 在癌症中下调可能作为预后监测的生物学标志物。既往的研究表明,多种KLFs 因子确实与转移有关[13]。例如,过表达KLF4 通过调节caveolin-1 表达抑制胰腺癌转移[14]。值得注意的是,YAN 等[15]的研究也清楚地表明KLF8 通过转录激活FHL2 促进结肠癌的发生、侵袭和转移。因此,我们进一步检查了KLF3 和EMT 水平的关联,表明KLF3 的敲减伴随着间充质标志物表达的明显升高。此外,本研究评估了对照细胞和ShKLF3 细胞之间运动、迁移和侵袭的能力。与对照细胞相比,ShKLF3 细胞中观察到运动、迁移和侵袭的能力均明显增强。这些结果表明,敲低KLF3 能够促使肺癌细胞发生EMT 的表型变化,从而更容易从原发灶脱离,进入血管发生远处转移。在本研究中的数据提示了KLF3 是肺癌转移的关键因素,KLF3介导细胞EMT、促进肺癌的转移。
总之,本研究表明KLF3 在调节肺肿瘤转移中的重要作用。本研究的数据表明,KLF3 表达与临床中的肺癌发展密切相关,敲低KLF3 介导的肿瘤转移调控与EMT 相关。更重要的是,本研究为肺癌中的KLF3 信号通路提供了新的见解,提示KLF3 可能作为预后不良的诊断标志物,也可能是肺癌转移患者的潜在治疗靶点。
